超声辅助酶解法提取亚麻籽油的工艺
2020-05-24高瑞苑尹三毛李志英张海容
高瑞苑 尹三毛 李志英 张海容
(忻州师范学院化学系,忻州 034000)
亚麻籽俗称胡麻籽,是亚麻科的一年生或多年生草本植物亚麻的种子,其中含有不饱和脂肪酸,以及蛋白质、膳食纤维、维生素、微量元素等多种对人体有益的成分,适用于人体保健[1,2]。亚麻籽中含油率达35%~48%,亚麻籽油中不饱和脂肪酸的质量分数达80%以上,并且富含α-亚麻酸、维生素E、类黄酮[2,3]。α-亚麻酸是人体的一种必需脂肪酸,具有丰富的药理作用[4,5],在体内能转化成DHA,对智力和神经系统发育大有裨益。
目前,国内外亚麻籽油的提取方法主要有压榨法、溶剂浸提法、生物酶法、超临界萃取法等[6,7]。压榨法分为冷榨和热榨,压榨全过程无任何化学添加剂,但冷榨法出油率低,热榨相对于冷榨法出油率较高,但油色泽较暗。溶剂浸提法提油率较高,多利用有机溶剂,溶剂用量较大,增加加工成本[6]。超临界萃取需要在高压的条件下进行,这对设备及工艺技术的要求极高,也使生产成本增加[7]。生物酶法提油是最近油脂工业的研究热点,本实验通过酶解将组织结构和大分子物质破坏,再利用超声波辅助法进一步破坏细胞组织,使细胞中的游离油流动性增强,从而提高提取率[8]。
本实验利用纤维素酶和碱性蛋白酶将亚麻籽细胞壁、多糖及脂蛋白分解,在此基础上,利用超声波辅助进一步将亚麻籽细胞组织结构破坏,使油脂能够充分的溶出[9]。结合酶本身的特点及超声波的使用条件,确定料液比、加酶量、保温温度、保温时间、pH、超声时间及超声功率作为单因素考察变量,以亚麻籽油得率为响应值,采用Box-Behnken响应面分析法,对影响较大的因素:料液比、加酶量、保温温度、pH、超声时间进行分析,确定最佳的提取条件,以期优化亚麻籽油提取工艺。
1 材料与方法
1.1 材料与试剂
亚麻籽:产地为山西省神池县烈堡乡;碱性蛋白酶,酶活力 200 U/mg;纤维素酶,酶活力50 U/mg;果胶酶:3 000 000 U/g;正己烷、氢氧化钠、盐酸均为分析纯。
1.2 实验仪器
100Y多功能粉碎机;pHS-3C酸度计;TDL-40B离心机;HH-6SH数显恒温水浴锅;KQ-400KDE型高功率数控超声波清洗器;RE-52AA旋转蒸发器。
1.3 实验方法
1.3.1 超声酶法提取亚麻籽油的工艺流程
亚麻籽原料→脱胶→烘干→粉碎过筛(60目)→加沸水→调节pH→加酶→超声→保温浸提→离心分离(4 000 r/min,10 min,取上清液)→萃取(取上层液体)→旋蒸→亚麻籽油。
1.3.2 脱胶处理方法
首先对亚麻籽进行脱胶处理[10],先清理掉亚麻籽中的空壳,碎粒,发霉的种子,以及石子、杂草等杂质。取处理好的亚麻籽500 g置于烧杯中,加入3 g果胶酶,水浴加热到40 ℃,搅拌均匀,保温30 min,用纱布过滤,除去亚麻籽表面的胶,再用40 ℃的清水清洗几次,充分将亚麻籽表面的胶去除。放入干燥箱中60 ℃下烘干,粉碎,得亚麻籽粉末。
1.3.3 亚麻籽油提取及得率计算方法
取15 g脱胶后的亚麻籽粉末,加入一定量的沸水,搅拌均匀。待料液冷却后,调节至所需pH。加入碱性蛋白酶,水浴保温十分钟,再加入纤维素酶,超声。然后4 000 r/min下离心10 min,取上清液,用正己烷萃取,旋蒸,得亚麻籽油,干燥、称重。
1.3.4 单因素实验
考察料液比、加酶量、提取温度、酶解pH、超声时间、超声功率各自对亚麻籽油得率的影响。选取料液比1∶5、1∶10、1∶15、1∶20、1∶25,加酶量0.05、0.1、0.15、0.2、0.25 g,提取温度30、40、50、60、70 ℃,酶解pH 4、5、6、7、8、9、10、11,超声时间10、20、30、40 min,超声功率160、240、320、400 W,进行单因素考察实验,通过计算亚麻籽油得率,确定响应面分析实验范围,进而优化提取亚麻籽油的工艺条件。
2 结果与分析
2.1 单因素实验
2.1.1 料液比对亚麻籽油得率的影响
准确称取亚麻籽粉末15 g,分别按料液比1∶5、1∶10、1∶15、1∶20、1∶25加入煮沸的蒸馏水,不断搅拌,待料液冷却,再加入碱性蛋白酶和纤维素酶各0.15 g,提取温度40 ℃,超声时间10 min,超声功率200 W,条件下提取,得到料液比对亚麻籽油得率的影响如图1所示。
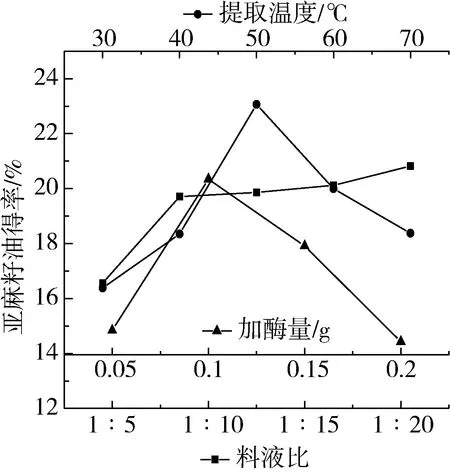
图1 料液比、加酶量、提取时间对亚麻籽油得率的影响
由图1可知,亚麻籽油得率随料液比的增加而增加,当料液比超过1∶10后提油率增长缓慢,可能原因是随着料液比的增加,酶与亚麻籽原料能够充分接触,酶解更加充分,使油脂更易溶出,随着料液比继续增加时,因为酶解作用有限,亚麻籽油得率增加不明显[11]。故选择合适的料液比为1∶10。
2.1.2 加酶量对亚麻籽油得率的影响
准确称取亚麻籽粉末15 g,加入150 mL沸水,不断搅拌,待料液冷却,分别加入碱性蛋白酶和纤维素酶各0.05、0.10、0.15、0.20 g,在超声时间10 min,超声功率200 W,提取温度40 ℃,条件下提取,得到加酶量对亚麻籽油得率的影响如图1所示。
由图1可知,随着加酶量的增加,亚麻籽油得率增加,但是在超过0.1 g以后,得率开始下降。可能原因是,随着加酶量的增加,酶水解细胞组织的效果增加,使得细胞中的大分子蛋白质、糖类等水解彻底,有利于细胞内油脂的释放,从而亚麻籽油的得率增加,随着加酶量的继续增加,料液中酶解后产生的小分子成分增加,使得游离的油脂与料液不易分离彻底,从而使得亚麻籽油得率降低[12]。故选择合适的加酶量为0.10 g。
2.1.3 提取温度对亚麻籽油得率的影响
准确称取亚麻籽粉末15 g,加入150 mL沸水,不断搅拌,待料液冷却,分别加入碱性蛋白酶和纤维素酶各0.10 g,在超声时间10 min,超声功率200 W,提取温度为30、40、50、60、70 ℃,条件下提取。得到不同提取温度对亚麻籽油得率的影响如图1所示。
由图1可知,随着温度的升高亚麻籽油的得率增加,但在超过50 ℃以后,得率开始下降,可能原因是,纤维素酶和碱性蛋白酶的最适温度45 ℃,在达到酶活性的最适温度之前,随着温度的升高,酶活性增加,酶解作用增强,亚麻籽油得率增加,但在超过酶活性的最适温度后,酶的活性开始降低,导致亚麻籽油的得率下降[13]。故选择合适的提取温度为50 ℃。
2.1.4 酶解pH对亚麻籽油得率的影响
准确称取亚麻籽粉末15 g,加入150 mL沸水,不断搅拌,待料液冷却,调节pH为4、5、6、7、8、9、10、11,加入碱性蛋白酶和纤维素酶各0.10 g,在超声时间10 min,超声功率200 W,提取温度50 ℃,条件下提取,得到酶解pH对亚麻籽油得率的影响如图2所示。
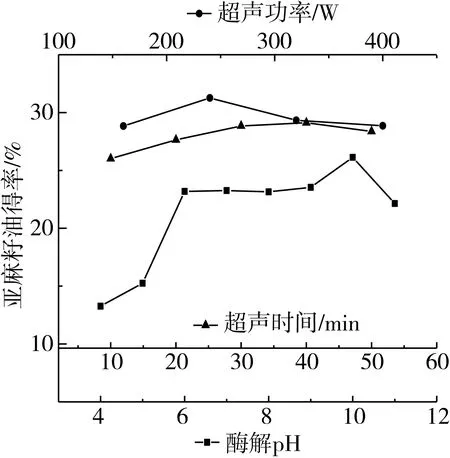
图2 酶解pH、超声时间、超声功率对亚麻籽油得率的影响
由图2可知,pH由4~6时,纤维素酶发挥主要作用,随着pH的升高亚麻籽油的得率增加,这与纤维素酶的活性随pH变化有关,pH为6时,纤维素酶活性最大。pH由7~10时,碱性蛋白酶发挥主要作用,随着pH的升高亚麻籽油的得率增加,这与碱性蛋白酶的活性随pH变化有关,pH为10时,碱性蛋白酶活性最大,pH超过10以后,碱性蛋白酶活性下降,得率下降,pH通过影响酶的活性进而影响亚麻籽油的得率[6]。故选择合适的酶解pH为10。
2.1.5 超声时间对亚麻籽油得率的影响
准确称取亚麻籽粉末15 g,加入150 mL沸水,不断搅拌,待料液冷却,调pH至10,加入碱性蛋白酶和纤维素酶各0.10 g,在超声功率200 W、提取温度50 ℃,改变超声时间20、30、40、50 min,条件下提取,得到超声时间对亚麻籽油得率的影响如图2所示。
由图2可知,随着超声时间的升高亚麻籽油的得率增加,但在超过40 min以后,得率开始下降,可能原因是,随着超声时间的增加,细胞组织被破坏的更加充分,有利于酶解的进一步作用,使得游离油流动性增强,更易溶出,从而提高了亚麻籽油的得率,随着超声时间的继续增加,细胞释放油脂分子的速度和油脂分子的扩散速度达到动态平衡,游离油与料液的混合度增加,使得游离油的分离困难,造成部分油脂难以彻底分离,使得亚麻籽油的得率降低[14]。故选择合适的超声时间为40 min。
2.1.6 超声功率对亚麻籽油得率的影响
准确称取亚麻籽粉末15 g,加入150 mL沸水,不断搅拌,待料液冷却,调节pH至10,分别加入碱性蛋白酶和纤维素酶各0.10 g,在超声时间40 min,提取温度50 ℃,改变超声功率160、240、320、400 W,条件下提取,得到超声功率对亚麻籽油得率的影响如图2所示。
由图2可知,随着超声功率的升高亚麻籽油的得率增加,但在超过240 W以后,得率开始下降,可能原因是,随着超声功率的增加,细胞组织被分解的更加彻底,细胞组织释放油脂分子的速度和油脂分子的扩散速度不断增加,当达到一定值后达到动态平衡,油脂的产量不再增加,但随着超声功率的继续增加,亚麻籽细胞结构破坏更加彻底,亚麻籽颗粒粉末度加大,这就增加了混合油分离的难度和部分油脂的损耗,使得亚麻籽油的得率降低[15]。故选择合适的超声功率为240 W。各单因素实验除超声功率外,不同条件对亚麻籽油得率的影响范围在3.11%~12.87%之间,不同超声功率对亚麻籽油得率的影响范围为2.43%<3.11%,因此,超声功率没有列入响应面因素中。
2.2 响应面分析
2.2.1 响应面实验设计及结果
在单因素实验基础上,利用Box-Behnken中心组合实验设计原理,采用Design-Expert软件设计五因素三水平的响应面分析实验。选择料液比(A)、加酶量(B)、提取温度(C)、酶解pH(D)、超声时间(E)为自变量,亚麻籽油得率(Y)为响应值。响应面因素水平及编码见表1,响应面实验设计及结果见表2。

表1 响应面实验设计因素水平及编码
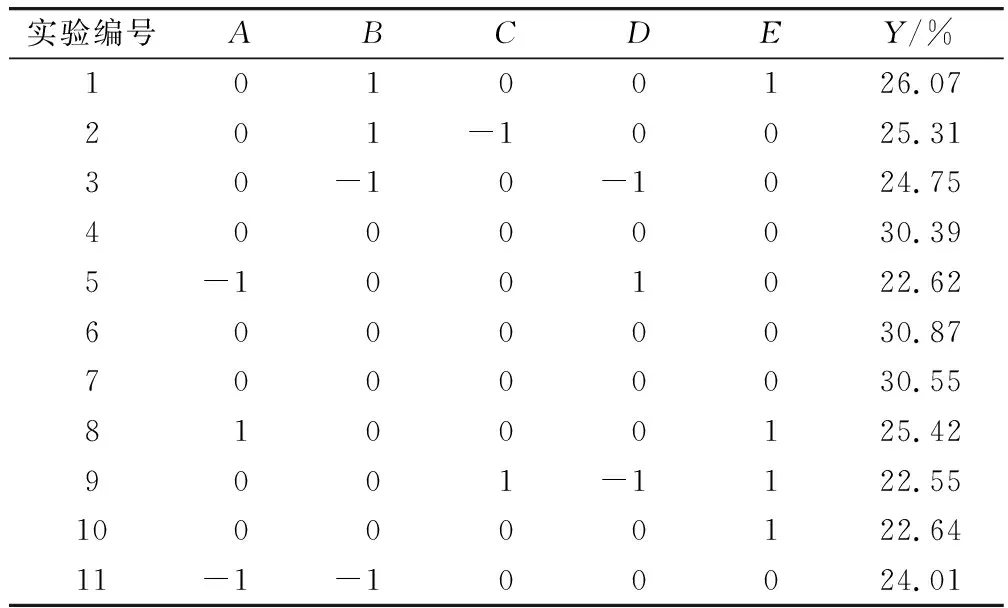
表2 响应面实验设计及结果
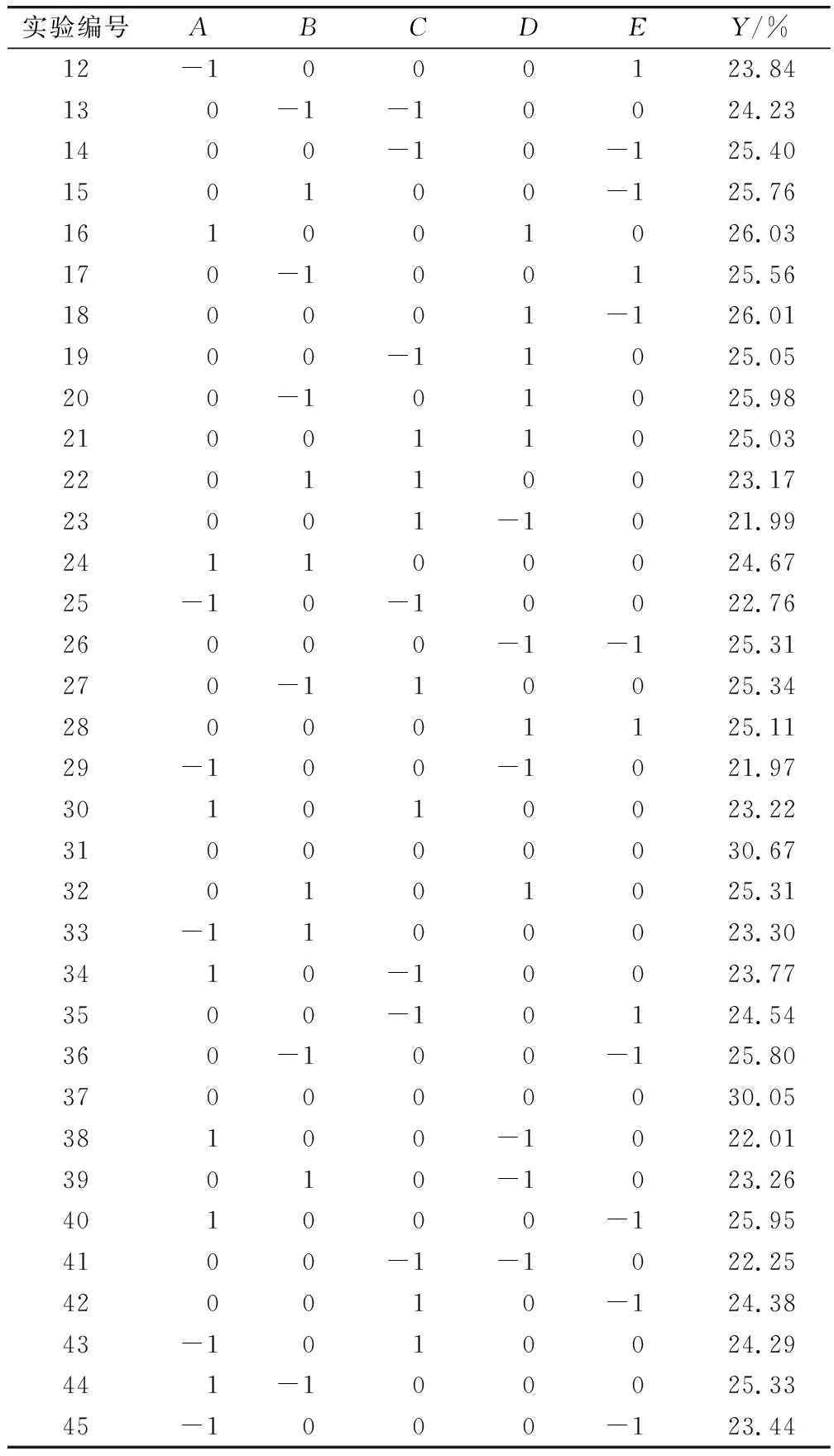
续表2
对表2中的实验数据进行多元回归拟合,得到亚麻籽油得率的多元二次回归方程:Y=30.51+0.63A-0.26B-0.20C+1.07D-0.40E+0.008 833AB-0.52AC+0.84AD-0.23AE-0.81BC+0.20BD+0.14BE+0.060CD-0.22CE+0.46DE-3.65A2-2.38B2-3.59C2-3.43D2-2.39E2。回归模型的显著性检验及方差分析见表3。由表3可知,模型P<0.000 1,差异极显著,表明响应值与参考变量之间存在极显著的关系。模型的相关系数R2=0.954 8,说明模型响应值的95.48%取决于参考变量,所以该模型拟合度良好。信噪比(Adep Precision=18.288)大于4说明回归方程的可信度较高。变异系数等于2.67,说明模型稳定性较好。因此,响应面法优化酶解法提取亚麻籽油工艺可靠、稳定性好,得到的回归方程能较好地预测实验结果。
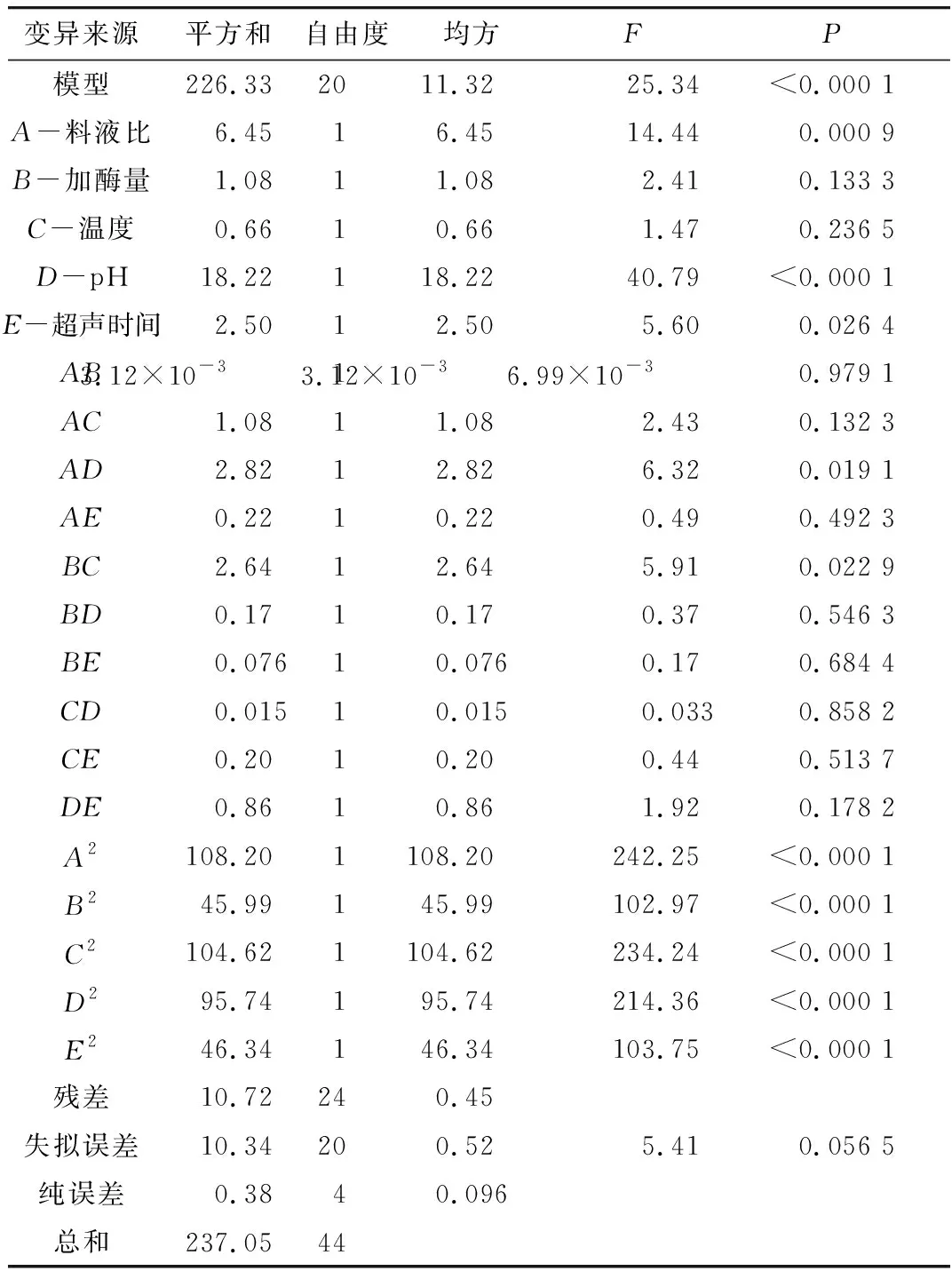
表3 回归模型显著性检验及方差分析
注:P<0. 001为差异极显著水平;0.001 从回归方程模型因变量的方差分析可知,模型的一次项A、D对响应值的影响极显著,E对响应值的影响显著;交互项影响不显著;二次项A2、B2、C2、D2、E2对响应值的影响显著;失拟项P>0.05,差异不显著。根据F值大小可知各因素对亚麻籽油得率的影响顺序为D>A>E>B>C,即酶解pH>料液比>超声时间>加酶量>提取温度。 2.2.2 最优提取工艺的确定 对多元二次回归方程求一阶偏导,得到在料液比1∶10.5,加酶量0.10 g,提取温度49.7 ℃,酶解pH 10.2,超声时间 39 min的条件下,亚麻籽油得率最大为30.53%。结合实际的仪器条件,以及实验具体操作的可行性,修正为料液比1∶10.5,加酶量0.10 g,保温温度50 ℃,酶解pH 10,超声时间 40 min,在修正后的实验条件下,进行3次验证实验,所得亚麻籽油的得率为(30.52±0.04)%,与理论值30.57%接近,实验值与理论值基本吻合,表明模型误差小、可靠。 响应面实验得到亚麻籽油得率与各因素的二次方程模型为:Y=30.51+0.63A-0.26B-0.20C+1.07D-0.40E+0.008 833AB-0.52AC+0.84AD-0.23AE-0.81BC+0.20BD+0.14BE+0.060CD-0.22CE+0.46DE-3.65A2-2.38B2-3.59C2-3.43D2-2.39E2该模型回归显著,对实验拟合较好,有一定的实用价值。 通过单因素实验和响应面优化亚麻籽油的酶解法提取工艺后,得到酶解法提取亚麻籽油的最优工艺条件为:料液比 1∶10.5、加酶量 0.10 g、提取温度 50 ℃、酶解pH 10、超声时间 40 min,在该条件下所得亚麻籽油的得率为30.52%,所得的油品质好,为透明金黄色。 采用超声辅助酶解法提取亚麻籽油的方法,与传统压榨方相比,外观及稳定性方面更好。与溶剂浸提法相比,该方法过程简单,耗时短。与CO2超临界萃取相比,该方法设备简单,成本低。3 结论
