缢蛏(Sinonovacula constricta)GST和HSP90基因克隆及其在氨氮胁迫下的表达特征分析
2020-05-23张欢董迎辉姚韩韩俞凯佳胡月亚林志华
张欢,董迎辉,姚韩韩,俞凯佳,胡月亚,林志华*
(1. 宁波大学 海洋学院,浙江 宁波 315823;2. 浙江万里学院 生物与环境学院 浙江省水产种质资源高效利用技术研究重点实验室,浙江 宁波 315100)
1 引言
随着水产养殖集约化的发展,养殖动物的排泄物、粪便和残饵积累分解,导致水体中氨氮浓度偏高[1]。据报道,添加到养殖系统中的氮源(通常在饵料中)有52%~95%未被利用,导致水体中氨氮浓度急剧升高[2]。在水环境中,氨氮主要以游离氨(NH3)和离子氨(NH4+)两种形式存在,二者之和为总氨氮(Total Ammonium Nitrogen,TAN)。NH3由于脂溶性易穿过细胞膜进入体内,而其在体内累积则会导致机体中毒,甚至死亡[3-5]。氨氮作为水产养殖环境的胁迫因素之一,其浓度升高显著影响机体内氨基酸代谢、活性氧(Reactive Oxygen Species,ROS)代谢、抗氧化过程和免疫应答等过程,从而严重影响养殖动物的生存和养殖业的发展[6-8]。
氨氮中毒的早期特征主要是体内积累过量的氨、ROS、丙二醛(Malondialdehyde,MDA)等,继而导致氧化应激、机体损伤等[9],而氨诱导大量生成的ROS是引起细胞毒性的重要因素之一[10-12]。在氨氮暴露后,罗非鱼(Oreochromis niloticus)肝和肌肉中的氧化酶活力显著升高,以应对氨引起的氧化应激[13],而欧洲鲈鱼(Dicentrarchus labra)[14]、亚马逊河虾(Macrobrachium amazonicum)[15]则引起体内第二阶段抗氧化酶活性的改变。谷胱甘肽S-转移酶(Glutathione S-trans-ferases,GST)作为抗氧化系统中第二道防线的主要成员,主要参与有害亲电性的内源性和外源性化合物的解毒过程,包括脂质过氧化产物和致癌物、环境污染物[16-17]。GST 还催化谷胱甘肽(Glutathione,GSH)与亲电子外源化学物结合,将毒性物质转化成易排泄的水溶性形式[18]。由于其对环境污染物的解毒能力,水生动物中的GST已被广泛用作监测水环境污染的生物标志物[17,19]。环境污染物(如重金属、微生物、氨氮等)还可以诱导第二阶段解毒酶的基因表达[16-17,20],但目前关于氨氮胁迫导致GST基因变化的报道很少[21]。氨氮会损害生物的许多生理功能,如干扰蛋白质折叠和运输[22]。蛋白水平的研究表明,氨氮胁迫下表达水平发生显著改变的蛋白主要参与蛋白质合成和转运,并且抵抗应激刺激[23],如氨诱导暗纹东方鲀(Takifugu obscurus)肝脏中热休克蛋白(Heat Shock Proteins,HSP70和HSP90)显著表达,表明氨可引起机体启动应激机制以保护细胞免受损伤[4]。而作为分子伴侣,HSP有助于细胞从胁迫中恢复,其是具有重折叠应激变性蛋白或协助新生蛋白折叠功能的高度保守性应激蛋白,并调控多种细胞过程(如应激防御、细胞周期控制和细胞凋亡)[22,24]。作为热休克蛋白家族的重要成员,HSP90可应对多种环境因子胁迫,其主要通过形成特定复合物来维护关键蛋白,如类固醇受体和蛋白激酶[22]。由于HSP90在保护生物体免受损害方面具有重要作用,可对多种环境因子胁迫进行调节,被作为监测水环境健康的敏感生物标志物[24]。有研究表明,氨可诱导脊尾白虾(Exopalaemon carinicauda)[25]和栉孔扇贝(Chlamys farreri)[26]HSP90的表达。
缢蛏(Sinonovacula constricta)是我国海水池塘综合养殖的重要底栖经济贝类,其具有养殖周期短、营养价值高、味道鲜美等优点,在浙江、福建等东南沿海广泛养殖,2017年全国养殖总产量达到86.2万t[27]。缢蛏由于埋栖、滤食及开放式循环特点,易受到水体污染物的暴露和有害影响,同时对污染物也具有较高的耐受性[28-29]。本研究对Sc-GSTσ和Sc-HSP90基因的序列特征、组织表达和氨氮胁迫后的表达特征进行分析,了解氨氮对水生动物的早期毒性作用和机体潜在防御机制,以期为缢蛏大规模安全养殖提供科学指导。
2 材料与方法
2.1 实验材料
实验用缢蛏(壳长(63.42±1.57)mm)于 2018年4月采自宁波市海洋与渔业研究院科技创新基地。取健康无病、规格基本一致的20颗缢蛏,用2 mL无菌一次性注射器从后闭壳肌取血,置于冻存管中,并解剖取其鳃、肝胰腺、足、外套膜、水管和闭壳肌,液氮速冻后保存在-80℃超低温冰箱中,用于后续RNA提取。
2.2 氨氮暴露实验
暴露实验前清洁缢蛏壳表污物,暂养在盐度22、温度15℃的海水中,24 h连续充气,每日全换水1次,暂养期间定时投喂亚心形扁藻。暂养7 d后进行实验。
实验分别设置对照组和实验组,每组随机放置80颗缢蛏在100 L水体中,以自然海水中的氨氮浓度作为对照组,实验组氨氮依据半致死浓度(244.55 mg/L,本实验室未发表数据)分别设置为140 mg/L和220 mg/L,每天全换水两次,实验期间水体盐度为22.76±0.92、pH 值为 8.17±0.43、水温为(15.24±3.85)℃,不投饵、不充气,每6 h测定各组氨氮浓度,及时用NH4Cl母液调节氨氮浓度。实验进行到0 h、3 h、6 h、12 h、24 h、48 h、72 h和96 h后,每组随机取6颗缢蛏,解剖取肝胰腺,液氮速冻后保存在-80℃超低温冰箱中。
2.3 Sc-GSTσ和Sc-HSP90基因cDNA全长克隆
利用TRIzol试剂(Omega)提取肝胰腺总RNA,采用分光光度计(GE Healthcare,Nanovue Plus)测定RNA的浓度和纯度,并通过电泳检测其完整性。通过 SMARTTMRACE(Rapid Amplification of cDNA Ends)试剂盒(TaKaRa)将RNA合成cDNA第一链,作为全长克隆的模板。在缢蛏转录组库中检索GST和HSP90基因的EST序列,通过Primer5.0设计克隆引物(表1),根据采用聚合酶(Advantage 2 Polymerase Mix Kit,TaKaRa)进行2个基因的全长扩增,扩增产物经电泳检验后进行回收纯化,纯化的产物与载体T1(TransGen)连接后导入到感受态细胞中,经12 h培养后筛选阳性克隆进行测序。测得的序列利用DNAMAN6.0拼接得到其cDNA全长序列,为确定克隆和测序的准确性,以得到的全长cDNA为模板设计一对特异性引物(表1)进行PCR扩增验证。
2.4 cDNA全长序列分析
获得的cDNA全长序列通过开放阅读框(Open Reading Frame,ORF)查询器(https://www.ncbi.nlm.nih.gov/orffinder/)预测ORF及氨基酸序列;通过蛋白质专家分析系统(Expert Protein Analysis System,Ex-PASy)在线软件(https://web.expasy.org/compute_pi/)预测蛋白质的分子量和等电点;分析蛋白质疏水性(Ex-PASy-ProtScale,https://web.expasy.org/protscale/);预测氨基酸是否存在信号肽(SignalP,http://www.cbs.dtu.dk/services/SignalP/);利用 Smart在线软件(http://smart.embl-heidelberg.de/)对蛋白进行功能域预测,通过Swiss Model在线软件(https://swissmodel.expasy.org/interactive)预测蛋白质高级结构;利用美国国立生物技术信息中心(National Center of Biotechnology Information,NCBI)数据库中的本地序列基本搜索工具(Basic Local Alignment Search Tool,BLAST;http://www.ncbi.nlm.nih.gov/BLAST/)进行序列比对,搜索同源序列;利用MEGA5.2软件构建系统进化树,利用DNAMAN6.0软件进行同源序列的多重比较。

表1 本实验所用引物及序列信息Table 1 The information of primers and sequences used in this experiment
2.5 荧光定量PCR分析
提取缢蛏组织的总RNA,用专用反转录试剂(TaKaRa,PrimeScript™ RT reagent Kit with gDNA Eraser)进行RNA反转录,得到实时荧光定量PCR(Real-time Polymerase Chain Reaction,qRT-PCR)cDNA 模板。根据全长序列设计荧光定量引物(表1),以核糖体蛋白S9(Ribosomal Protein S9,RS9)基因作为内参基因[30]。用定量 PCR 仪(Roche,LightCycler®480)进行 qRTPCR扩增,每组样本设定4个平行,3个重复,所得数据采用2-ΔΔCt法对相对表达水平进行计算,结果以平均值±标准偏差(Mean±SD)表示,利用 SPSS13.0进行单因素方差分析(One-way ANOVA)。
3 结果
3.1 Sc-GSTσ基因cDNA全长序列分析及特征分析
克隆得到Sc-GSTσ基因cDNA全长序列为1 414 bp(GenBank登录号:MK301159),包含 639 bp的 ORF,编码212个氨基酸,根据氨基酸序列推导出Sc-GSTσ基因编码蛋白质的分子量为24.54 kDa,理论等电点为7.68。ExPASy-ProtScale软件预测显示,该蛋白质在氨基酸组成上,极性氨基酸所占比例较高,表现为亲水性,且没有明显的信号肽。预测Sc-GSTσ蛋白含有2个功能域,即GST-N(3-84 aa)和GST-C(86-212 aa)(图1a),其二级结构由271个H键、螺旋数25和42个转角组成。
同源氨基酸序列比对显示,Sc-GSTσ与菲律宾蛤仔(Ruditapes philippinarum,AEW46327.1)GSTσ 的同源性及同源性数据最高(43.40%),与紫贻贝(Mytilus galloprovincialis,AFQ35985.1)、海湾扇贝(Argopecten irradians,ANG56313.1)、刺参(Apostichopus japonicus,PIK56346.1)等无脊椎动物的同源性在26.67%~40.49%,与人(Homo sapiens,O60760.3)、小家鼠(Mus musculus,Q9JHF7.3)、家鸡(Gallus gallus,O73888.3)等脊椎动物的同源性为26.67%~29.52%。GSTσ同源序列比对显示,Sc-GSTσ的保守性较低。Sc-GSTσ与其他无脊椎动物GST和脊椎动物PGD进行多重比较,确定N端结构域显示较保守,C端结构域多样(图1b,图1c)。系统进化树结果显示,产生了4个不同的簇,分别是σ、Mu、Ω和微粒体GST,其中微粒体GST与其他3个类群保持相当大的遗传距离。每一类贝类GST与无脊椎动物GST的位置非常接近,而Sc-GSTσ与菲律宾蛤仔GSTσ3最亲密,其亚群及分支表明缢蛏Sc-GSTσ确实为σ亚型(图2)。
3.2 Sc-HSP90基因cDNA全长序列分析及特征分析
Sc-HSP90基因cDNA全长序列为2 752 bp(Gen-Bank登录号:MK301157),其中含有 2 181 bp的 ORF,编码726个氨基酸。根据氨基酸序列推导出其编码蛋白质的分子量为83.10 kDa,理论等电点4.78。Ex-PASy-ProtScale软件预测显示,该蛋白质表现为亲水性,没有明显的信号肽。Smart软件预测得到Sc-HSP90蛋白也含有2个功能域,分别是HATPase-C(35-189 aa)和 HSP90(191-720 aa),其中含有 5 个家族标签序列(35NKEIFLRELISNASDALDKIR55,102L G T I A K S G T110,126I G Q F G V G F Y S A136,354IKLYVRRVFI363,380GVVDSEDLPLNISRE394)。Swiss model软件预测显示,Sc-HSP90蛋白的二级结构由448个H键、螺旋数31和72个转角组成。
序列同源性分析表明,Sc-HSP90氨基酸序列与已知物种序列的同源性超过70%。与其他软体动物的HSP90的同源性超过79%,其中与河蚬(Corbicula fluminea,AMM04544.1)和菲律宾蛤仔(AHY275448.1)的同源性最高,分别为88.32%和87.05%。多重序列比对表明,Sc-HSP90具有高度保守性,特别是在HSP90家族标签区域(图3a)。系统进化树结果显示,这些蛋白分为两个簇,一簇包含软体动物、甲壳动物和脊椎动物,另一簇包含两个昆虫纲。所有脊椎动物聚集在一起,形成两个分支(HSP90α和HSP90β亚型)。而甲壳动物聚集在一起,与软体动物分支互为姐妹群。显然,Sc-HSP90与软体动物HSP90聚为一亚支,并与菲律宾蛤仔、河蚬的HSP90亲缘关系最近(图3b)。

图1 Sc-GSTσ结构域和多重比较Fig. 1 Sc-GSTσ domain structure and multiple sequence alignment

图2 利用MEGA5.2软件邻接法构建的GST的系统进化树Fig. 2 The phylogenetic tree of GST constructed by Neighbor-joining method using MEGA5.2 software
3.3 Sc-GSTσ和Sc-HSP90基因在缢蛏7个组织中的表达模式
利用qRT-PCR技术检测了Sc-GSTσ和Sc-HSP90基因在鳃、肝胰腺、足、外套膜、血液、水管和闭壳肌7个组织中的表达。结果表明,Sc-GSTσ在肝胰腺中的表达量最高,显著高于其他6个组织(p<0.05),而其他组织间表达量没有显著性差异(图4a1)。Sc-HSP90基因也在肝胰腺中表达量最高(p<0.05),其次是鳃、血液和水管,外套膜中表达量最低(图 4b1)。
3.4 Sc-GSTσ和Sc-HSP90基因在氨氮胁迫下的表达特征分析
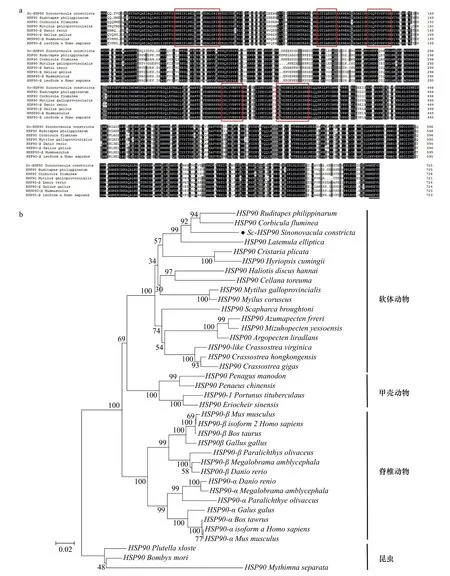
图3 Sc-HSP90基因鉴定及系统进化树Fig. 3 Sc-HSP90 gene identified and phylogenetic tree
氨氮胁迫后缢蛏肝胰腺中Sc-GSTσ和Sc-HSP90的mRNA水平升高(图4)。在140 mg/L氨浓度暴露下Sc-GSTσ基因在肝胰腺中的表达量持续上升,在48 h达到峰值,显著高于对照组(p<0.05),随后表达量显著下调,72 h恢复到对照组水平,然而96 h又显著高于对照组。而在220 mg/L氨浓度暴露下,Sc-GSTσmRNA表达水平在3 h显著上升,在6 h达到最大值,但随后显著下降,在24 h下降到与对照组无显著性差异,然而之后又缓慢上升直至96 h(图4a2)。

图4 Sc-GSTσ和Sc-HSP90基因在缢蛏不同组织中及不同氨浓度胁迫后的表达特征Fig. 4 The expression characteristics of Sc-GSTσ and Sc-HSP90 genes in different tissues of S. constricta and after different ammonia concentration stress
在140 mg/L和220 mg/L氨氮胁迫下,Sc-HSP90的转录水平呈现先升后降的趋势,分别在48 h和 24 h 达到峰值,显著高于对照组(p<0.05),140 mg/L氨氮胁迫72~96 h其表达量有所下降,但仍显著高于对照组,而220 mg/L氨氮胁迫72~96 h表达水平恢复到对照组水平(图4b2)。
4 讨论
GST作为具有解毒和抗氧化等多种生理功能的蛋白酶,在哺乳动物和水生动物中已被广泛研究[17,31-32]。本研究克隆得到Sc-GSTσ基因的全长cDNA,其氨基酸序列与其他动物GST氨基酸序列比对显示相似度不高,该结果与曼氏无针乌贼(Sepiella maindroni)、三角帆蚌(Hyriopsis cumingii)GST基因的分析结果相似[19,33]。Sigma型GST是一个大家族,包括来自不同有机体的亚型,因此不同物种GSTσ型之间的同源性较弱。结构域分析表明,在Sc-GSTσ N端含有一个GST_N结构域,该结构域是GSH结合位点(G位点),还存在一个相当保守的酪氨酸残基(Try,Y5)在催化反应中起重要作用,而且在C末端还存在一个GST_C结构域,是亲电子物质即底物结合位点(H位点)。对GSTσ的结构域比较分析表明,所有物种均存在N末端和C末端结构域,但多重比较发现含有G位点的N末端区域较保守,其与GST功能紧密相关,而含H位点的C末端显示出高度变异性,这种差异可能表明物种间存在底物特异性[34-35]。
作为应激蛋白中的重要成员,热休克蛋白已被广泛研究,其中对缢蛏热休克家族的研究包括Sc-HSP70[36]和小分子热休克蛋白Sc-sHAP[37],而关于HSP90的报道尚未见到。在本研究中,推导Sc-HSP90氨基酸序列发现,其具有HSP90家族标签序列和腺嘌呤核苷三磷酸(Adenosine triphosphate,ATP)结合域,这与哺乳动物和水生动物的研究一致[38-40]。根据C末端存在722MEEVD726序列,则Sc-HSP90属于细胞溶质HSP90家族[40-41]。序列多重比较表明,缢蛏Sc-HSP90序列具有高度保守性,基于系统进化树分析进一步表明,Sc-HSP90是HSP90家族成员。在系统发育树中,脊椎动物存在HSP90α和HSP90β两个亚型。相比之下,大多数无脊椎动物只有一个HSP90基因。与所有脊椎动物HSP90β亚型一样,Sc-HSP90氨基酸序列N末端缺少α亚型特有的dsDNA依赖激酶磷酸化位点[39-41]。这些结果表明,Sc-HSP90应该属于HSP90β亚型家族。
本研究通过qRT-PCR方法检测氨暴露下Sc-GSTσmRNA在肝胰腺中的转录水平,结果表明在氨氮胁迫下Sc-GSTσ转录水平显著上升,随着暴露时间推移表达水平下降,接近正常水平,并且高浓度氨氮胁迫下Sc-GSTσ的表达水平明显低于低浓度氨氮胁迫,这与暗纹东方鲀(Takifugu obscurus)[12]、脊尾白虾(Exopalaemon carinicauda)[42]、三疣梭子蟹(Portunus trituberculatus)[8]的研究结果相似。由此表明,缢蛏对氨氮胁迫较敏感,氨氮胁迫初始阶段下GST基因高表达参与氨氮的解毒过程,但在氨氮持续胁迫下,GST的表达降低,解毒能力减弱。研究表明持续胁迫下,抗氧化防御系统未能及时清除ROS,其在体内过度积累,导致机体代谢能力的降低,从而影响相关基因的表达[21,42]。此外,机体氧化应激强度随着氨氮浓度的增加而增加[13],氨在水生动物组织中积累,引起机体释放大量ROS,导致氧化损伤[42]。黄颡鱼(Pelteobagrus vachelli)血液中超氧化物歧化酶(Superoxide dismutase,SOD)和过氧化氢酶(Catalase,CAT)活性在高浓度氨氮胁迫下低于低浓度氨氮胁迫,而且在高浓度氨氮胁迫下体内MDA含量显著升高[43]。氨氮胁迫后期或高氨氮胁迫下体内会累积过量的自由基,超出机体的清除能力,从而造成脂质过氧化,加剧细胞和组织损伤。由此表明,抗氧化酶mRNA的表达是具有时间和剂量依赖性的,并且与机体的代谢能力相关[24]。Sc-GSTσ基因表达上调表明,GST的表达量可以用作指示环境氨氮毒性的生物标记。
ROS对机体细胞有害,具有毒性诱变作用,可诱导蛋白质变性或蛋白毒性[22]。氨除了诱导ROS的大量生成,还可能会干扰体内蛋白质和氨基酸平衡、运输,增加细胞中蛋白质碎片化和聚集[44]。研究发现氨诱导草鱼(Ctenopharyngodon idella)[24]、宽体沙鳅(Aeromonas hydrophila)[22]、山黄鳝(Monopterus cuchia)[44]肝脏中HSP90的表达水平上调,而在本研究中氨氮胁迫下缢蛏肝胰腺中Sc-HSP90表达量显著上升,达到峰值后显著下降。这表明氨氮胁迫下,体内高表达的HSP90可能有助于防止蛋白质变性或损伤从而保护细胞免受损害,这可作为缢蛏对氨氮胁迫的适应性反应。此外其高表达量也可能意味着高氨氮胁迫造成机体高水平的蛋白损伤,其基因表达的增加,可能表明机体对氨氮胁迫的耐受性的增强[45]。然而,随着胁迫时间延长而表达量减少,这可能是由于HSP90修复受损DNA和蛋白的能力有限,变性的蛋白在体内累积,影响正常细胞的代谢能力[26]。
5 结论
本研究克隆得到Sc-GSTσ和Sc-HSP90基因的cDNA全长序列,同源性分析表明,它们均与菲律宾蛤仔的同源性最高。这2个基因在缢蛏7个组织中均有表达,且均在肝胰腺中表达量最高。经氨氮胁迫后,Sc-GSTσ和Sc-HSP90的表达量均显著上升,表明这2个基因均参与氨氮胁迫的应激反应,但高浓度氨氮胁迫或胁迫后期,其表达量下降,表明它们在肝胰腺中积极响应氨氮胁迫。研究结果为进一步研究氨氮对缢蛏的早期毒性作用和潜在应激机制奠定了基础。
附录

表A1 GST进化树结构中使用的序列的登录号Table A1 Accession numbers of the sequences used in GST phylogenetic tress

续表 A1

表A2 HSP90进化树结构中使用的序列的登录号Table A2 Accession numbers of the sequences used in HSP90 phylogenetic tress
