军曹鱼(Rachycentron canadum)幼鱼对环境低氧胁迫氧化应激与能量利用指标的响应
2020-05-23李洪娟陈刚郭志雄王维政黄建盛曾泽乾
李洪娟,陈刚*,郭志雄,王维政,黄建盛*,曾泽乾
(1. 广东海洋大学 水产学院,广东 湛江 524088)
1 引言
鱼类的生命活动易受到各种环境因子的影响,水体溶解氧含量是其中重要的影响因子之一[1]。溶解氧作为维持水生动物生存的基本条件,它主要影响水生动物的生长、呼吸、物质和能量代谢等各种生理生化指标[2-4]。在自然因素和人为因素的影响下,近岸海域缺氧现象呈现出不断上升的趋势,造成水体周期性和连续性低氧的现象,且部分近岸海域在夏、秋季大多处在低氧状态(溶解氧含量大约为3 mg/L),从而导致了大量鱼类和海洋无脊椎动物的死亡,成为名副其实的“死水区”[5-8]。水生动物在低氧环境下,容易引起机体的应激反应,尤其是低氧胁迫后的复氧阶段更加剧了应激反应,导致机体氧化损伤,产生大量的活性氧(Reactive Oxygen Species,ROS),最终影响其生理功能[9]。为了降低ROS对机体的损伤,生物体通过抗氧化酶体系来发挥抗氧化应激作用。同时,低氧会导致有氧代谢降低和无氧代谢增加,随之能量代谢系统也会受到影响[10-11]。近年来研究表明,鱼类通过增加呼吸效率、增加血氧亲和力、改变代谢效率以及降低能量消耗等方式来应对低氧环境[9]。因此,研究低氧胁迫下鱼类的氧化应激水平及其能量利用不仅为鱼类适应低氧环境提供参考依据,还可以探讨其在水产健康养殖中的意义。
军曹鱼(Rachycentron canadum)亦称海鲡、海龙鱼,隶属于鲈形目(Perciformes)、军曹鱼科(Rachycentridae)、军曹鱼属(Rachycentron),为海产名贵鱼类,是南方沿海海水网箱养殖产业的重要组成部分,且对水体溶氧要求很高,一旦缺氧,将造成巨大经济损失[12-13]。近年来,由于风和潮汐的作用,受水温、季节、养殖密度等因素的影响,在军曹鱼养殖海区经常出现低氧现象。溶解氧的变化会引起机体氧化应激水平的改变,肝脏是机体对外界刺激反应最早、最敏感的组织之一,也是最早出现损伤的组织,严重时则会使鱼类肝脏的解毒功能处于超负荷状态[14]。同时,鱼类为了延长自身的生存时间,会降低其运动能力,因此肝脏和肌肉组织的代谢情况也备受关注[15]。本实验室已研究了急性低氧对军曹鱼大规格幼鱼血液生化指标的影响[16],而关于低氧及复氧对其氧化应激水平的影响尚未开展研究。为此,本实验以军曹鱼幼鱼为对象,研究低氧胁迫与复氧对其肝脏和肌肉组织氧化应激水平与能量利用的影响,探讨军曹鱼对低氧环境的适应性,以期为军曹鱼的健康养殖提供参考资料。
2 材料与方法
2.1 实验材料
实验鱼来源于广东海洋大学水产学院鱼类种子工程与养殖团队在东海岛生物研究基地繁育的幼鱼,随机选取健康、活力好的个体200尾用专用鱼苗运输车运回实验室,幼鱼的体质量为(220.67±20.73)g,全长为(29.37±3.76)cm。实验在自制的室内循环水养殖系统中进行,水体交换量为90 L/h,水槽的长、宽、高分别为70 cm、50 cm和60 cm,每个水槽放20尾幼鱼。暂养期间,通过调节水槽内的充气量大小,保持水中溶解氧在6 mg/L以上,水温为(26.3±2.5)℃,盐度为 27.8±0.47,总氨氮含量为(0.17±0.03)mg/L。每日投喂石斑鱼专用配合饲料2次(广东越群海洋生物研究开发有限公司),及时清理粪便。实验开始前一天停止投食。
2.2 实验设计
实验在循环水养殖系统中的6个水槽中进行,分为实验组和对照组,各3个重复。对照组采用循环水养殖并始终保持持续充气及流水状态,用溶氧仪(台湾衡欣,AZ8403)每隔10 min监测溶氧量的变化,对照组的溶氧量为(6.64±0.35)mg/L;实验组通过调节循环水的流量、关闭充气及水槽上方覆盖薄膜的方法来降低水体溶解量,并用溶氧仪实时监测。当溶解氧为(2.64±0.25)mg/L条件下低氧胁迫维持3 h,取样后,立即恢复常氧状态,复氧后溶氧量为(6.34±0.15)mg/L,在复氧8 h,24 h和48 h后取样,实验组和对照组取样时间一致。
2.3 样品采集与制备
实验处理后,实验组在低氧胁迫与常氧恢复的各个时间点取样,常氧对照组在实验结束后取样,每个时间点每桶各取3尾鱼,将实验鱼用适量的200 mg/L间氨基苯甲酸乙酯甲磺酸盐(MS-222)海水溶液快速麻醉,用纱布擦干解剖,取其肌肉和肝脏组织,放置于1.50 mL冻存管中,迅速放于液氮中速冻,之后转移至-80℃超低温冰箱,保存待测。取肝脏和肌肉各0.60 g,按1∶9加入0.90%生理盐水,在冰水浴中用匀浆机(IKA)匀浆5 min,制成10%匀浆液;之后在温度4℃、转速2 000 r/min的条件下,离心15 min;取上清液分装后,置于-80℃保存,用于各酶活指标的测定。
2.4 酶活力测定
采用南京建成生物工程研究所检测试剂盒测定组织中氧化应激和能量利用指标,包括丙二醛(Malondialdehyde,MDA)、脂质过氧化物(Lipid Peroxide,LPO)、谷胱甘肽还原酶(Glutathione Reductase,GR)、过氧化氢酶(Catalase,CAT)、谷胱甘肽过氧化物酶(Glutathione Peroxidase,GPx)、超氧化物歧化酶(Superoxide Dismutase,SOD)以及乳酸脱氢酶(Lactate Dehydrogenase,LDH)和糖原。MDA采用硫代巴比妥酸(TBA)法,反应体系产生红色产物,在532 nm波长处测其吸光度,计算转换为MDA含量;GR采用紫外比色法,定义1 g组织蛋白1 min使反应体系中底物还原型辅酶Ⅱ(Triphosphopyridine Nucleotide,NADPH)的浓度改变1 mmol/L所需的酶量为一个酶活力单位;CAT采用钼酸铵法,定义1 mg组织蛋白1 s分解1 μmol的H2O2的量为一个活力单位;GPx采用比色法,定义1 mg蛋白质,1 min扣除非酶反应的作用,使反应体系中谷胱甘肽(Glutathione,GSH)浓度降低1 μmol/L为一个酶活力单位;SOD采用羟胺法,定义1 mg组织蛋白在1 mL反应液中SOD抑制率50%时所对应的SOD量为一个活力单位(单位U);蛋白质浓度测定采用考马斯亮蓝法;LDH采用微板法,定义1 g组织蛋白37℃与基质作用15 min,反应体系中产生1 μmol丙酮酸为1单位;糖原采用比色法,利用糖原在浓硫酸的作用下可脱水生成糖醛衍生物,后者再与蒽酮作用形成蓝色化合物,与同法处理的标准葡萄糖溶液比色定量。相应的操作步骤参照试剂盒说明书。
2.5 数据处理
实验所得数据用平均值±标准差(mean±SD)表示。采用配对t检验方法分析对照组和低氧胁迫后的数据差异显著性,以p<0.05表示差异显著,以p<0.01表示差异极显著;采用SPSS17.0软件进行单因素方差分析对照组与恢复常氧不同时间点的数据差异显著性,并用Duncan检验进行多重比较。
3 结果
3.1 低氧胁迫对军曹鱼幼鱼氧化应激指标的影响
低氧胁迫对军曹鱼幼鱼肝脏和肌肉的氧化应激指标的影响见图1。由图1可知,低氧胁迫3 h后,肝脏MDA含量与对照组的差异具有统计学意义(t=6.675,df=2,p=0.022<0.05),肌肉 MDA 含量与对照组的差异具有统计学意义(t=4.352,df=2,p=0.049<0.05)(图 1a);肝脏LPO活性与对照组无显著性差异(p>0.05),肌肉LPO活性比对照组降低了0.08 μmol/g,差异具有统计学意义(t=3.482,df=2,p=0.037<0.05)(图 1b);肝脏CAT活性比对照组降低了4.81 U/mg,差异具有统计学意义(t=8.715,df=2,p=0.013<0.05),肌肉 CAT 活性与对照组无显著性差异(p>0.05)(图 1c);肝脏和肌肉GPx 活性均与对照组无显著性差异(p>0.05)(图 1d);肝脏SOD活性与对照组无显著性差异(p>0.05),而肌肉SOD活性与对照组差异具有统计学意义(t=5.027,df=2,p=0.037<0.05)(图 1e);肝脏 GR 活性与对照组差异具有统计学意义(t=4.428,df=2,p=0.047<0.05),肌肉 GR 活性与对照组无显著性差异(p>0.05)(图 1f)。
3.2 低氧胁迫对军曹鱼幼鱼能量利用指标的影响
低氧胁迫对军曹鱼幼鱼肝脏和肌肉的能量利用指标的影响见图2。由图2可知,低氧胁迫3 h后,肝脏LDH活性比对照组升高了169.80 U/g,差异具有统计学意义(t=4.816,df=2,p=0.020<0.05),肌肉 LDH 活性比对照组升高了177.90 U/g,差异具有统计学意义(t=3.845,df=2,p=0.031<0.05)(图 2a);肝糖原含量比对照组降低了8.51 mg/g,差异具有统计学意义(t=22.14,df=2,p=0.002<0.01),肌糖原含量比对照组降低了 1.41 mg/g,差异具有统计学意义(t=13.13,df=2,p=0.006<0.01)(图 2b)。
3.3 复氧过程对军曹鱼幼鱼氧化应激指标的影响

图1 低氧胁迫对军曹鱼幼鱼肝脏和肌肉氧化应激指标的影响Fig. 1 Effects of hypoxic stress on oxidative stress indicator of liver and muscle of juvenile cobia
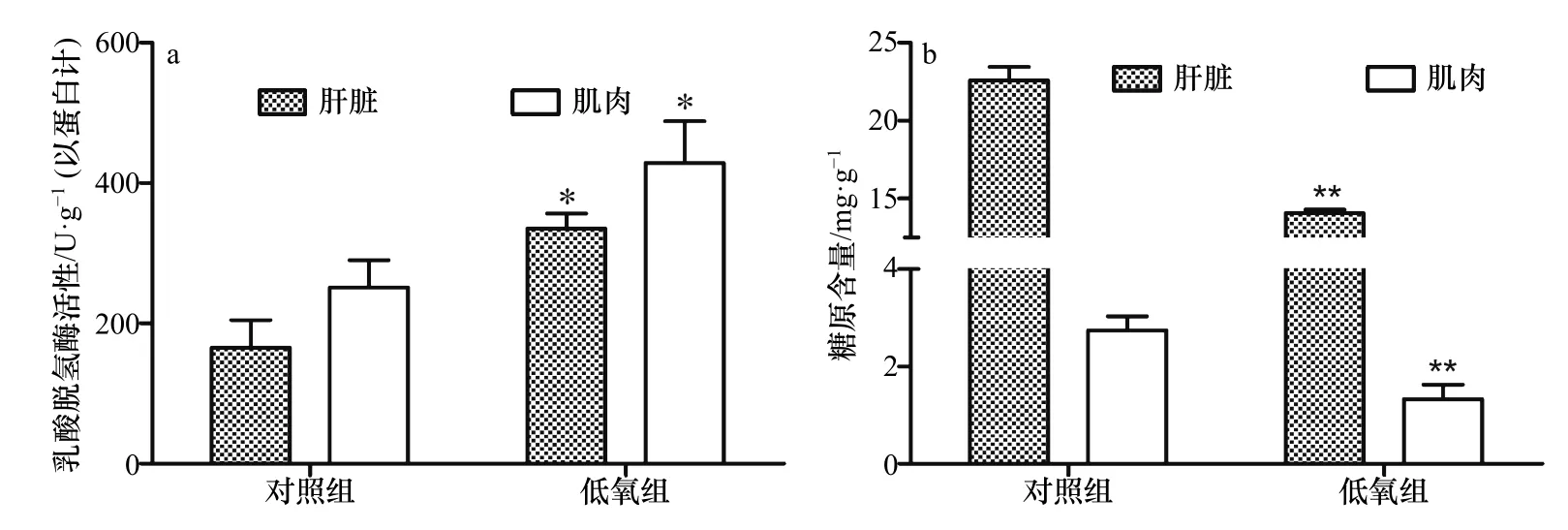
图2 低氧胁迫对军曹鱼幼鱼肝脏和肌肉的乳酸脱氢酶活性、糖原含量的影响Fig. 2 Effects of hypoxia stress on lactate dehydrogenase activity and glycogen content in liver and muscle of juvenile cobia
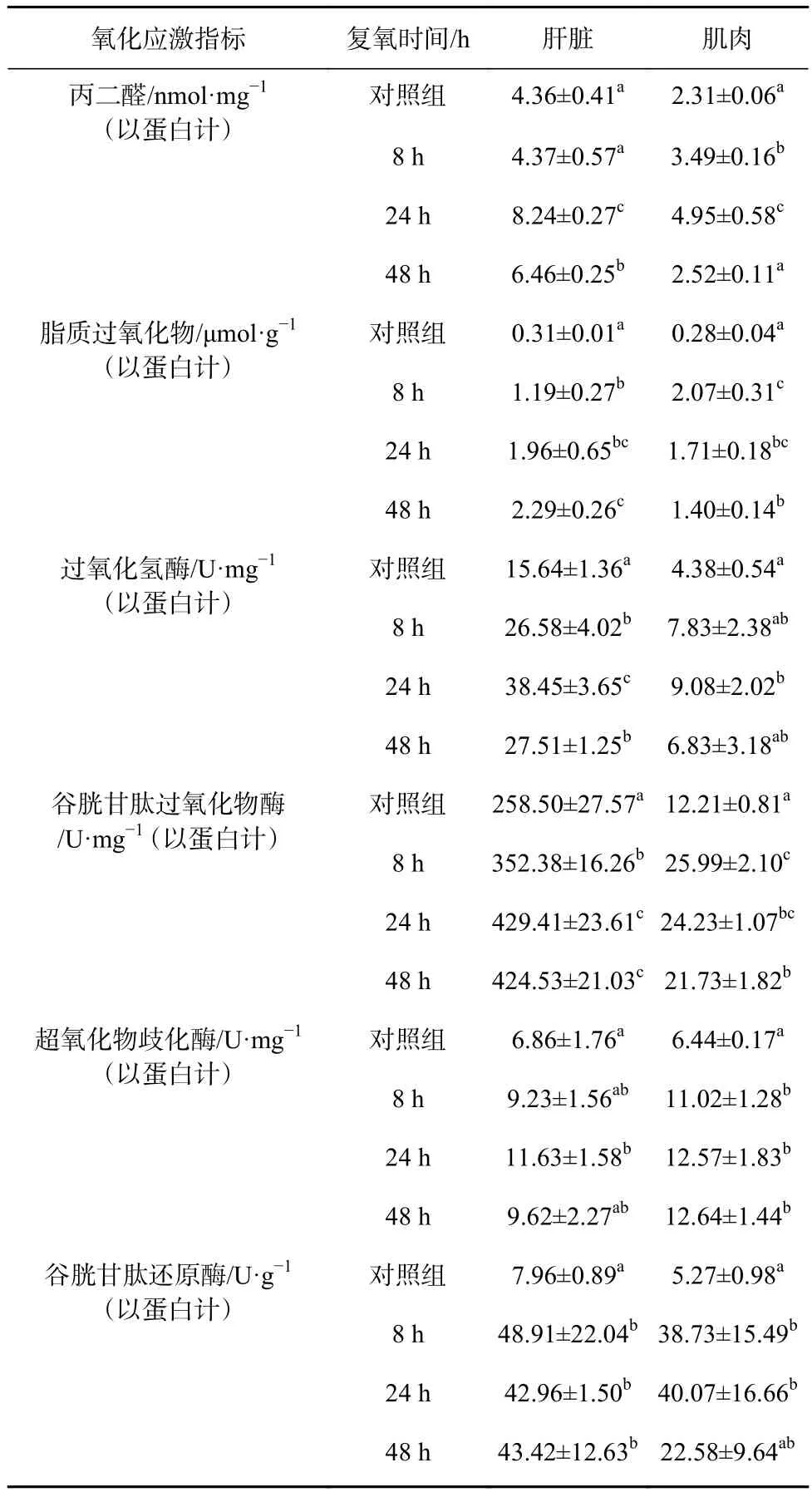
表1 复氧过程对军曹鱼幼鱼肝脏和肌肉氧化应激指标的影响Table 1 Effects of reoxygenation on oxidative stress indicator of liver and muscle of juvenile cobia
复氧过程对军曹鱼幼鱼肝脏和肌肉氧化应激指标的影响见表1。由表1结果显示,肝脏组织中,MDA含量恢复常氧8 h后与对照组无显著差异(p>0.05),24 h和48 h后显著高于对照组(p<0.05);LPO活性在复氧 8 h、24 h和 48 h后显著高于对照组(p<0.05);在复氧8 h、24 h和48 h过程中,CAT活性显著高于对照组(p<0.05),并且在24 h时CAT活性达到最大;复氧8 h、24 h和48 h后,GPx活性显著高于对照组(p<0.05),呈逐步增加趋势,且在复氧24 h后达到最大值;在复氧8 h和24 h的过程中,SOD含量逐渐升高,且在复氧24 h后显著高于对照组(p<0.05);在复氧8 h、24 h和48 h过程中GR活性显著高于对照组(p<0.05)。肌肉组织中,MDA含量在复氧8 h和24 h后显著高于对照组(p<0.05),且逐渐升高,48 h 与对照组无显著性差异;LPO活性在复氧8 h、24 h和48 h后显著高于对照组(p<0.05),且在复氧8 h时达到最大值,随后逐渐降低;CAT活性在复氧24 h后显著高于对照组(p<0.05);GPx活性在复氧 8 h、24 h和 48 h后显著高于对照组(p<0.05),呈逐步下降趋势,但未能降低到正常水平;SOD活性在复氧8 h、24 h和48 h后显著高于对照组(p<0.05);GR活性在复氧8 h和24 h后显著高于对照组(p<0.05),且在复氧 24 h后,GR 活性达到最大值,复氧24~48 h阶段GR活性逐渐下降,在复氧48 h后无显著性差异。
3.4 复氧过程对军曹鱼幼鱼能量利用指标的影响
复氧过程对军曹鱼幼鱼肝脏和肌肉能量利用指标的影响见表2。表2结果显示,肝脏组织中,LDH活性在复氧8 h、24 h和48 h后,与对照组无显著性差异(p>0.05),随着复氧时间的增加活性逐步降低,且恢复到正常水平;肝糖原含量在恢复氧气24 h后显著高于对照组(p<0.05),复氧48 h后显著低于对照组(p<0.05)。肌肉组织中,LDH 活性在复氧 8 h、24 h和48 h后无显著性差异(p>0.05);肌糖原含量在复氧8 h、24 h和 48 h 后显著低于对照组(p<0.05)。
4 讨论
正常状态下,机体内的ROS处于一种不断产生又不断被清除的动态平衡状态,而过多的ROS便会对机体造成一定的毒害,如MDA和LPO含量的变化。机体的抗氧化系统作为ROS的清除系统,主要包括SOD、CAT、GPx和GR,参与ROS的清除以及在机体的保护性防御反应中发挥巨大作用[1]。糖原是机体内最为重要的功能物质,对维持机体的能量代谢有重要作用。因此,实验将从以下3个方面进行讨论。
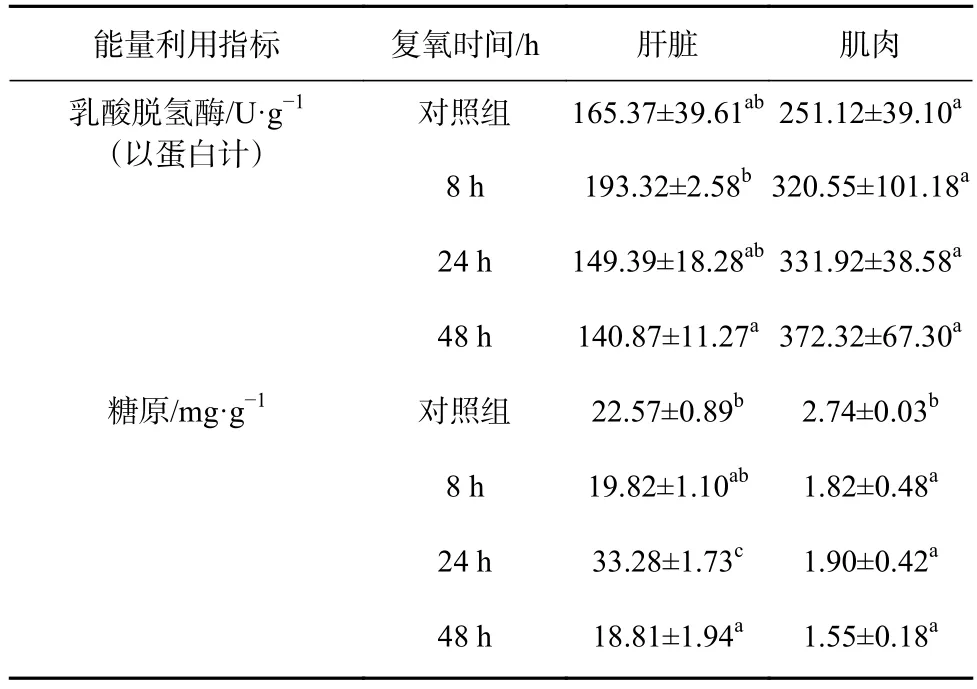
表2 复氧过程对军曹鱼幼鱼肝脏和肌肉能量利用指标的影响Table 2 Effects of reoxygenation on energy utilization indicator of liver and muscle of juvenile cobia
4.1 低氧胁迫与恢复对军曹鱼组织MDA和LPO含量的影响
机体受到低氧胁迫后,体内的ROS含量发生变化,从而引起机体抗氧化系统的变化[17]。MDA和LPO作为脂质过氧化的一种指标,其含量增加表明低氧胁迫对鱼体产生了氧化损伤,影响鱼类的生理功能[18]。本实验中,在低氧胁迫3 h后,肝脏和肌肉中MDA含量显著降低,肌肉LPO含量也显著降低,这是因为在低氧胁迫下军曹鱼供氧受到限制,使氧气经过线粒体呼吸链相应减少,那么线粒体产生的ROS也相应减少,这与对瓦氏黄颡鱼(Pelteobagrus vachelli)的研究结果相似[1]。肝脏MDA含量在复氧24 h和48 h后显著升高,且肌肉MDA含量在复氧8 h和24 h后显著升高;肝脏和肌肉LPO活性在复氧8 h、24 h和48 h后均出现不同程度的升高,说明恢复溶氧后军曹鱼氧化应激反应较为强烈。这与对瓦氏黄颡鱼和花鲈(Lateolabrax maculatus)的研究结果相似[1,9]。分析其原因可能由于军曹鱼在复氧过程中由于大量氧气的导入,机体补偿代谢更加剧了氧化应激胁迫,使得ROS的浓度迅速升高,导致生物大分子过氧化,如LPO和MDA含量升高,因而出现了复氧过程中更为强烈的氧化应激现象。
4.2 低氧胁迫与恢复对军曹鱼组织抗氧化酶活性的影响
低氧能够影响鱼体抗氧化防护能力,从而引起鱼类产生氧化应激,其与抗氧化酶活性密切相关[19]。酶类抗氧化剂(如CAT、SOD、GPx和GR)可清除细胞内多余的氧自由基,来预防氧化应激对组织或细胞的损伤,从而维持机体的ROS平衡[20]。本研究中,肝脏和肌肉中GPx活力在低氧胁迫3 h后无显著性差异,而肝脏CAT和GR活力显著降低,肌肉SOD活力显著升高,这与对细鳞肥脂鲤(Piaractus mesopotamicus)和葛氏鲈塘鳢(Perccottus glenii)的研究结果相似[21-22]。说明低氧胁迫3 h时,机体抗氧化酶体系未被完全激活,机体线粒体仍然可以在静止状态下呼吸,在一定程度上抵抗低氧胁迫或产生较少的ROS或存在代谢减痕作用,导致线粒体有氧呼吸减弱,减少了电子传递链上电子逃逸的几率,以致氧携带电子减少,从而减少了ROS的生成,主要的原因可能是低氧胁迫下鱼类的耐受性较高,且低氧胁迫的时间较短[23]。在复氧8 h、24 h和48 h阶段,肝脏和肌肉中CAT、SOD、GPx和GR活性均出现不同程度的升高。肝脏CAT、SOD和GPx活性在复氧24 h后达到最大值,而在复氧24~48 h阶段,其活性逐渐下降,但未能恢复到正常水平;在复氧过程中,肌肉SOD和GPx活力没能恢复到正常水平,这与花鲈和鲻鱼(Mugil cephalus)的研究结果相似,恢复溶氧后其氧化应激反应仍然较为强烈[9,14],说明在缺氧后再复氧的过程中,ROS在组织或细胞内快速蓄积,过量的ROS造成鱼体氧化应激和抗氧化体系的紊乱,从而使军曹鱼体内的抗氧化防御机制在缺氧后再复氧的过程中被完全激活。综上所述,鱼类在低氧胁迫下氧化应激参数变化各异,表明机体能够提高自身的抗氧化潜能,从而为解决再氧化后体内的氧化应激做好准备[1]。本研究中氧化损伤指标(MDA和LPO)和能量利用指标(LDH和糖原)也证实了这一结论。
4.3 低氧胁迫与恢复对军曹鱼能量利用的影响
机体正常生命活动的运行需要能量来维持。糖原是机体内最为重要的供能物质,对维持机体的能量代谢有重要作用[24]。而LDH可以催化丙酮酸和乳酸之间的相互转化,为生命活动提供能量,是鱼类机体无氧代谢的标志酶,其活力大小在一定程度上反映了无氧代谢能力的高低[25]。
本实验中,在急性低氧胁迫3 h后,肝脏和肌肉中糖原含量急剧下降,LDH含量急剧上升,表明机体由于氧气不足进行了无氧代谢,动用糖原中贮存的能源物质来维持其基本代谢,同时LDH活力升高,将更多的丙酮酸转化为乳酸,乳酸浓度升高表示厌氧糖酵解反应加剧,以应对突然出现的低氧环境[14,26],与对白鲢(Hypophthalmichthys molitrix)和卵形鲳鲹(Trachinotus ovatus)的研究结果一致[24,27]。复氧过程中,肝脏和肌肉LDH含量呈现相反的变化趋势,但在复氧48 h后,其LDH含量均与对照组无显著性差异;肌糖原含量显著降低。这说明尽管机体的代谢水平随着复氧时间的增加而逐渐恢复,但仍需部分厌氧糖酵解产生ATP为机体供能,这与大弹涂鱼(Boleophthalmus boddaerti)和梭鱼(Liza haematocheila)的研究结果相似[28-29]。已有研究显示,鱼类的白肌组织是乳酸产生和清除的主要部位[30],本实验说明军曹鱼肌肉具备一定的厌氧代谢能力,可以通过厌氧代谢提供能量,从而使LDH和糖原含量维持在一定的范围内,有利于减少肝脏等重要器官的损伤,也有利于提高军曹鱼适应低氧环境的能力。
5 结论
低氧胁迫与恢复对军曹鱼机体的氧化应激和能量利用有显著的影响。在低氧胁迫阶段,军曹鱼幼鱼抗氧化酶活力存在显著差异,无氧代谢增加;在复氧阶段,不同组织的抗氧化应激能力不同,且肝脏在抗氧化应激防御体系中发挥重大作用。随着复氧时间的增加,机体能量供应能够通过自身的生理调节逐渐恢复到正常水平,说明军曹鱼具有一定的抗逆性。
致谢:感谢广东海洋大学水产学院2017级曹勤、曹丹煜及2018级邝杰华、蔡润佳、黄宝松、毛非凡、邓文鑫在样品采集中给予的帮助。
