黄、东海春季海水胞外酶活性水平分布特征研究
2020-05-23张正雨田继远于娟杨桂朋崔煜陈得萍高萍许瑞陈容
张正雨,田继远,于娟,2*,杨桂朋,2,崔煜,陈得萍,高萍,许瑞,陈容
(1. 中国海洋大学 海洋化学理论与工程技术教育部重点实验室,山东 青岛 266100;2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室,山东 青岛 266071;3. 青岛农业大学 食品科学与工程学院,山东 青岛 266109;4. 自然资源部第一海洋研究所,山东 青岛 266061)
1 引言
胞外酶活性可以指示水环境中有机物的分布特征以及微生物的营养状况。Chróst等[4]指出营养盐对碱性磷酸酶活性有显著影响,在周围环境和细胞内可利用的无机磷充足时,磷酸酶在微生物体内的合成会受到抑制,只有当可利用的磷酸盐被消耗达到临界值,这种抑制才会解除,即“抑制-诱导机制”。胞外酶活性受环境温度[5]、pH[6]、重金属离子、UV-B[7]等条件的影响,且同种因素对不同酶活性的影响也不同。目前水体中胞外酶的研究主要涉及葡萄糖苷酶、半乳糖苷酶、几丁质酶、肽酶、磷酸酶、硫酸酯酶、脂肪酶等,其中对碱性磷酸酶的研究较多[8-10]。国内外已对沉积物[10-11]、湖泊河流水[12-13]、海水[8,14]以及大洋环流[9,15]中的磷酸酶进行了研究。研究表明碱性磷酸酶可作为水体中磷状况的指示因子[16-18],而且不同海区碱性磷酸酶的主要来源不同。姜经梅等[11]指出长江口潮滩表层沉积物中碱性磷酸酶活性与降解磷细菌丰度有显著正相关,洪华生等[8]对厦门西港海域海水的研究指出浮游植物的碱性磷酸酶活力占主导地位。国际上对其他胞外酶也有报道[19-21],但国内研究较少,中国近海海水胞外酶活性的研究大多针对单一胞外酶,且研究区域限于台湾海峡[22]、胶州湾[23]、黄海和渤海[24]等海域,对于黄、东海大面积胞外酶活性的分布尚无报道。本研究扩大了胞外酶研究区域,并探讨了其影响因素,有助于进一步了解胞外酶对有机碳的降解作用。
测定胞外酶活性最常用的办法是荧光模拟底物法[25](Fluorogenic Model Substrates,FMS)。该方法所用底物通常具有一个人工荧光发色基团[6,26],如7-氨基-4-甲基香豆素(7-Amino-4-Methylcoumarin,AMC)、4-甲基伞形酮(4-Methylumbelliferone,MUF);一个或多个天然小分子基团(葡萄糖、氨基酸等),二者通过肽键或者酯键相连。在胞外酶的作用下,键断裂释放出荧光发色基团从而被荧光分光光度计检测。
黄、东海东临太平洋,西接中国大陆,陆架面积占总海域的70%以上,是最具代表性的大陆架浅海。黄、东海有长江、黄河等众多河流输入,同时受黄海冷水团、台湾暖流、沿岸流、黑潮等的影响,加上人为活动的输入,生态环境复杂,具有重要研究价值。胶州湾位于山东半岛东南部、黄海西岸。胶州湾及青岛沿岸工业、养殖业、港口发达,受人为活动影响较为明显,近年来随着海洋经济的发展,水体富营养化程度日益严重。由于同时受陆地、潮流、黄海的影响,环境复杂。本文选取胶州湾湾口附近海域、黄海海域、东海海域进行研究。运用FMS对2017年春季黄、东海以及2018年春季胶州湾湾口附近海域表层海水中的8种胞外酶(碱性磷酸酶(Alkaline Phosphatase,AP)、肽酶(Leucine Aminopeptidase,AMP)、脂肪酶(Lipase,LIP)、几丁质酶(Chitinase,CHI)、纤维素酶(Cellulase,CEL)、α-D-葡萄糖苷酶(α-D-Glucosidase,AGLU)、β-D-半乳糖苷酶(β-D-Galactosidase,BGAL)、木糖苷酶(Xylosidase,XYL))活性的水平分布特征进行了研究,并探讨了环境因素对胞外酶活性的影响,对进一步了解中国近海海水中有机物循环和能量流动具有重要意义。
2 材料与方法
2.1 样品的采集和保存
分别于2017年3月25日至4月15日、2018年4月28日至29日,随“东方红2号”调查船对黄、东海(26°~36°N,120°~128°E)的 44 个大面站位及胶州湾附近海域(35.8°~36.2°N,120.0°~121.2°E)的 10 个站位表层海水进行采样并测定胞外酶活性(图1),研究其水平分布。
2017年航次由北向南布设 A、B、C、D、FJ、F、P、E、S、T 10个断面,其中B、C断面位于黄海冷水团,长江口区域包括D、FJ、F、P 4个断面。黄海与东海的分界线为长江口北岸启东角与朝鲜半岛南侧济州岛西南角之间的连线,本次调查将D断面视为黄海与东海之间的分界(D断面不计入黄海、东海酶活性平均值的计算)。
现场海水采用12 L采水器(Niskin Rosette)进行采样。现场温度、盐度、水深由CTD(Sea-Bird 911 plus)获得。取250 mL海水样品用0.22 μm的微孔滤膜过滤后,-20℃冷冻保存,待运回陆地实验室后尽快测定酶活性。
2.2 胞外酶活性的测定
胞外酶活性测定方法为FMS,所测定的8种胞外酶所对应的底物分别是:4-甲基伞形酮酰磷酸酯(AP)、4-甲基伞形酮油酸酯(LIP)、L-亮氨酸-7-氨基-4-甲基香豆素盐酸盐(AMP)、4-甲基伞形酮-β-D-纤维素二糖苷(CEL)、4-甲基伞形酮-α-D-吡喃葡萄糖苷(AGLU)、4-甲基伞形酮-β-D-吡喃半乳糖苷(BGAL)、4-甲基伞形酮-N-乙酰基-β-D-氨基葡萄糖苷(CHI)、4-甲基伞形酮-β-D-木糖苷(XYL)。实验所用试剂均购自Sigma公司。
你说说,时为国家电网公司生产技术部主任的邓永辉会缺钱吗?肯定不缺!然而,邓永辉却以买房缺钱的名义,向北京泽源惠通科技公司老板刘某提出借款300万元。刘某当然清楚,这是邓永辉在讹他,明知是个当也得装憨去上哇,因为他要依靠邓永辉在国家电网的地位牵线做业务。因此,刘某先后5次送给邓永辉362万元和一套价值34.7万元的红木家具。

图1 2017年春季黄、东海(a)和2018年春季胶州湾附近海域(b)采样站位Fig. 1 Sampling stations in the Yellow Sea and the East China Sea in spring 2017 (a) and in the Jiaozhou Bay nearby waters in spring 2018 (b)
将底物加入已过滤的海水样品中使底物最终浓度为2 μmol/L,在现场海水温度及黑暗条件下进行反应。分别在0 h和2 h取3 mL反应物于石英比色皿中,加入 200 μL CAPS 缓冲溶液(3-环已胺-1-丙磺酸,pH 10.3),用荧光仪(HITACHI,F-4500)测定其荧光强度。用煮沸20 min的海水作为空白。其中缓冲溶液具有终止反应及增加荧光密度的作用。荧光物质的激发波长和发射波长分别为365 nm和455 nm(MUF)、380 nm和440 nm(AMC)。在相应酶的作用下,底物被分解并释放出小分子基团和荧光发色基团,通过测定荧光发色团的荧光强度,根据荧光强度与底物浓度之间的标准曲线,计算胞外酶对底物的水解速率,即胞外酶活性,单位为 pmol/ (L·h)。
酶活性计算公式:v=(F-F0)/(t×k)。式中,v为酶水解底物的速率,单位为pmol/(L·h);F为反应2 h后的荧光强度;F0为0 h时的荧光强度;k为单位浓度标准荧光物质的荧光强度;t为反应时间,单位为h。
2.3 Chl a含量及营养盐的测定
Chla含量的测定采用Parsons等[27]的测定方法。用90%的丙酮溶液低温萃取24 h后,F-4500荧光仪测定荧光值。硝酸盐亚硝酸盐磷酸盐的分析方法参照Grasshoff等[28];氨氮测定方法参照Holmes等[29],采用全自动间断化学分析仪(QuAAtro,Seal Analytical)分析,在航次中采集水样后立即测定。
Chla和营养盐数据来源于本航次的共享数据,分别由厦门大学高亚辉老师、中国海洋大学辛宇老师课题组提供。
2.4 数据处理
每个样品的酶活性平行测定3次,取平均值,用数据分析软件Origin 8、ODV 4和IBM SPSS Statistics 22.0处理数据和作图。数据结果间的显著性差异采用t检验分析,置信区间设置在95%。
3 结果与分析
3.1 表层海水胞外酶活性水平分布
3.1.1 2017年春季黄、东海
2017年春季黄、东海表层海水温度变化趋势为由北向南逐渐升高,长江口附近受河流输入的影响,盐度较低。东海东南部受高温、高盐的黑潮水影响,温度、盐度均较高(图2)。表层海水AP和LIP活性高值区均分布在C断面,即苏北沿岸至济州岛之间的海域,且最大值(AP:38 530 pmol/(L·h),LIP:23 473 pmol/(L·h))均出现在 C2 站位(33.75°N,122.15°E),酶活性以C2站位为最高值点向四周逐渐降低。CEL活性高值站位为苏北沿岸的C1(413 pmol/(L·h))、C3(456 pmol/(L·h))站位,AGLU 活性高值区也分布在苏北沿岸的 C1(558 pmol/(L·h))、C3(494 pmol/(L·h))站位,以及长江口外海海域的 P4(457 pmol/(L·h))站位。AMP、CHI、BGAL、XYL均在长江口以东的外海存在高值区(图2)。
黄、东海8种酶活性平均值排列顺序由大到小依次为: AP(5 891 pmol/(L·h))、LIP(4 760 pmol/(L·h))、AMP(2 241 pmol/(L·h))、CHI(235 pmol/(L·h))、AGLU(155 pmol/(L·h))、BGAL(155 pmol/(L·h))、CEL(136 pmol/(L·h))、XYL(71 pmol/(L·h))(表 1),其中AGLU和BGAL的活性基本一致。
3.1.2 2018年春季胶州湾附近海域

图2 2017年春季黄、东海表层海水温度、盐度及8种胞外酶活性水平分布Fig. 2 The distributions of temperature, salinity and eight extracellular enzyme activities in the surface waters of the Yellow Sea and the East China Sea during spring 2017

表1 2017年春季黄、东海表层海水温度、盐度和胞外酶活性的变化范围及平均值Table 1 Variation and average of temperatures, salinities and eight extracellular enzyme activities in the Yellow Sea and the East China Sea during spring 2017
2018年春季胶州湾附近海域表层海水盐度由近岸向远岸逐渐增加。AP在8种胞外酶活性中最高(1 865 pmol/(L·h)),LIP 与 XYL 活性分布均为近岸高于远岸,CHI活性分布趋势为近岸低于远岸,AMP活性分布大致为由北向南逐渐升高。LIP、AMP和CEL 均在胶州湾湾口处有高值(LIP:4 442 pmol/(L·h);AMP:2 050 pmol/(L·h);CEL:310 pmol/(L·h)),BGAL 活性最高值(423 pmol/(L·h))站位为#3(图 3)。
胶州湾附近海域胞外酶活性的平均值排列顺序由大到小依次为:AP(1 865 pmol/(L·h))、LIP(1 821 pmol/(L·h))、AMP(1 499 pmol/(L·h))、XYL(397 pmol/(L·h))、AGLU(186 pmol/(L·h))、BGAL(133 pmol/(L·h))、CHI(109 pmol/(L·h))、CEL(106 pmol/(L·h))(表 2),其中CHI和CEL的活性基本一致。
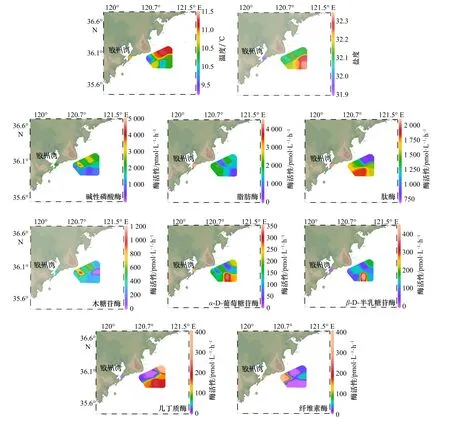
图3 2018年春季胶州湾附近海域表层海水温度、盐度及8种胞外酶活性水平分布Fig. 3 The distributions of temperature, salinity and eight extracellular enzyme activities in the surface waters of the Jiaozhou Bay nearby waters during spring 2018
用SPSS 22对酶活性平均值进行t检验。黄海的AP和LIP平均酶活性均显著高于东海和胶州湾附近海域(p<0.05);BGAL、XYL 平均酶活性为东海显著高于黄海(p<0.05);调查海域中的 AP、LIP、AMP 的平均酶活性均显著高于其他5种酶活性(CHI、CEL、AGLU、BGAL、XYL)(p<0.05)(图 4)。
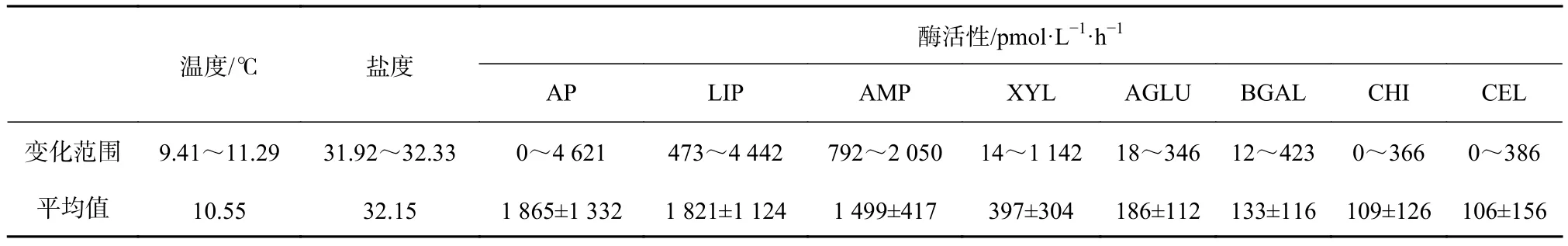
表2 2018年春季胶州湾附近海域表层海水温度、盐度和胞外酶活性的变化范围及平均值Table 2 Variation and average of temperatures, salinities and eight extracellular enzyme activities in the Jiaozhou Bay nearby waters during spring 2018
3.2 相关性分析
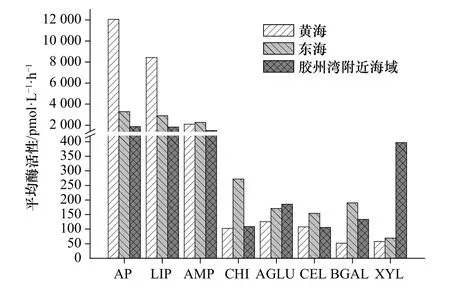
图4 2017年春季黄、东海和2018年春季胶州湾附近海域8种胞外酶的平均酶活性Fig. 4 Average activities of eight extracellular enzymes in the Yellow Sea and the East China Sea in spring 2017 and in Jiaozhou Bay nearby waters in spring 2018
将调查海域8种胞外酶活性之间,胞外酶活性与温度、盐度、Chla之间,AP活性与磷酸盐浓度之间,AMP活性与氨氮、硝酸盐、亚硝酸盐、总溶解无机氮(之和)浓度之间运用SPSS 22作皮尔孙(Pearson)相关性分析。黄、东海表层海水中 AP 与 LIP活性(r=0.883,p<0.01),AP与 CEL 活性(r=0.314,p<0.05),CHI与 BGAL 活性(r=0.606,p<0.01),CEL 与 AGLU 活性(r=0.862,p<0.01)之间存在正相关;温度与 BGAL(r=0.412,p<0.01)、CHI(r=0.326,p<0.05)活性呈正相关,与 LIP 活性呈负相关(r=-0.360,p<0.05)(表 3,表 4);AP 活性与磷酸盐浓度呈正相关(r=0.311,p<0.05),AMP 活性与无机氮盐浓度之间无显著相关性(p>0.05)。
胶州湾附近海域海水中AP与XYL活性呈正相关(r=0.817,p<0.01),其余酶活性之间无显著相关性(p>0.05);LIP 活性与盐度呈负相关(r=-0.851,p<0.01)(表 4)。
4 讨论
AP可由浮游植物、浮游动物和细菌产生,研究季节和海域不同,其来源主体也不尽相同[30]。AP活性受水体中溶解无机磷和小分子溶解有机磷浓度的影响[31]。磷酸盐与AP活性之间的关系目前有两种解释:一种解释是AP与磷酸盐之间存在“抑制-诱导”机制,AP活性为磷胁迫的指示因子[32]。另外一种解释是在富营养化水体中,AP与富营养化程度有关[33-35]。Taga和Kobori[33]对东京湾富营养化水体的研究表明,AP活性与磷酸盐浓度呈正相关。在本次调查海域中,AP活性与磷酸盐浓度呈正相关,与Taga和Kobori[33]的研究结果相似。这可能是因为调查海域水体营养盐含量较高。苏北沿岸有淮河、射阳河等多条河流入海,携带了大量的营养物质,在沿岸水的作用下向外海扩张,同时苏北浅滩处大量的水产养殖、紫菜养殖也造成了附近水体富营养化[36-37]。长江口河流输入更是带来大量营养盐。磷酸盐分布显示长江口、苏北沿岸及南黄海中部为正磷盐高值区,其营养盐浓度较开阔大洋[32]要高出很多。青岛沿岸排污及人为活动向近海输入营养盐,导致近岸AP活性略高于远岸,与2017年黄、东海结果相似。相关性分析显示,在此海域AP活性与Chla无显著相关性,表明浮游植物分泌产生的AP可能不是该海域游离态AP主要的贡献者。本调查结果中黄、东海和胶州湾附近海域AP活性与宋福行[23]对胶州湾4月份的调查结果相近。

表3 2017年春季黄、东海和2018年春季胶州湾附近海域8种胞外酶活性之间的相关性分析Table 3 Correlation analysis between eight extracellular enzyme activities of the Yellow Sea and the East China Sea during spring 2017 and the Jiaozhou Bay nearby waters during spring 2018
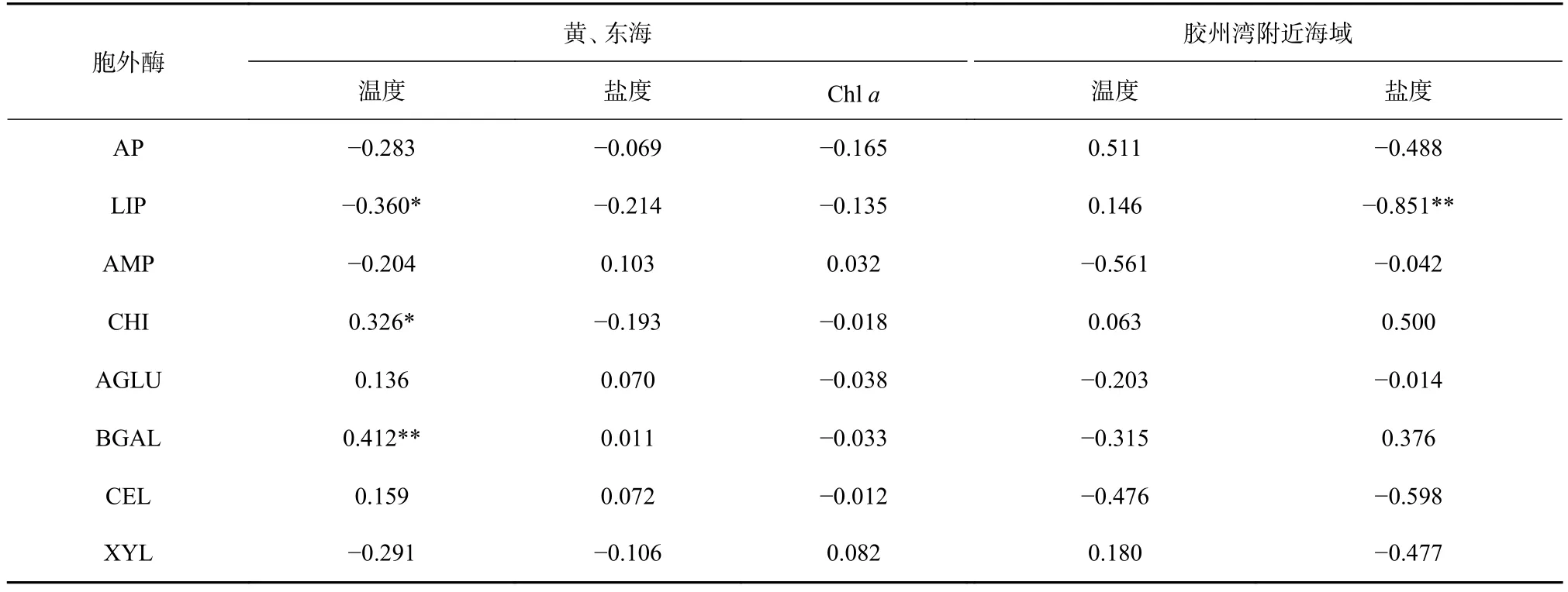
表4 温度、盐度及Chl a与8种胞外酶活性的相关性分析Table 4 Relationship between temperature, salinity, Chl a and eight extracellular enzyme activities
LIP能够将脂肪裂解为甘油和脂肪酸,在脂质转化中起到主要作用。在水生生态系统中,LIP来源于活的微生物输出或者在细胞破裂后作为游离酶释放[38]。水体中的脂肪占所有有机物的3%~55%,主要来自于活的以及死亡的浮游植物、浮游动物和大型植物[39]。相关性分析结果显示2017年春季黄、东海AP与LIP活性之间存在显著正相关,LIP活性高值区与AP活性高值区基本吻合。春季南黄海中部海域上层水体温度开始升高,Chla分布显示南黄海中部区域存在Chla含量高值区,表明上层水体浮游生物随温度升高开始大量繁殖,加上苏北沿岸大量水产养殖业对水体脂质的输送,导致该区域水体脂肪含量上升,这可能是该海域LIP活性高的原因。在东海的东南部因为受到高温高盐寡营养盐的黑潮水入侵,Chla含量较低,所以该区域LIP活性也较低。2018年春季胶州湾LIP活性与盐度呈显著负相关,间接表明了该区域LIP活性可能与河流输入有关。
在自然环境中,AMP和其他蛋白水解酶共同组成了细胞利用外源蛋白质的微生物酶体系。多肽和蛋白质是水体中微生物最重要也是最容易利用的碳、氮和能量来源,但它们必须先被胞外酶降解成小分子的肽或氨基酸才能被吸收利用,因此AMP对于微生物利用蛋白质具有重要作用。AMP广泛存在于海水中,由细菌、蓝藻、浮游植物及浮游动物合成[21]。研究表明AMP与水体中的蛋白质(藻类细胞降解产物)有关,AMP在藻华衰退期迅速合成[4];谷体华等[40]在对台湾海峡南部上升流区的研究得出,近岸高含量的溶解有机氮是诱导亮氨酸氨肽酶合成的主要原因。在山东半岛南部至苏北沿岸及长江口以东的外海因河流和人为输入带来了大量蛋白质,可能导致该海域AMP活性较高。本调查结果中AMP活性与溶解无机氮之间无明显的相关性,与Williams和Jochem[41]对佛罗里达湾的研究结果相同。黄、东海和胶州湾附近海域AMP活性低于谷体华等[40]对6月份台湾海峡南部上升流区的调查(AMP:21.40 nmol/(L·h)),这主要与测定方法的底物浓度不同有关。
黄、东海和胶州湾附近海域表层海水中与糖类水解相关的酶(CHI、CEL、AGLU、BGAL、XYL)活性低于其他酶活性,与Brown和Goulder[20]及Mudryk和Skórczewski[42]等的结果相似,这可能是因为糖类水解酶的游离态在总酶中所占比例较小[43-44]。温、盐分布图显示在济州岛附近有一个向西南方向延伸的温盐舌,位于此处的D6站位多糖及总糖的浓度较高[45],糖类水解酶的活性也比周围的高。对比2017年春季黄、东海多糖浓度分布发现,多糖浓度高值区与糖类水解酶活性高值区存在重合,证明了酶活性与底物浓度直接相关。调查海域CHI和BGAL活性都与温度呈正相关,Vetter和Deming[5]研究表明温度对几丁质酶影响较明显。除去温度对酶活性的影响,也可能存在多糖浓度分布变化导致的酶活性变化。黄、东海表层海水酶活性相关性分析显示CHI和BGAL、CEL和AGLU活性之间存在显著正相关,Arrieta和Herndl[19]、Tholosan 等[46]及 Unanue等[47]对酶动力学研究表明有不同种类β-葡萄糖苷酶共同作用,表明这些酶之间可能存在共同作用来降解多糖。但也不排除是因为这些酶活性的影响因素大致相同而导致的酶活性分布出现相似性。除AMP以外,调查海域其余胞外酶活性均低于赵丽军等[24]对秋末黄、渤海的调查,这主要与研究的季节、海区不同有关。
5 结论
酶活性分布受调查海域的营养状况及相应底物浓度影响较大。2017年春季黄、东海表层海水中AP和LIP活性高值区出现在苏北沿岸和南黄海中部。其余 6种酶(AMP、CHI、CEL、AGLU、BGAL、XYL)活性高值区出现在长江口以东的外海,AP活性与磷酸盐浓度呈正相关(p<0.05)。2018年春季胶州湾附近海域AP、LIP、XYL活性分布均大致为近岸高于远岸,CHI活性为近岸低于远岸。
2017年春季黄、东海表层海水中8种酶活性平均值排列顺序由大到小依次为:AP、LIP、AMP、CHI、AGLU、BGAL、CEL、XYL,其中 AGLU 和BGAL 的活性基本一致。2018年春季胶州湾附近海域海水中8种酶活性平均值排列顺序由大到小为:AP、LIP、AMP、XYL、AGLU、BGAL、CHI、CEL,其中 CHI 和 CEL 的活性基本一致。东海的BGAL、XYL平均酶活性显著高于黄海。黄海的AP和LIP平均酶活性显著高于东海和胶州湾附近海域。糖类水解酶(CHI、CEL、AGLU、BGAL、XYL)平均酶活性在黄海最低。
调查海域多种酶活性之间存在相关性。黄、东海表层海水中 AP与 LIP、CEL,CHI与 BGAL,CEL与AGLU活性之间均存在显著正相关(p<0.01),胶州湾附近海域海水中AP与XYL呈正相关(p<0.01)。这些酶活性的影响因子可能相似,或在酶与酶之间可能存在协同作用。
致谢:本实验2017年春季黄、东海Chla数据由厦门大学高亚辉老师课题组提供;营养盐数据由中国海洋大学辛宇老师课题组提供,在此表示感谢。
