酿酒废糟中温和高温干式厌氧消化及微生物群落结构的研究
2020-05-23张腾王世朋孙照勇王松涛沈才洪
张腾, 王世朋, 孙照勇, 王松涛, 沈才洪
(1.四川大学建筑与环境学院,四川 成都 610065;2.泸州老窖股份有限公司,四川 泸州 646000)
中国是世界上主要的白酒生产国,白酒年产量约1 300万t[1]。酿酒废糟是白酒生产过程中主要固体副产物,主要由发酵谷物如高粱、玉米、小麦、大麦、大米以及稻壳等组成[2-3]。据推算,2015年中国酿酒废糟的年产量已经达到约4 000 万t。酿酒废糟的含水率较高,同时含有大量的易降解有机质,处置不当极易腐败并产生臭气,造成严重的环境污染。传统的处理方法是将酿酒废糟饲料化和焚烧,然而低蛋白和高纤维的特性使其动物适口性差[4],饲料化利用效率较低,难以推广应用;同时,较高的含水率使酿酒废糟不易焚烧,导致后续运行成本的增加以及二次污染的产生。因此,快速有效处理酿酒废糟并实现其资源化成为酿酒企业亟待解决的问题。
厌氧消化是将有机质通过微生物发酵转换为沼气,实现有机废弃物的减量化、无害化和资源化[5]。由于酿酒废糟中有机物固体质量分数达到了90%以上,因此可作为厌氧消化底物。相比于湿式厌氧消化(总固体质量分数<15%),干式厌氧消化(总固体质量分数>15%)优势十分明显,包括更小的反应器体积、更少的水消耗、更少的能量投入和更少的消化残渣等[6-7]。近年来,干式厌氧消化工艺在工程上的应用愈加广泛。2010年欧洲约60%的反应器采取干式厌氧消化工艺[8]。温度是影响厌氧消化过程的重要因素之一。目前,大多数厌氧消化系统都在中温(20~40 ℃)条件下运行,同时对高温(50~60 ℃)厌氧消化的研究也在不断增加[9]。高温可以更大程度削减病原体,缩短水力停留并提高沼气产量[10]。另外,高温可以促进木质纤维的降解,有利于处理木质纤维素原料[11]。酿酒废糟中纤维素、半纤维素及木质素含量较高,高温下可能更有利于酿酒废糟厌氧产沼气。然而也有研究者认为,高温下有机物降解菌活性高导致产酸更快,容易造成挥发性有机酸的积累[12]。SUN等[13]以啤酒糟为底物进行批次干式厌氧消化(固体质量分数为25%)试验,结果表明高温条件下甲烷产气率优于中温,最大甲烷产气率为310.4、220.1 mL·g-1有机质。SHI等[9]对比中温和高温玉米秸秆干式厌氧消化过程,发现高温干式厌氧消化在试验前期纤维素和半纤维素降解速率更快,但是高温干式厌氧消化过程的挥发性有机酸积累量是中温过程的5倍,这导致了高温反应器的pH值大幅度下降。厌氧消化是复杂的生物化学过程,其运行表现与微生物群落结构密切相关。LIU等[14]对比了不同温度(35、38、41和44 ℃)下玉米秸秆厌氧消化过程中微生物群落变化,结果发现随着温度的升高,厚壁菌门(Firmicutes)逐渐取代拟杆菌门(Bacteroidetes)成为绝对优势菌门。GUO等[15]发现中温厌氧消化系统中细菌和产甲烷菌的丰富度与均匀度都高于高温系统。YU等[16]研究了生物废物和污泥中高温共消化过程,发现中高温反应器中占主导地位的产甲烷菌同时包括甲烷杆菌(Methanobacterium)和甲烷八叠球菌(Methanosarcina),但是在高温反应器中优势菌属还包括甲烷热杆菌(Methanothermobacter)。MOSET等[17]发现高温厌氧消化系统较中温系统具有更高有机物降解能力和甲烷产率,然而高温系统的微生物多样性较低,特别是细菌群落。目前,干式厌氧消化多是以餐厨垃圾和农作物秸秆为主,以酿酒废糟为底物的研究较少。本研究以酿酒废糟为底物,探究中温和高温条件下的酿酒废糟干式厌氧消化过程中的运行表现,并比较2种温度条件下微生物群落结构演替规律,为酿酒废糟的干式厌氧消化工艺选择和优化提供理论基础。
1 材料与方法
1.1 试验材料
酿酒废糟由四川泸州某酒厂提供,经粉碎机(MKCA6-2,日本Masuko Sangyo公司)粉碎至3~5 mm,于-20 ℃冷冻储存。接种污泥取自本实验室处理市政污水处理厂脱水污泥的中温(37 ℃)厌氧消化反应器。酿酒废糟和接种污泥理化性质如表1所示。
1.2 试验方法
采用2 L玻璃反应器(工作体积为1 L),装入接种污泥后分别放入中温(37 ℃)、高温(52 ℃)培养箱进行饿养驯化7 d,按m(酿酒废糟有机物)∶m(接种污泥有机物)=1∶1混合均匀,此时混合物总固体质量分数为16%,取样并记为0 d样品。为了保证有机质充分降解,厌氧消化过程共持续70 d。反应器用硅胶塞密封,产生的沼气通过乳胶管导入到集气槽(有效体积1.5 L),通过集气槽刻度记录沼气体积后将其排出,记录频次为45 d(快速产气阶段)之前3 d记录1次,最后于70 d(产气停滞阶段)记录1次。为降低频繁打开反应器取样对厌氧体系中微生物产生的人为影响,同时根据厌氧体系微生物动态变化规律[18],厌氧消化污泥取样频次为45 d之前3~6 d取样1次,最后于70 d取样1次。样品分别储存于4和-80 ℃以用于理化性质测定和微生物群落结构分析。

表1 酿酒废糟和接种污泥理化性质Table 1 Physicochemical properties of distilled grain waste and inoculated sludge
注:NM表示未检测。
Note:NM means not measured.
1.3 模型建立及理论产沼气体积计算
酿酒废糟的厌氧消化产沼气的累积体积通过修正的Gompertz模型进行拟合,修正的Gompertz模型如下所示[18]。
y=Aexp{-exp[μme(λ-t)/A+1]}
(1)
式中:y为第t天物料累积沼气产量;t为发酵时间;A为物料产沼气潜力;μm为最大产气速率;λ为迟滞时间;e为自然常数。
酿酒废糟中的有机物可通过微生物发酵转换为沼气,有机物通常用分子式CaHbOcNd表示。因此,1 mol有机物CaHbOcNd的理论产沼气体积(L)可由Buswell方程式(2)和公式(3)算出。
(2)
(3)
1.4 理化性质测定
沼气体积采用排水法测定[19];总固体质量分数(total solid, TS):采用烘干法[20],将样品放在105 ℃烘箱(MOV-112(U),日本三洋公司)烘干至恒重测定;有机物质量分数(volatile total solid, VTS)和灰分质量分数(ash):采用灼烧法[21],将烘干至恒重的样品放入马弗炉(TMF-5T,日本托马斯公司)后在600 ℃下灼烧2 h测定;pH值采用pH计测定(pHS-3C);可溶性总有机碳(soluble total organic carbon, S-TOC)用总有机碳分析仪测定(TOC-VE,日本岛津公司);挥发性有机酸(volatile fatty acids, VFAs)用高效液相色谱测定(HPLC SCL-10Avp,日本岛津公司),包括乳酸、乙酸、丙酸和丁酸;碳、氢和氮的质量分数用元素分析仪测定(Vario EL,德国艾力蒙塔公司),碳氮比由碳和氮的质量分数比值求出,氧的质量分数由单位质量总固体减去碳、氢、氮和灰分的质量后求出;铵根离子(NH4+)用离子色谱仪测定(ICS-1100,美国戴安公司);木质素、纤维素和半纤维素质量分数用范式法测定[22]。
1.5 DNA提取及分析
样品微生物DNA采用CTAB法提取,DNA样品经过质检后送到上海美吉生物医药科技有限公司采用Illumina Miseq平台进行16S rRNA高通量测序。高通量测序用细菌和古菌通用引物515F(5′-GTGCCAGCMGCCGCGGTAA-3′)和909R(5′CCCCGYCAATTCMTTTRAGT-3′)扩增16S rRNA的V3~V5可变区。
测序原始数据首先采用Prinseq软件(PRINSEQ-lite0.19.5)进行质量控制,去掉低质量数据;并采用Flash软件去除引物序列、短片段、低复杂度等序列;最后用Usearch软件(V 8.0)检测嵌合体序列,去除嵌合体序列后得到有效数据。所有样品的全部有效序列利用Qiime软件以97%的相似性将序列聚类为操作分类单元(operational taxonomic units,OTU),再利用RDP Classifier软件(V 2.2)对OTU代表序列进行物种注释。
2 结果与分析
2.1 酿酒废糟中温和高温干式厌氧消化运行情况
2.1.1 酿酒废糟中温和高温干式厌氧消化累积产沼气体积对比 根据前期记录的产沼气体积以及修正的Gompertz模型,酿酒废糟中温和高温干式厌氧消化过程中累积产沼气体积变化趋势和拟合曲线如图1所示。中温和高温干式厌氧消化过程的累积产沼气体积相差不大,但产沼气速率在不同时段存在着较大差异。中温和高温系统在发酵初期6 d产沼气体积均较低,这可能是系统微生物对酿酒废糟原料需要一定的适应期。适应后产气速率快速增加,持续至40 d之后产气体积趋于平稳,发酵结束时2个系统的累积产沼气体积分别为16.25、16.90 L。根据酿酒废糟C、O、N和H元素的质量分数,推算其分子式为C3.572H6.08O2.5N0.164,用Buswell方程式(2)和公式(3)计算酿酒废物原料理论产沼气体积为39.33 L。因此,中温和高温系统沼气回收率分别为41.32%和42.97%。
利用Gompertz模型拟合得到的产沼气潜力、最大产沼气速率与迟滞时间的结果如表 2 所示。拟合得到中温和高温条件下酿酒废糟产沼气潜力分别为16.51、18.12 L,最大产沼气速率分别为0.519、0.454 L·d-1,迟滞时间分别为1.11、6.12 d。高温条件下酿酒废糟产沼气潜力高于中温,但中温条件下最大产沼气速率较大,且迟滞时间短于高温条件。
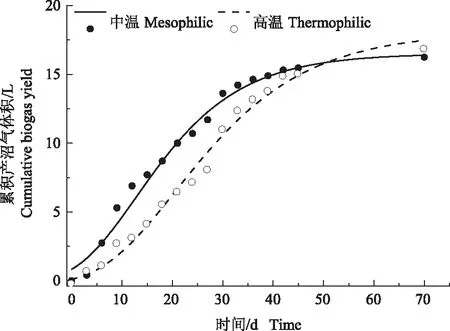
图1 酿酒废糟中高温干式厌氧消化累积产沼气体积和拟合曲线
表2 中温和高温累积产气曲线模型拟合参数
Table 2 Parameters of cumulative biogas yield fittingcurve during mesophilic and thermophilic conditions
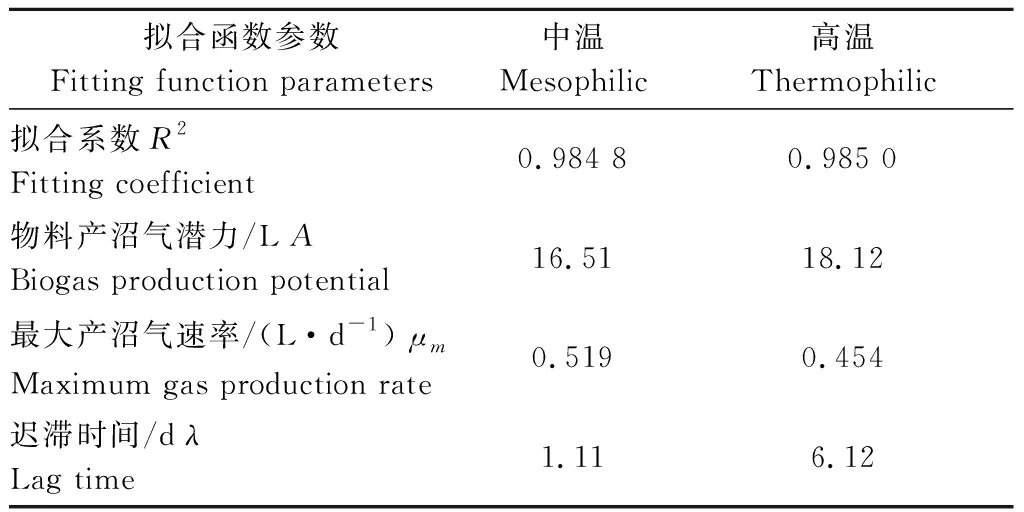
拟合函数参数Fitting function parameters中温Mesophilic高温Thermophilic拟合系数R2Fitting coefficient0.984 80.985 0物料产沼气潜力/L ABiogas production potential16.5118.12最大产沼气速率/(L·d-1) μmMaximum gas production rate0.5190.454迟滞时间/d λLag time1.116.12
2.1.2 酿酒废糟中温和高温干式厌氧消化挥发性有机酸和pH值变化 中温和高温干式厌氧消化系统运行过程中挥发性有机酸和pH值的变化如图2所示。酿酒废糟原料中含有大量挥发性有机酸,导致2个条件下初始挥发性有机酸含量较高,随着发酵进行,中温和高温反应器中的有机酸最终都被降解。中温系统中VFAs从消化开始就持续减少,32 d后被消耗殆尽,而高温系统中VFAs直到44 d后才被完全降解。其中,乳酸在中温和高温系统中快速降解,6 d后几乎没有乳酸被检测到;乙酸和丁酸在21 d有少量积累,之后几乎没有被检出;丙酸则在消化过程中不断积累。丙酸在中高温反应器中均先增加后降低,但中温系统中丙酸积累在6 d达到最大值,为1 477.54 mg·kg-1,随后逐渐降低在32 d被完全消耗,而高温系统中丙酸积累在32 d达到最大值,为1 939.76 mg·kg-1,随后逐渐降低在44 d被消耗完毕。2个系统pH值在6 d之前略微下降,之后随着挥发性有机酸消耗,pH值开始逐渐上升,最终中温和高温反应器pH值分别为8.55和8.43,均在厌氧消化适合pH范围内。
2.1.3 酿酒废糟中温和高温干式厌氧消化丙酸含量与产沼气速率变化 丙酸积累情况的不同会导致中温和高温条件下酿酒废糟产沼气速率的差异,丙酸含量和产沼气速率的变化情况如图3所示。2个系统中产沼气速率均先增加后降低,但中温系统中产沼气速率在12 d达到最大值,为0.517 L·d-1,随后逐渐降低至几乎不产沼气,而高温系统中产沼气速率在20 d达到最大值,为0.453 L·d-1,随后逐渐降低至较小值。不同温度下产沼气速率的变化趋势与丙酸相似。在整个厌氧消化过程中,中温系统在最大丙酸含量低于高温系统的同时获得了更大的最大产沼气速率,而且中温系统中最大产沼气速率出现的时间点和丙酸含量开始下降的时间点均早于高温系统。由此可见,高温系统中丙酸积累持续时间较长且最大丙酸含量较高,而中温系统在前期的产沼气速率大于高温系统,丙酸积累对高温系统的抑制程度强于中温系统。
2.2 微生物群落解析
2.2.1 酿酒废糟中温和高温干式厌氧消化微生物群落对比 酿酒废糟中温和高温干式厌氧消化微生物整体群落组成如图4所示。从基于OTU水平的主坐标分析(principal co-ordinates analysis,PCoA)的结果可以看出,微生物群落聚类为3簇:第1簇为M_0和T_0,由于初始接种污泥均来自中温厌氧消化系统,因此起始的微生物结构相似;第2簇为中温过程的所有样品;第3簇为高温过程的所有样品。这说明微生物群落结构在中温和高温干式厌氧消化过程中存在着显著的差异。此外,中温和高温系统微生物群落在发酵过程中也显示出逐渐变化的趋势。
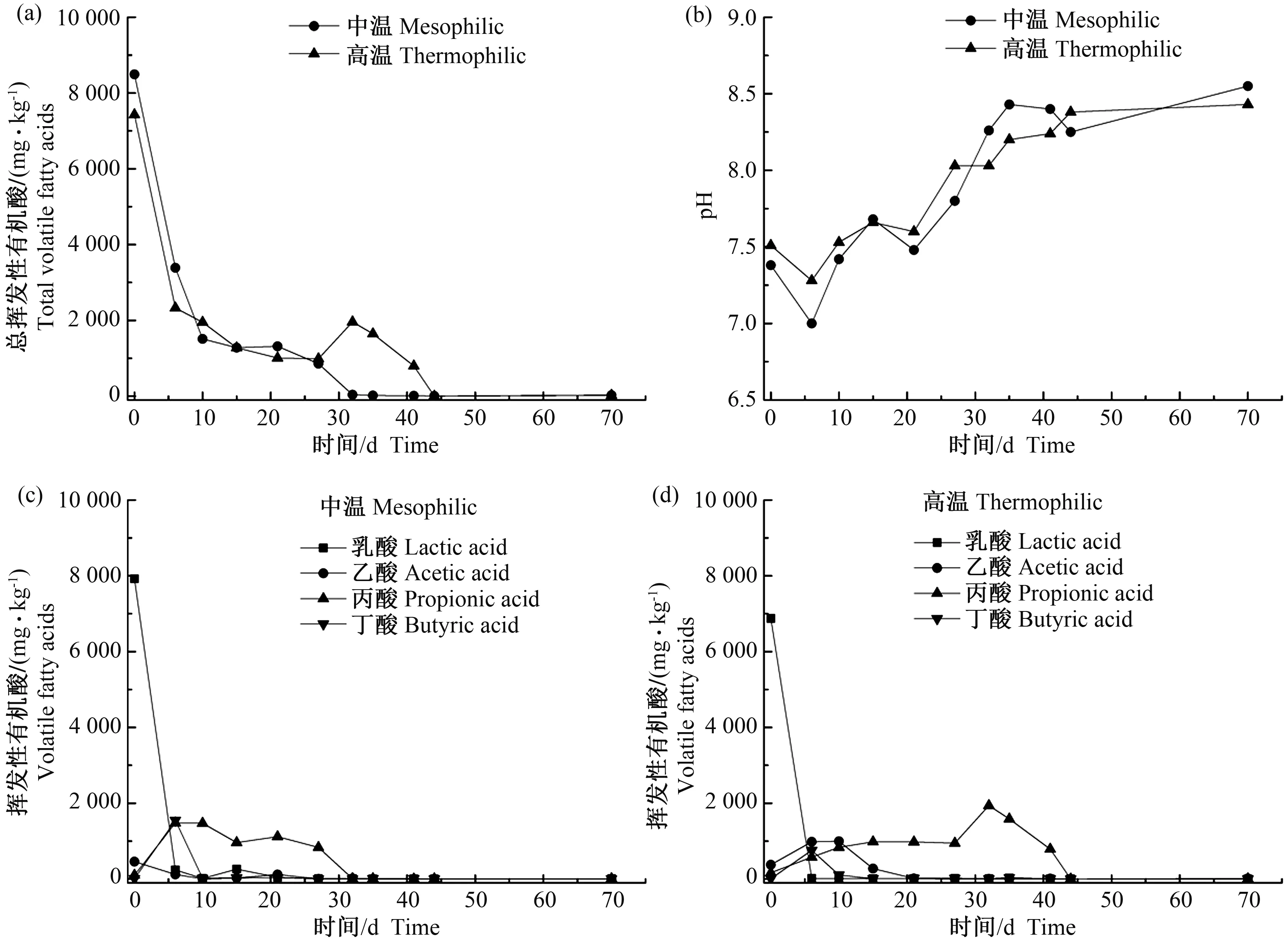
图2 酿酒废糟中温和高温干式厌氧消化过程有机酸和pH的变化
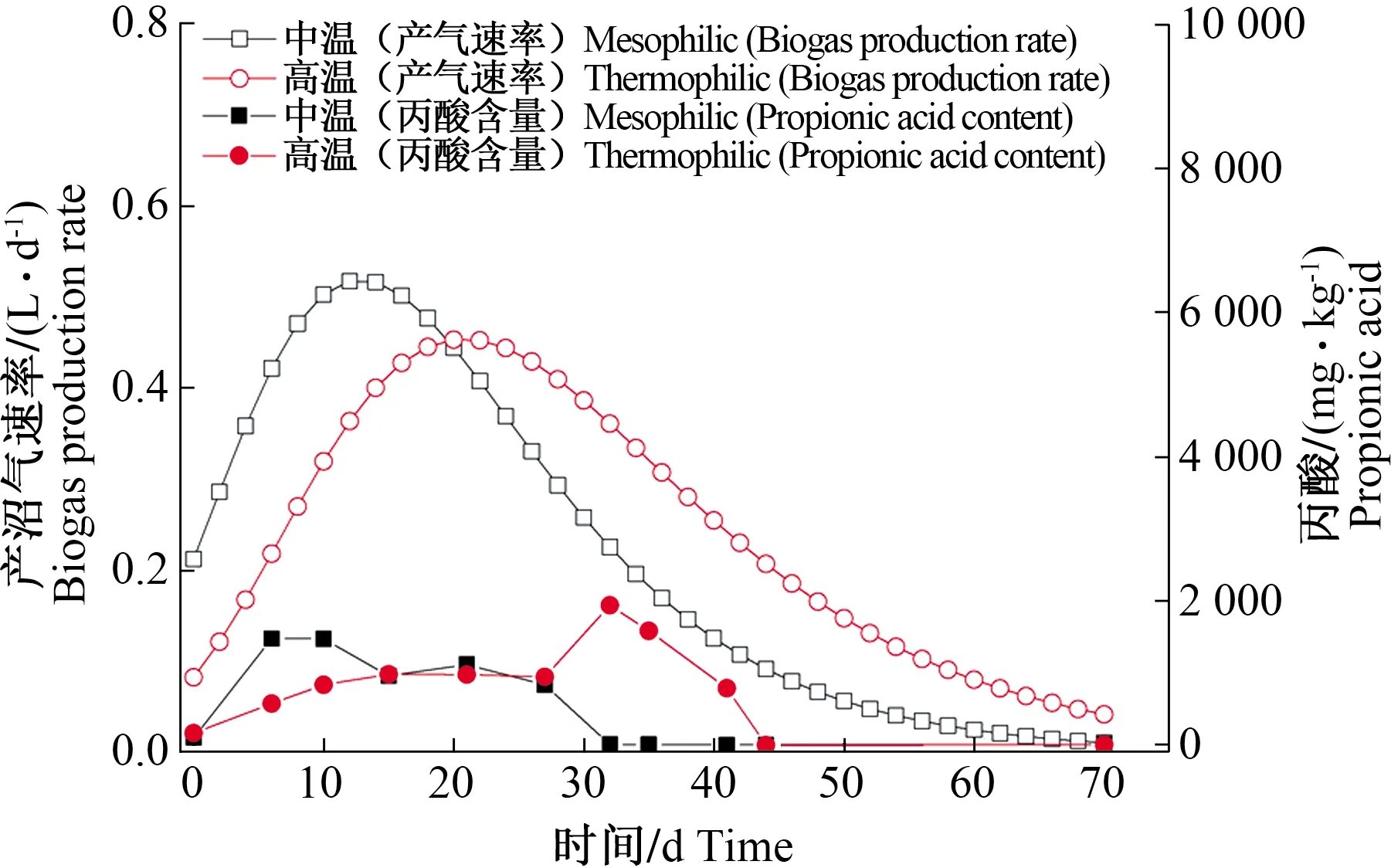
图3 酿酒废糟中温和高温干式厌氧消化过程丙酸和产气速率的变化
2.2.2 酿酒废糟中温和高温干式厌氧消化细菌门水平对比 图5和图6分别显示了酿酒废糟中温和高温干式厌氧消化过程中微生物群落在门水平的结构演替和组间差异。16S rRNA测序共检测到9个优势细菌门,分别是热袍菌门(Thermotogae)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、共温菌门(Coprothermobacteraeota)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、螺旋体门(Spirochaetes)和互养菌门(Synergistetes)。其中,热袍菌门、厚壁菌门和拟杆菌门是主要优势菌门,整体相对丰度为51.63%~83.76%,共温菌门、变形菌门、放线菌门、绿弯菌门、螺旋体门和互养菌门为第二优势菌门,整体相对丰度为16.25%~45.12%。分析中温和高温组间细菌门水平差异,可以看出热袍菌门、拟杆菌门和螺旋体门在中高温系统中差异较大。在中温和高温干式厌氧消化过程中,热袍菌门开始相差不大,随后均逐渐增加,在21 d后保持相对稳定,但高温系统中热袍菌门在前21 d增幅较大。中温系统中拟杆菌门在开始就高于高温系统,随后迅速增加,在6 d后保持相对稳定,而高温系统中拟杆菌门逐渐降低直到发酵结束。高温系统中未检测到螺旋体门,但中温系统中螺旋体门逐渐增加至消化结束。其他细菌门如厚壁菌门均缓慢降低;共温菌门、变形菌门和互养菌门均一直在波动,但波动范围不大;放线菌门在中温系统中相对稳定,在高温系统中略有降低;绿弯菌门均一直降低。从整体上看,这些细菌门有差异,但不显著。
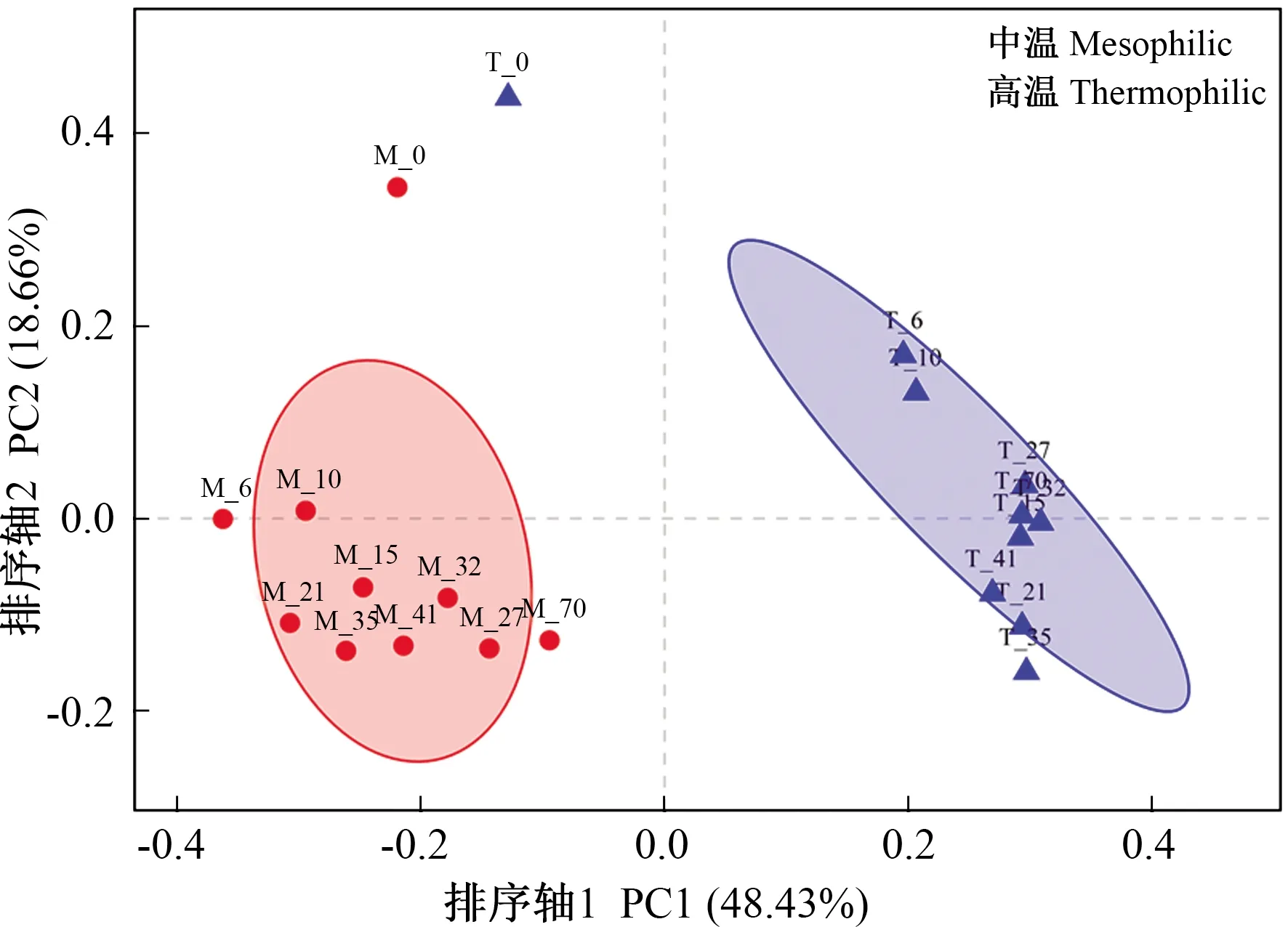
图4 酿酒废糟中温和高温干式厌氧消化过程微生物群落结构PCoA分析
2.2.3 酿酒废糟中温和高温系统干式厌氧消化细菌属水平对比 图7和图8分别显示了酿酒废糟中温和高温干式厌氧消化过程中微生物群落在属水平的结构演替和组间差异。可以看出,Defluvii-toga、Proteiniphilum、Coprothermobacter、Petrimonas、Clostridium_Sensu_stricto_8、Sphaerochaeta、Clostridium_sensu_stricto_1、Bacteroides等属是酿酒废糟干式厌氧消化过程中的优势属。分析中温和高温干式厌氧消化系统优势属之间的物种差异,发现Defluviitoga、Petrimonas、Clostridium_sensu_stricto_8在2个厌氧消化系统中差异较大。在中温和高温干式厌氧消化过程中,Defluviitoga开始相差不大,随后均逐渐增加,在21 d后保持相对稳定,但高温系统中Defluviitoga在前21 d增速较快。Petrimonas在中温系统中迅速增加,随后逐渐降低,但在高温系统中未被检测到。Clostridium_sensu_stricto_8在高温系统中迅速增加,随后逐渐降低,但在中温系统中未被检测到。其他优势细菌属如Proteiniphilum和Clostridium_sensu_stricto_1在中温系统中保持相对稳定,在高温系统中先增加后降低;Coprothermobacter均先降低后增加;Sphaerochaeta在中温系统逐渐增加,在高温系统中未被检测到;Bacteroides在中温系统先增加后降低,在高温系统中相对丰度很低。从整体上看,这些细菌属有差异,但不显著。
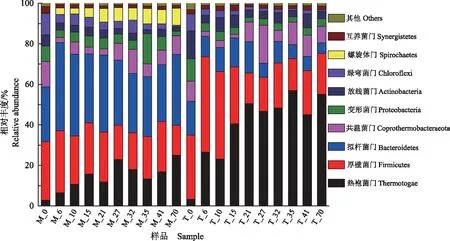
图5 酿酒废糟中温和高温干式厌氧消化细菌门水平组成
2.2.4 酿酒废糟中温和高温干式厌氧消化古菌群落结构对比 图9显示了酿酒废糟中温和高温干式厌氧消化古菌属水平组成及演替。可以看出,随着厌氧消化过程的进行,中温和高温干式厌氧消化系统的产甲烷菌的种类和丰度均发生了较大改变。中温和高温系统的初始古菌属组成存在着明显差异,其中高温系统中甲烷囊菌(Methanoculleus)、甲烷热杆菌(Methanothermobacter)和甲烷杆菌(Methanobacterium)显著高于中温系统,而甲烷八叠球菌(Methanosarcina)的相对丰度低于中温系统。2个系统的初始接种污泥均来自中温系统,分别在中温和高温系统中驯养7 d后古菌群落发生了显著的变化,高温系统出现了其独有的甲烷热杆菌,其相对丰度先降低后增加,酿酒废糟添加后中温系统出现了独有的甲烷泡菌(Methanofollis),且相对丰度呈现先增加后降低的趋势。随着厌氧消化的进行,2个系统中甲烷囊菌随着发酵时间的进行相对丰度逐渐增加,而甲烷八叠球菌与甲烷囊菌的变化趋势则相反,2个系统中其他种类产甲烷菌丰度在整个发酵过程中保持稳定。
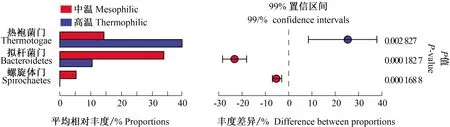
图6 细菌门水平组间差异显著性检验
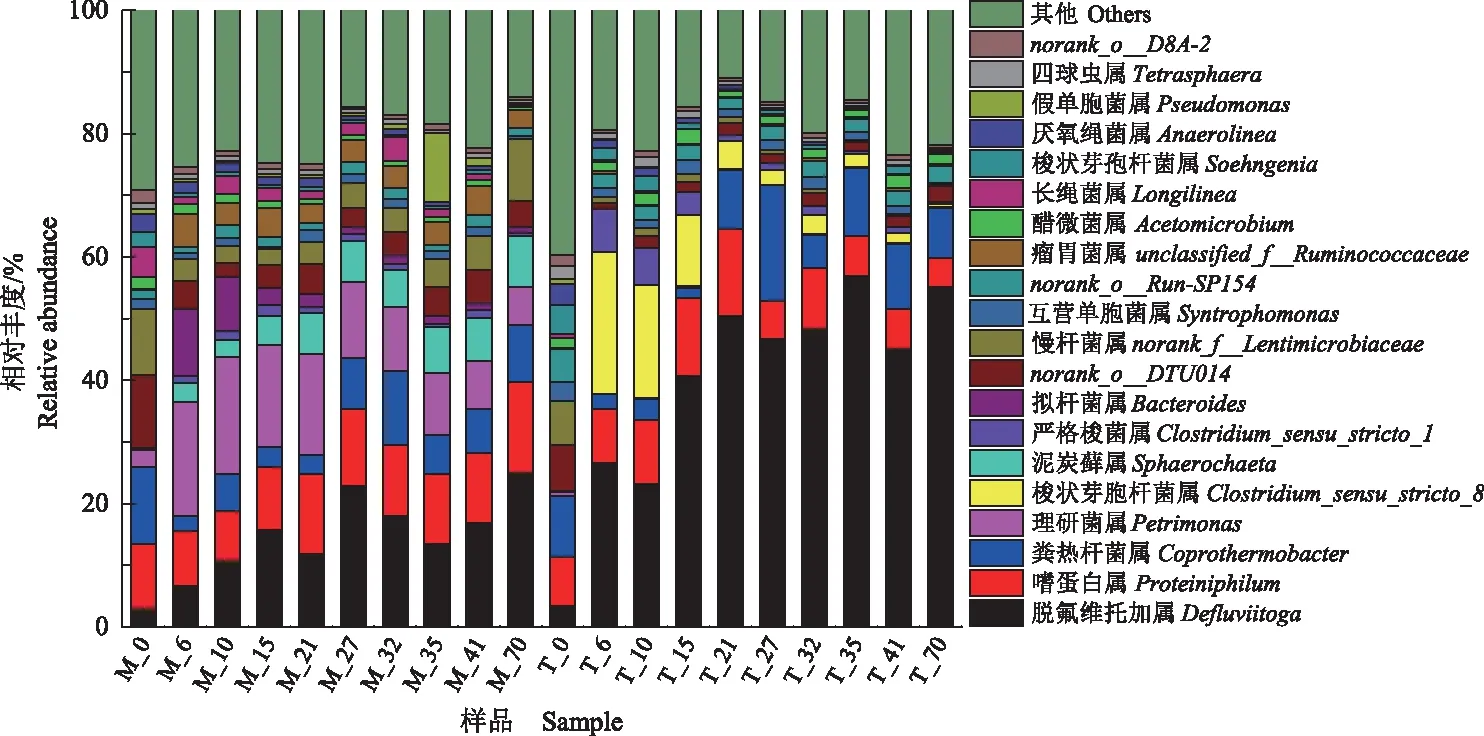
图7 酿酒废糟中温和高温干式厌氧消化细菌属水平组成
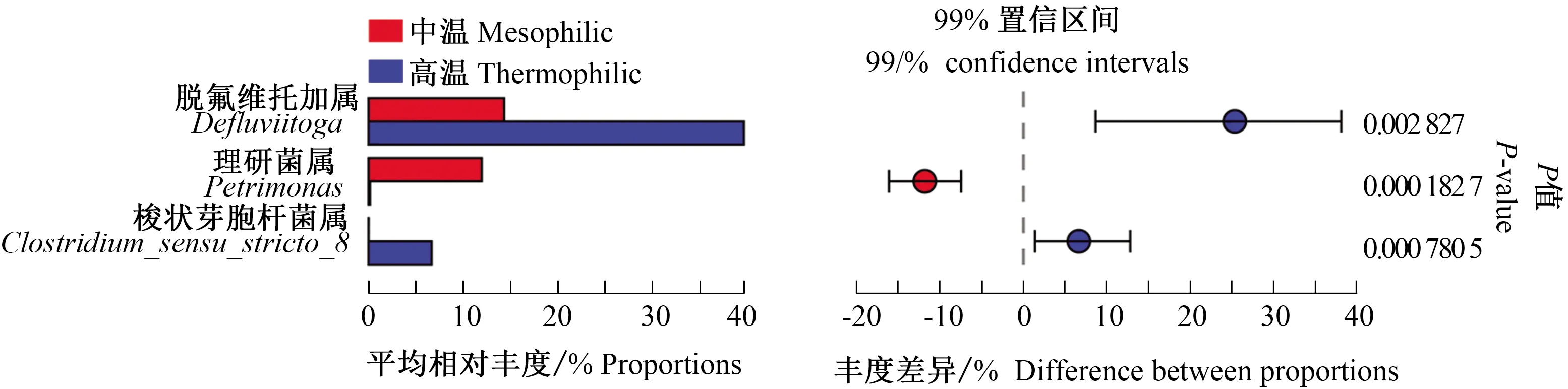
图8 细菌属水平组间差异显著性检验
3 结论与讨论
厌氧消化是多种微生物共同作用的生物化学过程。累计产沼气体积表明,在中温和高温条件下,利用酿酒废糟作为底物进行干式厌氧消化的最终累积产沼气体积差异较小。在本研究中,20 d之前中温系统的产沼气速率高于高温系统,之后高温系统的产沼气速率高于中温系统,推测是因为始接种污泥均为中温污泥,初始微生物群落结构可能更适应中温环境,导致中温系统迟滞期较短,且20 d之前中温系统产沼气速率较高,之后因为高温系统微生物群落经过充分驯化,活性提升导致高温系统的产沼气速率较高。发酵进行至40 d时中温和高温系统的累积产沼气体积相差不大,表明此时易被降解的有机物几乎降解完全,之后累积产沼气体积略微增加主要是由剩余难降解物质如木质纤维素成分导致。挥发性有机酸积累情况表明,乳酸、乙酸和丁酸在前期迅速降解,但丙酸在前中期有一定积累,且高温系统中丙酸积累持续时间较长,最大积累含量也高于中温系统。VEEKEN等[23]发现温度由20 ℃提高到40 ℃时,厌氧反应中生成丙酸的一级水解速率常数由0.03~0.15 d-1提高到0.24~0.47 d-1,这也说明在高温下丙酸可能更容易积累。丙酸转化为乙酸和氢气所需的吉布斯自由能较高,是所有挥发性有机酸中转化为乙酸和氢气最慢的。周晓臣[24]发现反应器过多的丙酸不仅影响复杂有机化合物向丙酸的转化,也影响丙酸向乙酸和氢气的转化,从而抑制了产甲烷过程。BARREDO等[25]发现当丙酸含量为1 500~2 220 mg·L-1时,产甲烷菌的数量随丙酸浓度的上升呈指数下降。这表明中温和高温反应器快速产气期的不同有可能和丙酸含量差异相关。
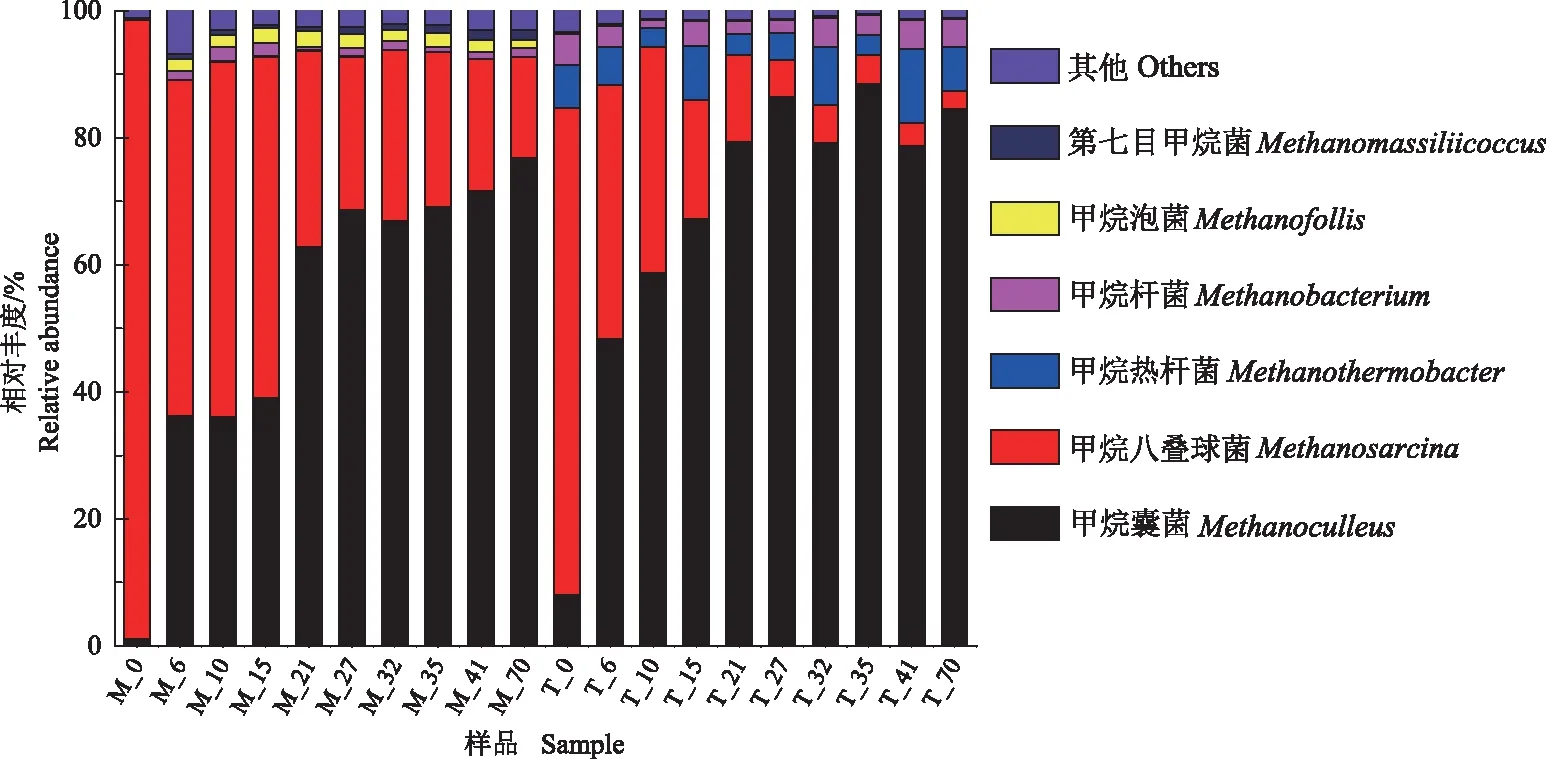
图9 酿酒废糟中高温干式厌氧消化古菌属水平组成
温度是影响厌氧消化过程微生物群落的重要因子,影响微生物的生长和繁殖[26]。在初始接种污泥来源相同的情况下,发酵温度的差异会给菌群结构的调整带来选择压力[27]。细菌门水平差异分析发现,热袍菌门在高温系统的平均相对丰度达到了39.61%,而中温时只有14.32%。研究表明热袍菌门物种多为嗜热菌,并可利用多种碳源包括己糖、戊糖、葡聚糖、木聚糖、果胶和纤维素等作为基质[28];拟杆菌门是可以水解纤维素、半纤维素和几丁质等多糖物质的菌群,在中温系统中平均相对丰度达到了33.73%,而在高温系统中仅10.51%。螺旋体门只在中温系统中被检测到,其相对丰度为5.29%,包含多种致病菌种,这说明高温有利于杀死病原菌。细菌属水平分析发现,Defluviitoga在高温系统中优势显著,其具有纤维素降解能力,最适生长温度为55 ℃,可降解纤维素为乙酸、氢气和二氧化碳[29]。有研究对比了餐厨垃圾与秸秆混合物中温和高温共消化系统的微生物群落结构差异,发现高温系统的木质纤维素降解细菌和放线菌具有明显优势,且体系的木质纤维素降解率高于中温体系[30]。由于酿酒废糟为高木质纤维素物料,所以推测高温系统的最终沼气产量略高于中温系统是由更多木质纤维素类物质的降解引起的。Petrimonas是中温系统的独有菌属,主要以糖类为底物。有研究报道,Petrimonas是以香菇和双孢菇基质为底物的中温半连续厌氧发酵的重要优势物种[31]。Clostridium是高温系统的独有菌属,梭菌菌群为中温和高温厌氧消化过程中普遍存在的水解酸化菌群,有研究表明该菌群能在高温条件下成为优势菌种[32]。在古菌属水平上,酿酒废糟干式厌氧消化开始时,高温系统出现了其独有的甲烷热杆菌,中温系统出现了独有的甲烷泡菌,表明温度对古菌群落的影响较大。酿酒废糟干式厌氧消化结束时,中温系统中产甲烷菌丰度占比前3的为甲烷囊菌、甲烷八叠球菌和甲烷杆菌,高温系统中产甲烷菌丰度占比前3的为甲烷囊菌、甲烷热杆菌和甲烷杆菌。该变化表明,氢营养型产甲烷菌逐渐取代了乙酸营养型产甲烷菌。
综上所述,酿酒废糟中温和高温干式厌氧消化过程的累积沼气产量相差不大,后续将采用经酿酒废糟驯化的污泥作为接种物,进一步分析酿酒废糟在中高温条件下厌氧消化的差异。产气速率在不同时段存在着较大差异,发酵前期中温系统产气速率高于高温,而后期高温系统高于中温系统;高温有有机酸尤其是丙酸存在积累的风险。中温和高温系统发酵过程中微生物群落结构的差异明显,热袍菌门是高温系统的优势细菌门,拟杆菌门和螺旋体门是中温系统的优势细菌门;细菌属水平上,高温系统的优势菌属为Defluviitoga和Clostridium,中温系统的优势菌属为Petrimonas。随着发酵过程的进行,中温和高温系统的产甲烷菌群落均由乙酸营养型占优势转变为氢营养型产甲烷菌占优势,但2个系统的产甲烷菌存在着明显的差异,高温系统出现了独有的甲烷热杆菌,而中温系统出现了独有的甲烷泡菌。
