219份甜瓜种质资源的遗传多样性分析
2020-05-23张凯歌胡倩梅靳志恒杨会会杨路明胡建斌朱华玉
张凯歌,胡倩梅,靳志恒,杨会会,杨路明,胡建斌,朱华玉
(河南农业大学园艺学院,河南 郑州 450002)
甜瓜(CucumismeloL.)为葫芦科甜瓜属二倍体一年生双子叶植物,其果色、香、味俱佳、营养丰富且具有较高的经济价值,在世界各地广泛栽培,为世界十大水果之一。中国的甜瓜栽培历史已有 2 000 年以上[1],是世界最大的甜瓜生产地。目前,关于甜瓜的起源研究依旧不够明确,但大部分学者比较认同非洲[2-6]和亚洲[7-8]为甜瓜的起源驯化中心。中国是薄皮甜瓜的初级和次级起源中心,是厚皮甜瓜的次级起源中心[3,9-11]。甜瓜是葫芦科植物中表型变异最为丰富的作物之一,在株型、叶片和果实等形态特征上具有广泛的多样性,其中果实的表型变异最为丰富,如果皮颜色、果面覆纹、果肉颜色、果肉硬度、可溶性固形物含量以及风味等[12-14]。KIRKBRIDE[15]依据营养器官和果实形态特征,幼果和子房上绒毛的长度以及分布将甜瓜分为厚皮甜瓜和薄皮甜瓜。其后,又有学者将其分为2个亚种和16个变种[16]。中国在20世纪70年代末就开展了甜瓜种质资源的收集与保存工作,为中国甜瓜科研工作者提供了一个很好的材料平台。目前,国家西瓜甜瓜中期库(由中国农业科学院郑州果树研究所建立)中保存的甜瓜种质近 2 000 份[17]。中国目前收集的甜瓜种质资源颇具规模,但在叶片、果实、种子等相关性状的遗传多样性以及相关性的研究上缺乏系统分析。针对甜瓜遗传多样性的研究较多,但多为通过形态性状进行遗传多样性分析[18-19]或利用各种分子标记来评价甜瓜种质的遗传多样性[20-22],而将分子数据同表型数据进行综合分析的研究较少。本研究从国内外甜瓜种质资源中选取在叶片、果实和种子遗传变异较大的219份甜瓜材料进行表型鉴定,在此基础上进行形态性状的相关性分析以及分子水平和形态水平的遗传多样性分析,旨在了解甜瓜种质不同性状间的互作关系以及遗传多样性的分布情况,为甜瓜种质资源的收集、引进以及育种工作提供理论依据。
1 材料与方法
1.1 植物材料
本研究收集了来自世界27个国家的219份甜瓜种质资源(表1)。其中亚洲185份,分别来自于中国105份、印度44份、日本12份,土库曼斯坦7份,以色列5份,阿富汗、韩国各3份,伊朗2份,马尔代夫、马来西亚、叙利亚、巴基斯坦各1份;北美洲16份,分别来自于美国12份,加拿大3份,墨西哥1份;南美洲1份来自厄瓜多尔;欧洲12份,包括土耳其3份、西班牙、英国、俄罗斯各2份,乌克兰、希腊、法国各1份;非洲5份,其中包括埃及2份,津巴布韦、塞内加尔、赞比亚各1份。这些材料包括88份厚皮甜瓜,96份薄皮甜瓜以及35份野生甜瓜。所有材料于2017、2018年在河南农业大学科教园区毛庄实验基地的塑料大棚进行种植,每份材料2个重复,每个重复内4个单株。
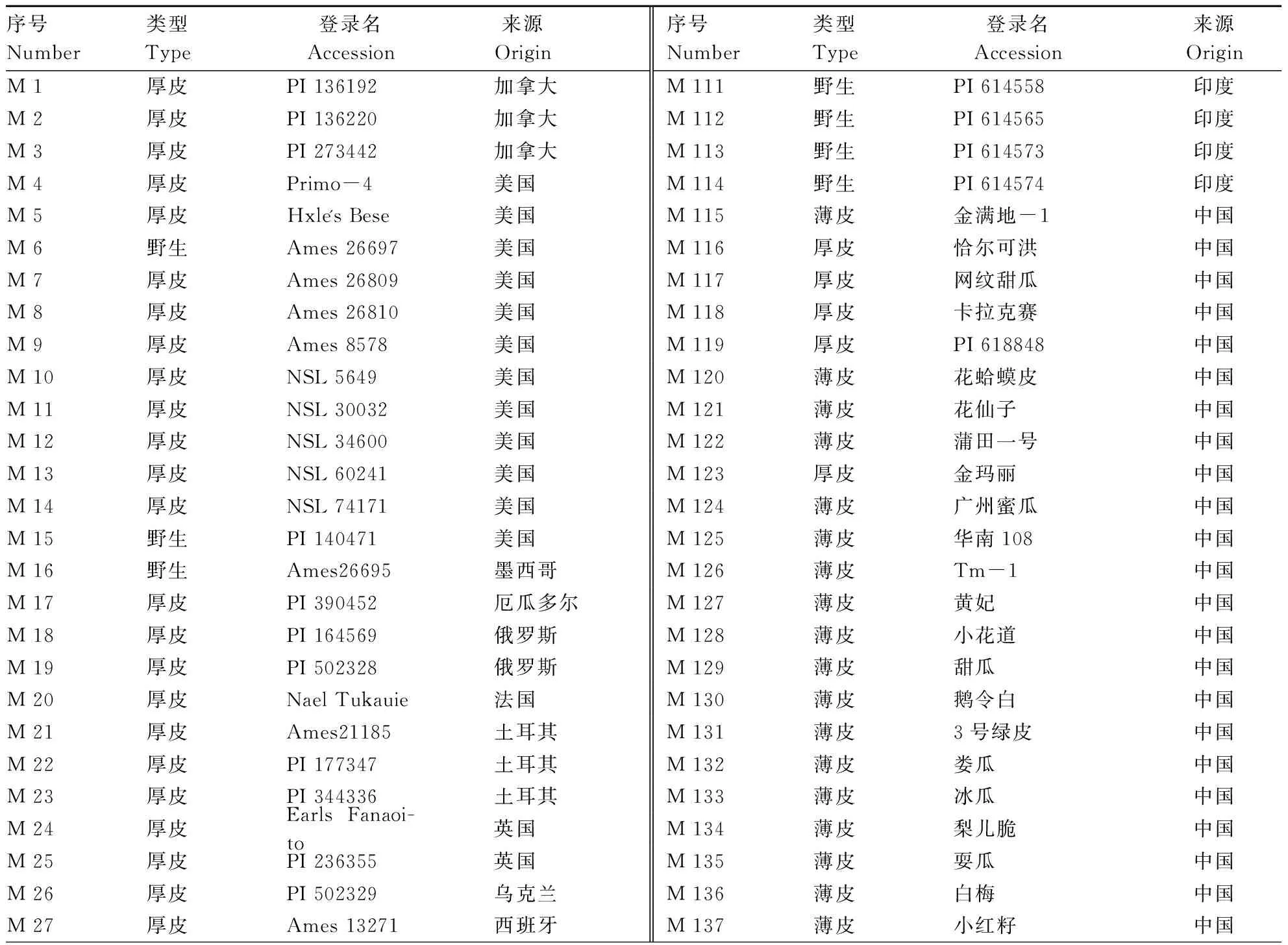
表1 219份甜瓜种质资源信息Table 1 The information of 219 melon germplasms

续表 219份甜瓜种质资源信息Continuing table The information of 219 melon germplasms
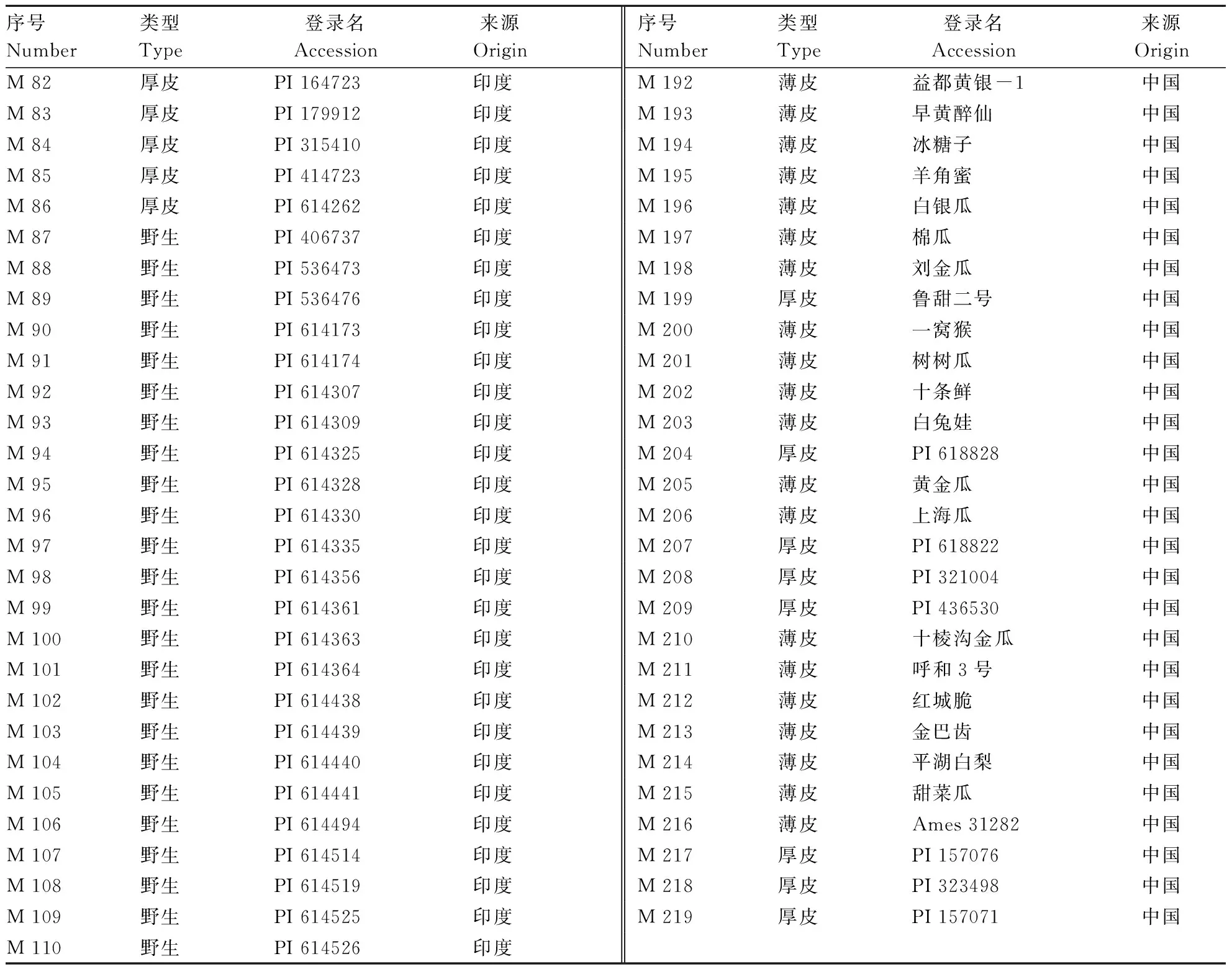
续表 219份甜瓜种质资源信息Continuing table The information of 219 melon germplasms
1.2 甜瓜种质资源的表型性状统计及分析
所有材料于果实成熟时期进行性状调查和统计。统计性状分为两个类型,一类为质量性状,主要对其频率分布和多样性指数进行分析,包括19类质量性状,即果面绒毛、果面瘤、果面沟、果面棱、果肉香气、网纹密度、网纹粗度、网纹分布、果面裂纹、果面覆纹形状、果皮底色、果面覆纹颜色、外果肉色、内果肉色、瓜瓤颜色、种皮颜色、果实形状、种子形状以及叶片缺刻,另一类性状为数量性状,包括单果质量、果实长度、果实宽度、果形指数、果肉厚度、果肉硬度、可溶性固形物含量、叶片长度、叶片宽度、叶形指数、叶柄长度、种子千粒质量、种子长度、种子宽度、种形指数共计15个性状。表型调查中用直尺测量长度;用电子秤测定质量;果肉硬度用果实硬度计(杭州绿博,型号:GY-1)测量,可溶性固形物用数显糖度计(日本爱拓,型号:PAL-α)测量。
所有表型性状调查标准参考《甜瓜种质资源描述规范和数据标准》[23]的标准与方法进行统计、分级和赋值,质量性状以1~10级进行记录(表2)并统计频率,数量性状参照胡建斌等[19]的方法,根据平均值(X)和标准差(S)把数据分为10级,1级<(x-2s),10级≥(x+2s),每 0.5s为一级,统计各级分布频率。各个性状遗传多样性采用Shannon′s信息指数(H′)进行评价,计算公式为:
H′=-ΣPilnPi,
式中:Pi为第i种变异类型出现的频率, ln为自然对数。
基于部分质量性状的复杂性,如颜色类、形状类、网纹类等,将该类性状拆分为二进制性状[24],如:果皮底色可以拆分为白色底色、浅绿底色、深绿底色、浅黄底色、深黄底色、橘色底色6个性状,各个质量性状按照质量性状分级情况进行拆分,共计获得72个二进制质量性状。所获得的72个质量性状和15个数量性状计算219份种质的均值,利用MEGA 6.0 和 R 3.5.1对其进行表型性状的聚类分析、相关性分析和主成分分析,聚类方法为非加权配对算数平均法(unweighted pair group method with arithmetic mean,UPGMA)。
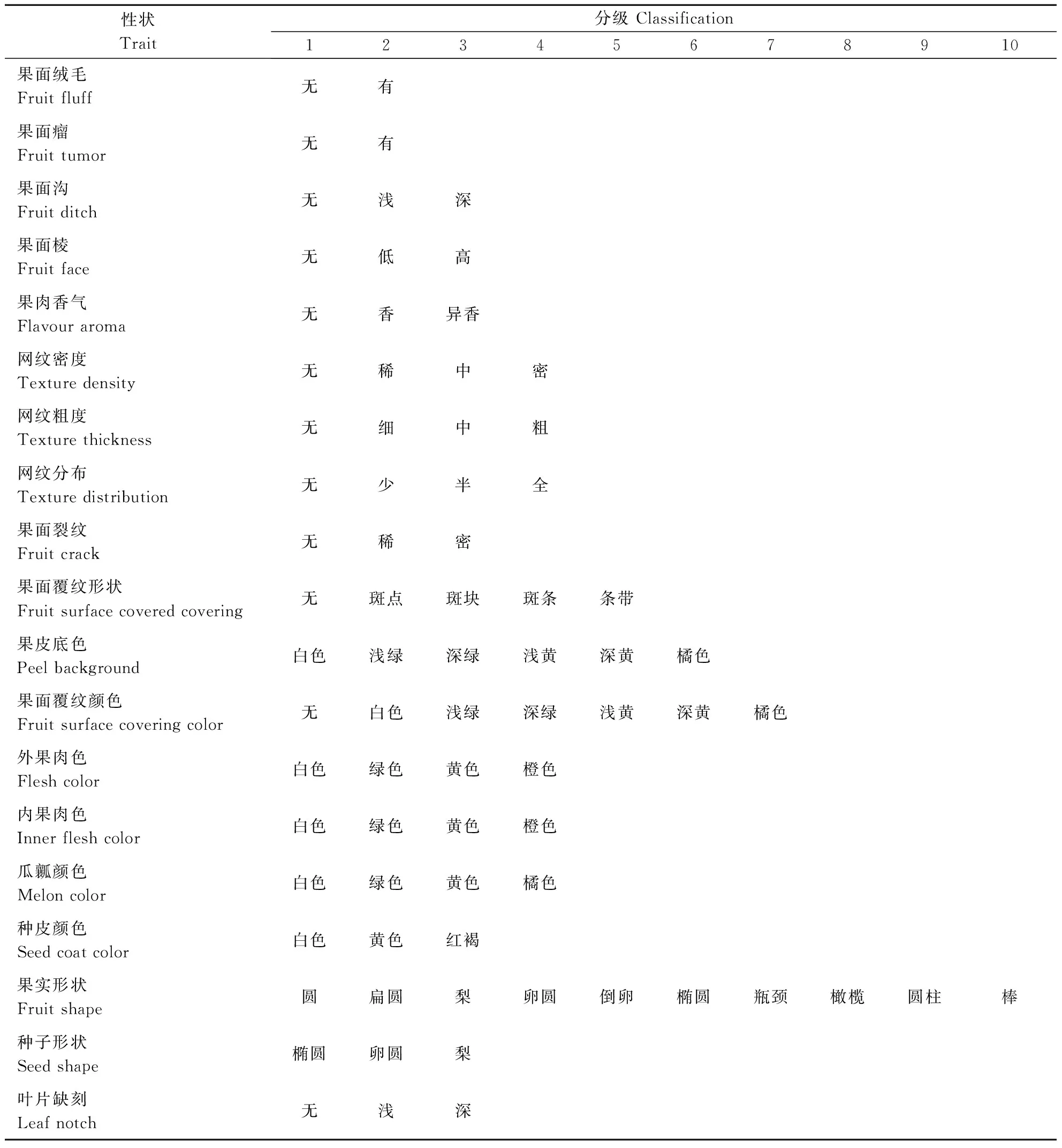
表2 甜瓜种质资源质量性状描述分级Table 2 Description and classification of qualitative characters of melon germplasms
1.3 分子数据统计与分析
在材料定植21 d后,每份材料采4株等量幼嫩叶片混合,用CTAB法[25]提取DNA,用分光光度计对所提取的DNA进行质量检测,将所有样本稀释至10 ng·μL-1以备PCR扩增使用。本研究所用22对SSR(Simple Sequence Repeats)引物由ZHU等[26]从甜瓜全基因组开发设计(表3)。PCR流程及标记多态性分析参考ZHU等[26]的方法。
使用Structure 2.3.4对219份甜瓜种质的基因型数据进行基于贝叶斯算法的群体结构分析[27-28],以确定试验群体的亚群数目,以及材料的遗传背景。通过lnP(D)值和ΔK来确定真正的K值[29]。利用MEGA 6.0对219份甜瓜种质进行聚类分析。使用R语言 3.5.1对219份甜瓜种质进行主成分分析。

表3 22对SSR引物信息Table 3 22 pairs of SSR primer information
2 结果与分析
2.1 甜瓜种质资源表型性状分析
2.1.1 甜瓜种质资源表型性状遗传多样性分析 基于质量性状的分级情况对219份甜瓜种质资源的19个质量性状进行赋值,分别统计各个性状的频率和多样性指数(表4)。质量性状多样指数变幅为0.09~1.96,果面瘤遗传多样性指数最低(0.09),果实形状遗传多样性指数最高(1.96)。7个质量性状(果面覆纹形状、果皮底色、果面覆纹颜色、内果肉色、瓜瓤颜色、果实形状、叶片缺刻)在数据统计中,多样性指数均大于等于1.0。果实形状以梨形(0.22)、卵圆(0.22)和圆形(0.19)为主;果皮底色以深绿(0.29)和浅绿(0.25)为主。在分析的所有材料中,48%的材料没有覆纹,而有覆纹的材料覆纹形状以斑条(0.14)和条带(0.15)为主,且以深绿(0.30)为主;瓜瓤颜色以橘色(0.39)和白色(0.32)为主;内果肉色以白色(0.48)和绿色(0.25)为主,外果肉色也以白色(0.33)和绿色(0.57)为主;叶片缺刻以浅缺刻(0.55)为主;种皮颜色以黄色(0.77)为主,种子形状以卵圆(0.68)为主。大部分成熟果实没有果面绒毛(0.62)、果面瘤(0.98)、果面沟(0.54)、果面棱(0.83)、果面网纹(0.89)和果面裂纹(0.88),果实表面比较光滑,而有网纹的种质网纹多为密(0.05)、细(0.05)、全(0.07)(表4)。
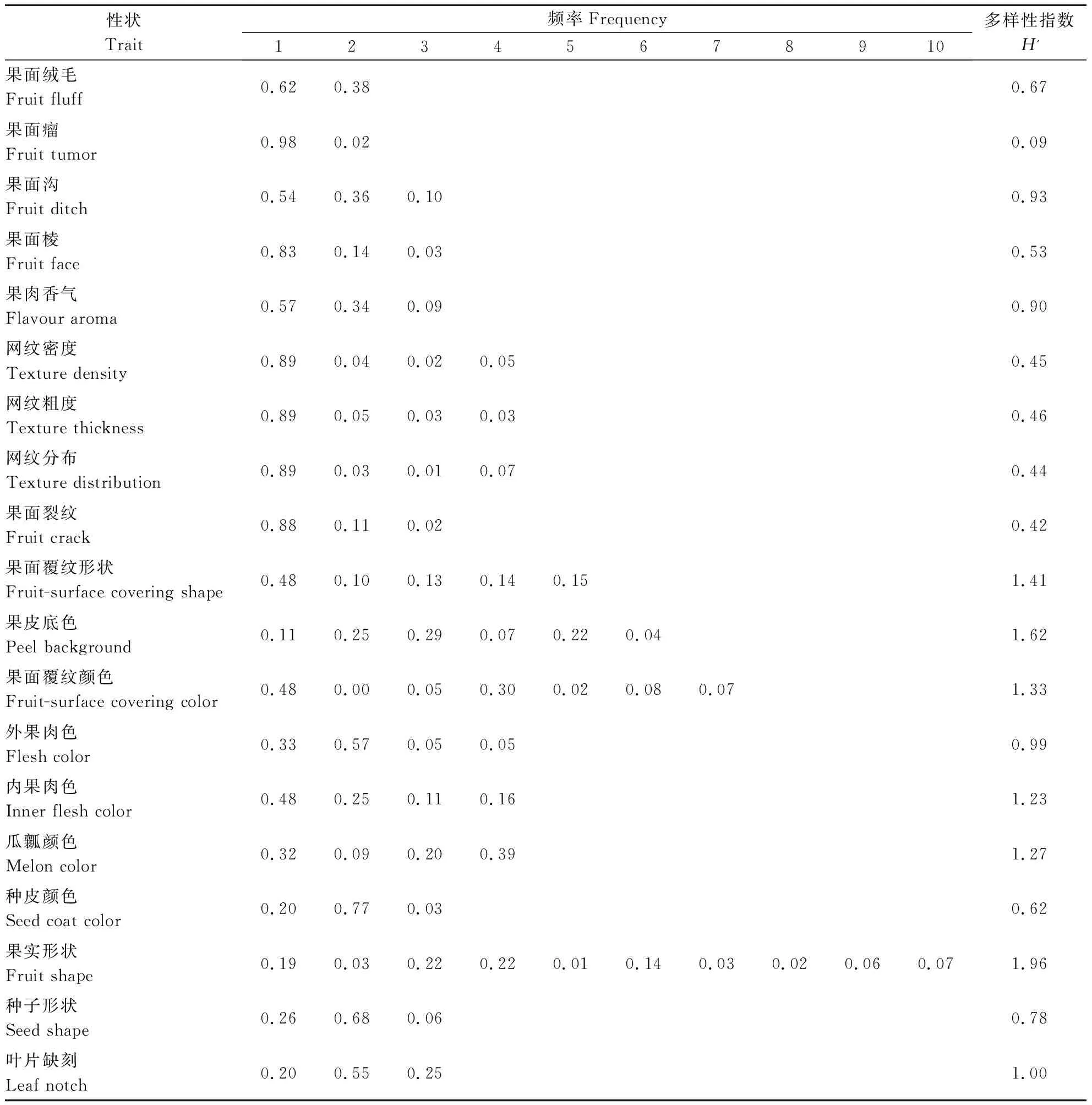
表4 219份甜瓜种质资源质量性状频率分布及多样性Table 4 Frequency distribution and diversity index of qualitative traits of 219 melon germplasms
219份甜瓜种质在15个数量性状中也表现出广泛的变异(表5),除种型指数多样性指数小于1(0.95)外,其他性状均高于1,变幅为0.95~2.09,其中可溶性固形物、叶片宽度和叶柄长度多样性指数最高。果肉厚度(0.50)、果肉硬度(0.53)、种子宽度(0.57)、种子千粒质量(0.60)、果实长度(0.65)、果型指数(0.68)、果实质量(0.93)的变异系数均超过了0.5,表明这7个数量性状可以进行遗传改良的潜力较大;其他8个数量性状的变异系数较小(0.12~0.38),表明其在219份甜瓜种质之间变异较小。
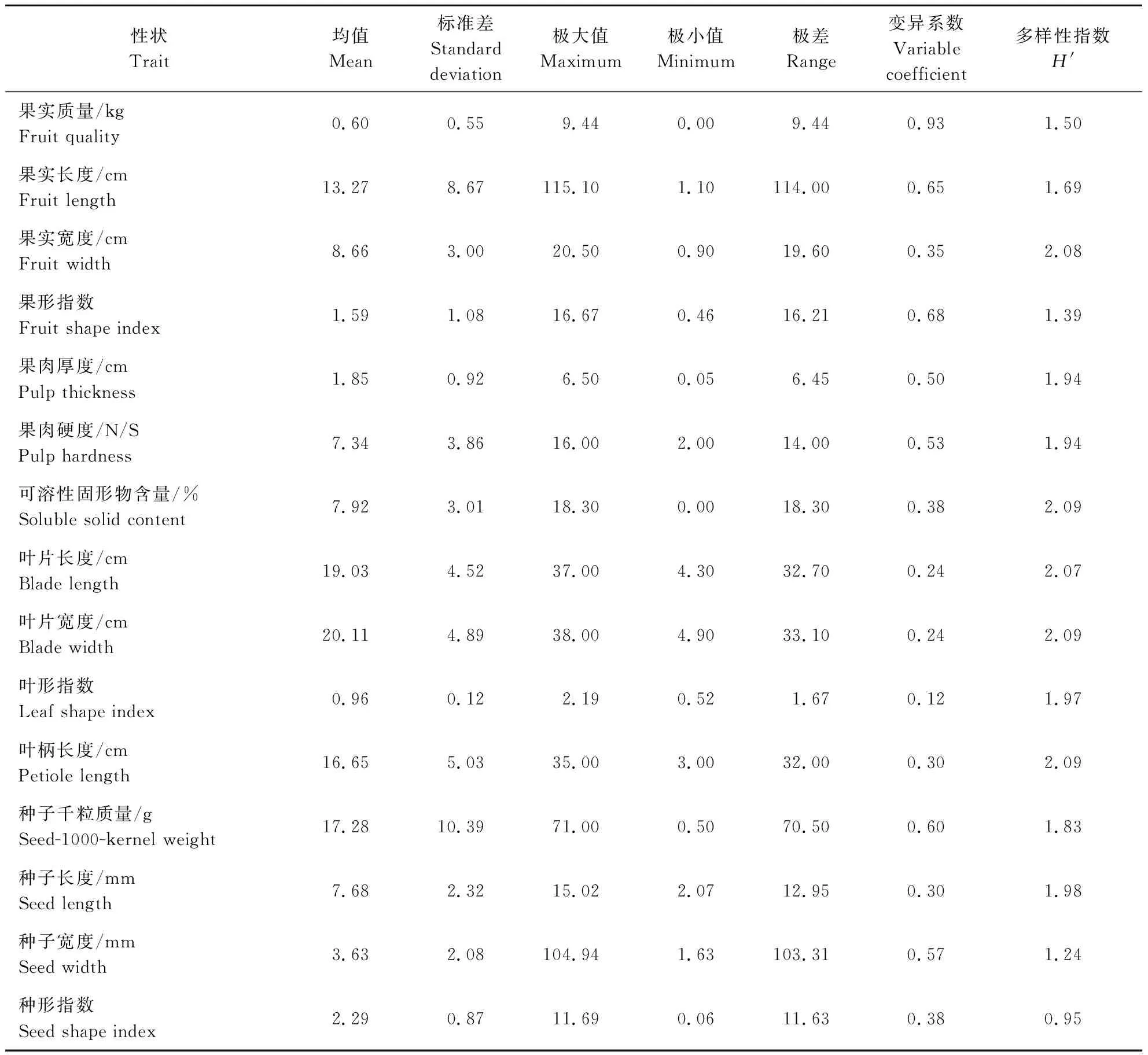
表5 219份甜瓜种质资源数量性状变异统计分析Table 5 Analysis of variation of quantitative traits for 219 melon germplasms
2.1.2 甜瓜种质资源表型性状相关性分析 在田间性状调查过程中发现,部分表型性状之间存在较高的关联,对87个表型性状进行了相关性分析(图1)。结果表明,本研究所用219份甜瓜种质资源的87个表型性状中有较多的性状之间存在相关性关系,除发现果实长度、果实宽度、果实质量、果肉厚度、种子长、种子宽、叶片长、叶片宽等性状之间存在比较常见的正相关关系外,还发现外果肉橙、内果肉橙、瓜瓤橘之间存在极高的正相关关系;且瓜瓤桔和瓜瓤白,种皮白和种皮黄,外果肉白和外果肉绿之间存在极高的负相关关系。
2.1.3 甜瓜种质资源表型性状聚类分析和主成分分析 通过对87个表型性状进行UPGMA法聚类分析(图2)。从图2可看出,厚皮材料相对集中,其中M193、M173、M176、M137、M163、M191、M198和M96表型性状归类为厚皮,与其材料类型不一致,从表型来看,这8份材料与厚皮更为接近,从遗传角度分析其可能存在更多的厚皮背景。聚类图中薄皮与野生材料相互交织在一起,并没有按照其材料类型区分开,说明从表型性状来看,薄皮和野生材料的表型相似度高,这可能是由于薄皮和野生材料遗传背景比较接近。
对219份甜瓜种质资源的表型性状进行主成分分析(图3),前两个特征向量累计解释了21.7%的总变异,第一和第二特征向量分别解释了14%和7.7%的变异。这两个特征向量可以将219份种质分为3个区域,厚皮区域(红色)、薄皮区域(蓝色)、野生区域(暗绿色),在3种类型交汇处有部分材料并不能完全区分开厚皮、薄皮和野生材料,表明单纯的形态学标记不能很好的区分种质类型。
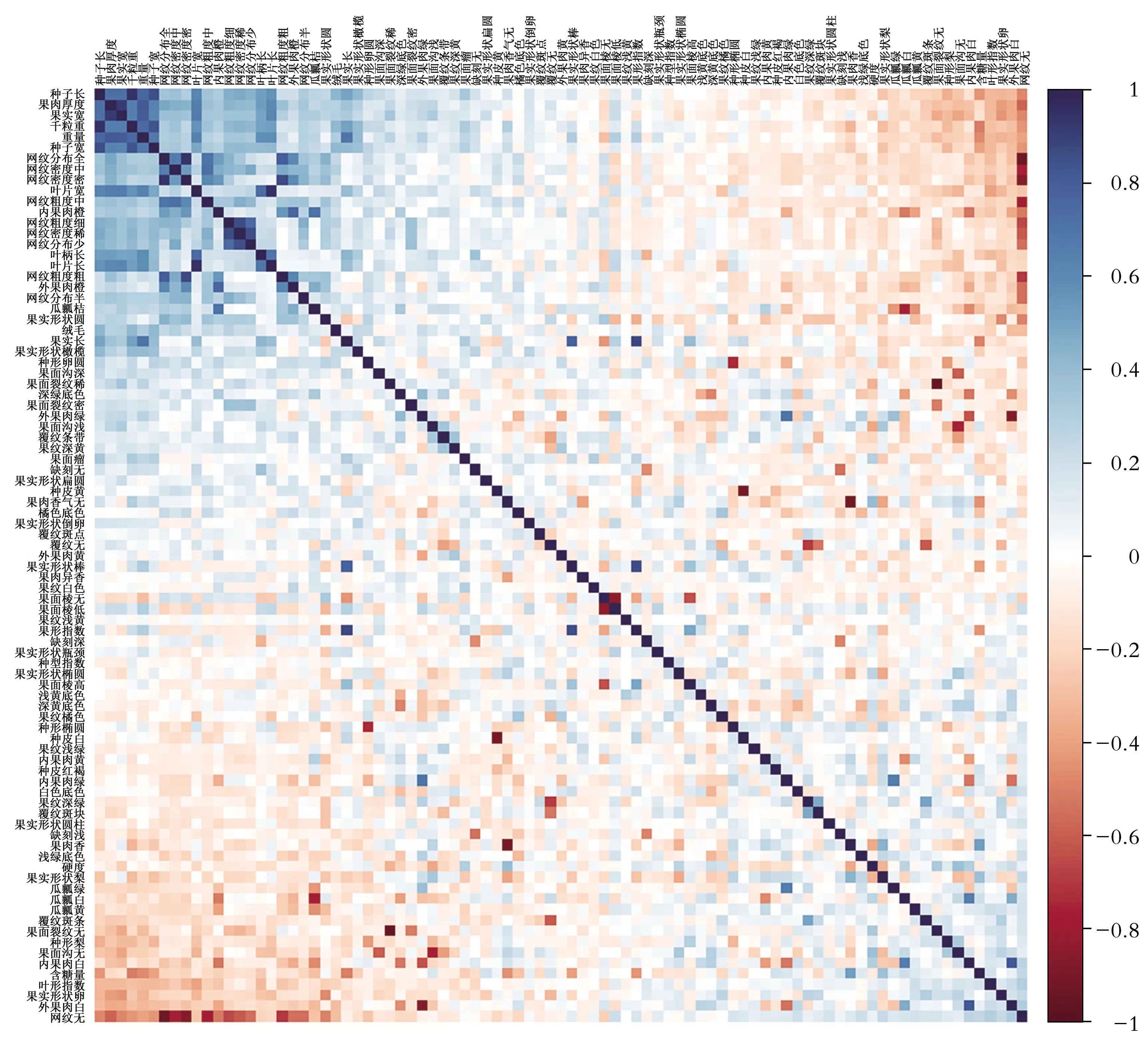
图1 87个性状相关性热图Fig.1 Correlation across 87 morphological traits
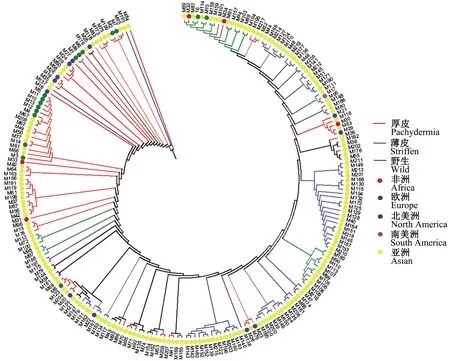
图2 基于表型性状对甜瓜种质资源的聚类分析Fig.2 Clustering of melon germplasms based on phenotypic traits
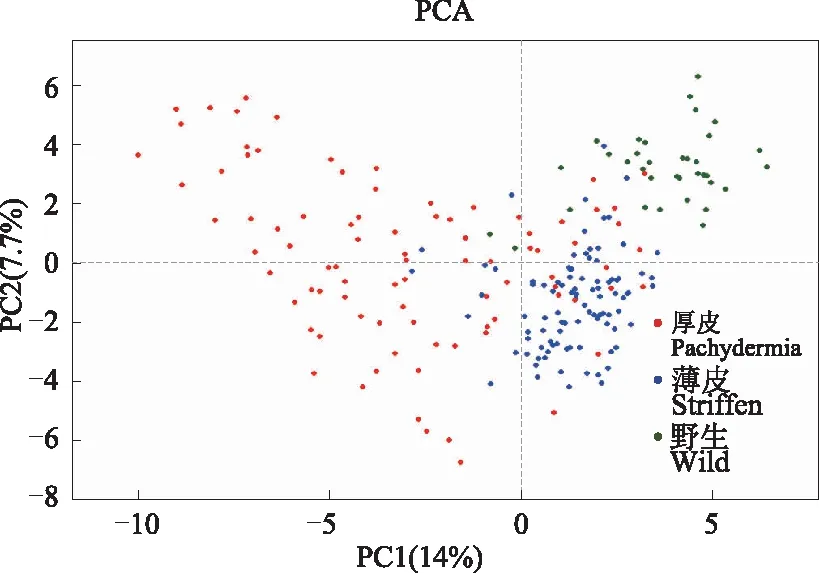
图3 219份甜瓜种质形态学标记主坐标分析图Fig.3 The principal components analysis of 219 melon germplasms
2.2 甜瓜种质资源SSR标记遗传多样性分析
2.2.1 甜瓜种质资源SSR位点遗传多样性分析 22对SSR标记在219份材料中共扩增出130个等位位点(表6),平均每对引物5.91个位点,其中引物CmSSR04895位点最多为11个,CmSSR13690、CmSSR15606和CmSSR18058最少仅有3个,表明这些引物在本研究的219份材料中具有较好的多态性。全部引物的Ne变幅为1.07~3.74,CmSSR06905最大,CmSSR15606最小,平均2.44。Ho变幅为0.63~0.97,CmSSR15606最大,CmSSR12254最小,平均0.88。He变幅为0.03~0.37,CmSSR12254最大,CmSSR15606最小,平均0.12。PIC变幅为0.07~0.71,CmSSR06905最大,CmSSR15606最小,除CmSSR15606的PIC值低于0.25外,其他引物均高于0.25,表明该套SSR标记具有较高的多态性。Shannon’s指数变异范围在0.16~1.69之间,CmSSR15606最小,CmSSR06905最大,平均为1.07。从He、Ho、PIC以及Shannon’s指数值可以看出本研究的群体的遗传多样性相对丰富。
表6 22对引物在219份甜瓜材料中的遗传多样性Table 6 Genetic diversity of 219 melon germplasms based on 22 SSR markers
注:Na:观测等位基因数;Ne:有效等位基因数;I:Shannon-Weaver指数;Ho:观测杂合度;He:期望杂合度;PIC:多态性信息含量。
Note:Na:observed allele number;Ne:effective allele number;I:Shannon-Weaver index; Ho:observed heterozygosity;He:expected heterozygosity; PIC:polymorphism information content.
2.2.2 甜瓜种质资源群体结构分析 依据基因型数据,本研究利用Structure 2.3.4对219份甜瓜种质资源进行分析,以确定研究群体的最佳亚群数目。经分析后发现lnP(D)随着K值的增大持续增加(图4-A),难以确定真实的K值,故而参照EVANNO 等[29]的方法通过ΔK值来确定合适的K值。由图4可知,当K=3时ΔK有最大值324.94,因此可以将材料区分为3个亚群(图4-B)。其中72份材料归属于P1,包括70份厚皮材料和2份薄皮材料,其中43份来自亚洲,13份来自北美洲,12份来自欧洲,3份来自非洲,1份来自南美洲;39份材料归属于P2,包括32份野生材料和6份厚皮材料及1份薄皮材料,其中34份来自于亚洲的印度,剩下的5份分别来自于亚洲的马尔代夫和中国,北美洲的美国和墨西哥及非洲的津巴布韦;108份材料归属于P3,包括92份薄皮材料、13份厚皮材料和3份野生材料,其中106份来自于亚洲,2份分别来自非洲和北美洲。材料分类情况基本与厚皮、薄皮以及野生材料的原始分类比较接近,仅有25份材料(P12份,P27份,P316份)与原始分类不一致,25份材料中除M6、M34、M78、M82、M85、M158、M159这7份材料遗传背景较杂乱外,其余材料的遗传背景都比较单纯(图4-B)。综上所述,除了利用表型性状作为分类标准外,分子数据亦应纳入分类标准。
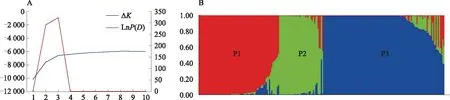
A:219份甜瓜群体lnP(D)值和ΔK值随K值变化图;B:219份甜瓜种质群体结构示意图A: lnP(D) and ΔK with change of K values in the 219 melon germplasms; B:Population structure of the 219 melon germplasms
2.2.3 甜瓜种质资源聚类分析以及主成分分析 利用MEGA6.0对219份供试材料进行聚类分析。可将219份材料分为3类(图5)。其中在第Ⅰ类,除4份薄皮材料外其他均为厚皮材料;第Ⅱ类除M42、M71外,其他均为野生材料;第Ⅲ类除16份厚皮种质和7份野生种质外,其他均为薄皮材料,而这未按照原分类聚类的29份材料中有23份材料与Structure分类结果一致,故而无论从遗传背景还是进化关系,这23份材料均应重新进行分类。从图6可以看出,材料所在地域与材料类型并没有明显关系。同时从进化角度来看,薄皮材料与野生材料的亲缘关系更近(图5)。
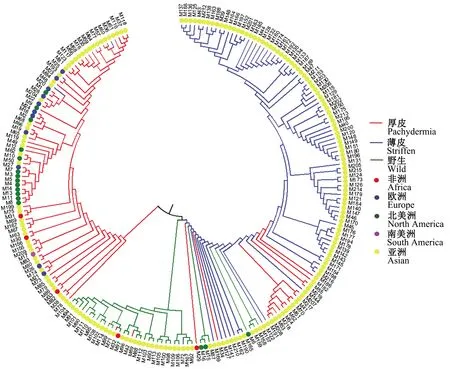
图5 基于SSR标记对甜瓜种质资源的聚类分析Fig.5 Clustering analysis of melon germplasms based on SSR markers
对219份甜瓜种质的SSR标记数据进行主成分分析(图6),前2个特征向量解释了21.6%的总变异,第一和第二特征向量分别解释了13.9%和7.7%的变异。这两个特征向量可以将219份种质分为3个区域,厚皮区域(红色)、薄皮区域(蓝色)、野生区域(暗绿色),厚皮和薄皮材料分布较集中,野生材料相对较为分散,这可能和不同种质类型的多样性程度有关。其中有部分材料原始分类与在图中分布不一致,经比较图6中不同类型材料中混杂的其他类型材料和Structure结果一致,表明种质入库记录并不完全正确,仍旧需要育种工作者对该方面进一步进行分析核实。
2.2.4 23份甜瓜种质资源的重新归类 本研究通过将分子数据的Structure结果和MEGA结果进行比对,发现有23份材料的初始归类类型可能存在问题。因此,本研究推测该23份种质的归类情况应当如表7所示。

图6 基于SSR标记的主坐标分析图Fig.6 The principal components analysis based on SSR markers
表7 23份甜瓜种质资源的重新归类Table 7 Re-categorization of 23 melon germplasm resources
3 讨论与结论
丰富多样的种质资源是研究人员选育新品种和研究物种起源、进化及分类的基础。甜瓜作为葫芦科植物中表型变异最为丰富的作物之一,育种工作者针对不同方向利用不同方法对其进行了广泛的研究[26,30-34]。虽然研究人员利用不同的甜瓜种质资源对表型性状进行遗传多样性分析[35-36],但其所研究的性状数目均低于本研究的19类质量性状和15个数量性状。本研究所分析的表型性状更为丰富、全面,且本研究参考FANG 等[37]对大豆表型性状的研究方法,首次将甜瓜质量性状进行拆分,简化了性状之间相关性的复杂程度,而间接鉴定法的重要依据就是以不同表型性状相互之间的相关关系,基因之间的连锁互作为其本质,可以通过某一性状预测其相关性状的表现,该项工作的细化研究将为甜瓜多个优良性状进行融合提供了理论依据,对育种工作有重要的参考应用价值,可以很大程度提高常规育种的效率。
生物进化和育种的基础是种质遗传多样性,通过形态学标记的遗传多样性研究,可以从整体了解种质资源的丰富程度,为育种者提供重要的信息。尽管由于环境因素的影响通过形态学标记所获得的结论往往不够完善,但相较于分子标记其可以在宏观水平直接明了地同表型性状相结合起来。在本研究表型性状遗传多样性分析中分别有7个质量性状和14个数量性状遗传多样性指数≥1,7个数量性状变异系数≥50%,这与前人检测到的具有较高多样性指数和变异系数的性状比较一致[18-19,36],上述14个具有较高多样性指数和变异系数的性状遗传改良的潜力较大,这为甜瓜某些表型性状基因的精细定位和图位克隆提供了优异的亲本材料。
随着基因时代的到来,遗传多样性研究也进入了分子水平[24,38],利用分子标记可以更为精确地从分子水平了解作物的遗传多样性研究。本研究除对表型性状进行遗传多样性分析外,亦在分子水平上对219份种质的遗传多样性及群体结构进行分析。相较于形态学标记,分子标记受环境因素影响小,具有较高的稳定性和可靠性,并且还具有数量丰富和多态性高的优点,可以全方位的对种质资源进行遗传多样性分析[38]。本研究22个标记中除CmSSR15606的PIC值低于0.25外,均具有较高的He、Ho以及PIC值,可以在一定程度上反应群体材料的遗传多样性程度,本研究的平均Shannon’s值为1.07,Shannon’s大小可以用来反映群体的遗传变异丰富程度,本研究与ZHU 等[30]利用42个分子标记在对118份甜瓜材料部分相同,且研究中得到的Na、Ho、Shannon’s、PIC的值相差不大。本研究的平均等位基因位点为5.91,高于KONG 等[39]利用EST-SSR进行27个甜瓜材料的研究中的3.01,本研究与王盼乔等[40]利用EST-SSR标记对47份甜瓜材料的研究结果对比发现,本研究的Na、Ne、Ho、He、PIC平均值均高于其平均值。表明本研究所用的22个标记具有较高的多态性,即本研究所用的219份种质材料之间存在较大的遗传差异。
形态学标记和分子标记技术相结合能够准确把握种质资源遗传多样性本质,因此本研究结合数据分析结果,对初始归类类型可能存在问题的23份种质进行了重新分类。一些学者在研究中发现SSR标记的多样性信息指数明显低于形态学标记[41-45],本研究与前人研究结果一致(形态学标记遗传多样性指数=1.29,分子标记遗传多样性指数=1.07),但通过比较分子数据的MEGA聚类结果和Structure结果发现,有213份材料始终分类一致,相较于形态学标记的MEGA聚类结果和主成分结果,分子标记更为稳定,更能够正确反应材料的遗传背景以及材料之间的亲缘关系。
