嘧啶酮-肉桂酸杂合体的合成及其抗氧化活性研究*
2020-05-21宁卫红路东亮谢永荣
李 静,宁卫红,路东亮,†,谢永荣,李 琰
(1.赣南师范大学 a.化学化工学院;b.江西省高等学校功能材料化学重点实验室,江西 赣州 341000; 2. 绍兴文理学院,浙江 绍兴 312000)
嘧啶酮(图1,a)及其衍生物由于具有抗炎、抗病毒、降血压和血糖、止痛、癌症预防和抗人类免疫缺陷病毒(HIV)等广泛的生理和药理活性[1],在医药领域中发挥着重要作用.目前应用于临床的很多止痛剂和抗炎剂都含有嘧啶酮骨架[2].多酚类化合物(如肉桂酸,图1,b)由于其含有多个酚羟基,具有清除机体自由基、保护机体免受自由基损害等生理功效[3],能够避免因自由基诱发而导致的生物大分子损伤,在抗氧化[4]、抗肿瘤、抑菌[5]、抗动脉硬化、预防心血管疾病、减缓骨质疏松、抑制高血压等方面均表现出良好的生理活性[6-7],但多酚类化合物的体内利用度低严重制约了其药用开发价值.
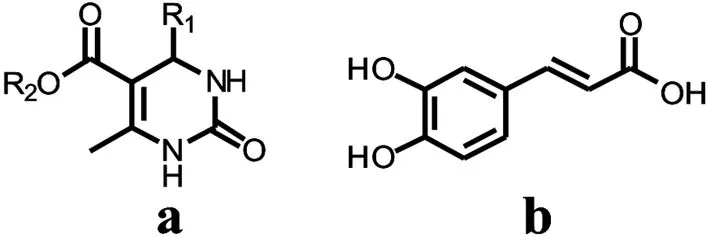
图1 化学结构式
为了得到更好的药理作用和满足药物分子库的结构多样性,以及研发的经济性,杂合体化合物的设计和合成受到越来越广泛的关注[8].杂合体化合物的结构设计是指拼合或连接两个或多个具有生物活性的分子骨架,也可将两个多个分子骨架进行杂合,再对杂合骨架进行合理的取代基修饰.通过改变这些杂合体化合物的结构来寻找最有益的活性结构并将其进一步优化,并研究其构效关系,最终得到比拥有单独母体分子具有更强药理作用的具有两个药效团的杂合体分子[9].
本文通过Biginelli缩合反应将肉桂酸骨架引入到嘧啶酮环的C-5位上,肉桂酸骨架上具有Michael加成受体单元,有研究表明,Michael加成受体单元在药物的癌症预防和治疗方面有着重要的研究前景[10].含有Michael加成受体的分子能够改变细胞内活性氧(ROS)水平,从而调控细胞的氧化还原状态.本文以嘧啶酮-肉桂酸杂合体为骨架进行结构修饰合成了4种具有不同取代基的化合物,并通过体外实验初步研究了其抗氧化活性.
1 实验部分
1.1 主要仪器与试剂
核磁共振仪(AM-400, 德国布鲁克AXS公司);红外光谱仪(360FT, 美国Nicolet公司);旋转蒸发仪(RE-52AA, 上海亚荣生化仪器厂);紫外/可见光谱仪(TU-1901, 北京普析通用有限公司);超声波清洗器(KQ5200E, 昆山市超声仪器有限公司);电子天平(CP114, 常州有限公司).
苯甲醛、硼酸三丁酯、乙酰丙酮、三氧化二硼等原料均购于阿拉丁;1,1-二苯基-2-三硝基苯肼自由基( DPPH·) 购于Sigma-Aldrich;二蒸水;甲醇(色谱纯);二甲亚砜(DMSO,分析纯).
1.2 合成实验
1.2.1 原料3的合成[11]
称取3,4-二羟基苯甲醛1 g(7.24 mmol)于100 mL三颈烧瓶中,加入磁力搅拌子和1,4-二氧六环10 mL和硼酸三丁酯0.3 mL(1.11 mmol),在358 K下搅拌回流30 min,然后加入乙酰丙酮4.44 mL(43.3 mmol),三氧化二硼1.5 g(21.5 mmol),在358 K下继续搅拌回流8 h,缓慢加入六氢吡啶0.36 mL(3.62 mmol),加热至373 K搅拌回流4 h,TLC点板跟踪反应,将反应体系温度降至323 K,加入1.5 M盐酸10 mL,搅拌30 min,冷却至室温,用乙酸乙酯萃取三次,合并有机层,有机层用饱和食盐水洗涤,加入无水硫酸镁,密封干燥,减压旋蒸至少量液体,加入柱层析硅胶至粉末状,柱层析纯化(乙酸乙酯 :正己烷=1:2),用乙醇和水重结晶得到黄色固体.产率65%.核磁数据:1H-NMR(400 MHz, d-DMSO):2.10(s,3H),5.85(s,1H),6.46(d,1H,J=15.6 Hz),6.75(d,1H,J=7.6 Hz),6.98(dd,1H,J=8.0,1.6 Hz),7.06(d,1H,J=2.4 Hz),7.42(d,1H,J=16.0 Hz).
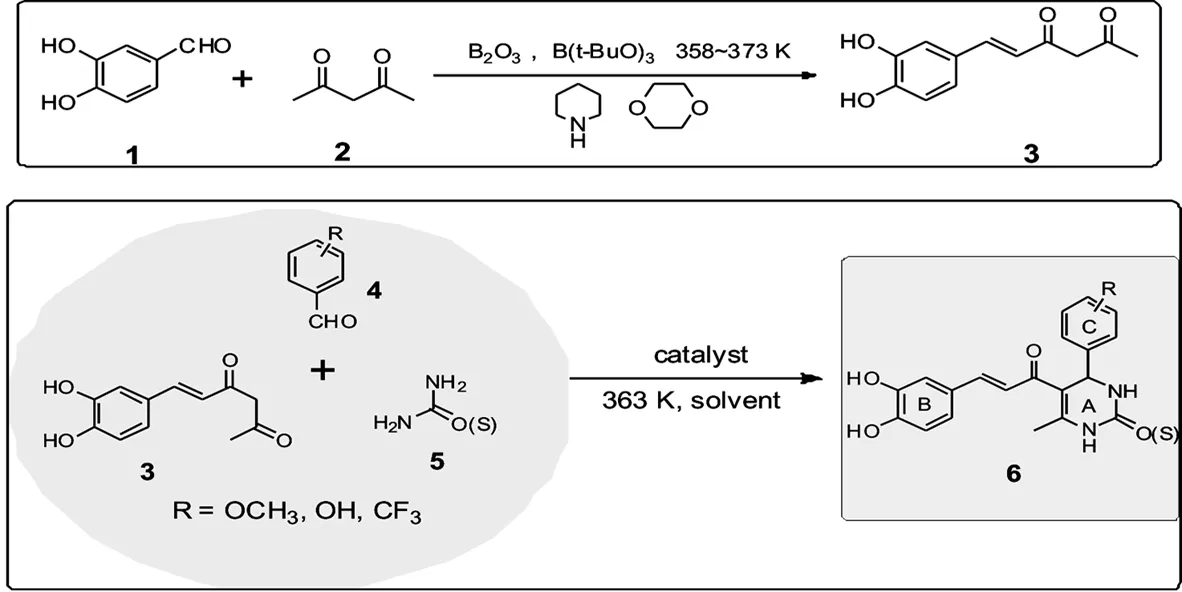
图2 原料3及药物分子6 的合成路线
1.2.2 杂合药物分子6的合成
将合成原料3(0.2 mmol),不同取代基的苯甲醛(0.24 mmol),尿素(0.2 mmol)及催化剂(10% mol).加于15 mL试管中,加入磁力搅拌子和1 mL乙醇,室温下搅拌30 min,363 K下反应12 h或18 h,TLC跟踪反应.反应结束后,冷却至室温,加入乙醇溶解,过滤除去不溶物,滤液减压旋蒸至少量液体,薄层层析分离(乙酸乙酯:正己烷=3:1),用乙醇和水重结晶得黄色固体.
1.3 DPPH自由基的清除活性
2 结果与讨论
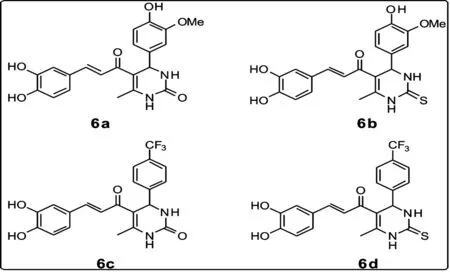
图3 合成的新型药物分子图
2.1 合成反应的讨论
2.1.1 新的药物分子(图3)
2.1.2 条件优化
在反应时间为12 h,溶剂为乙醇,反应温度为363 K,催化剂为氨基磺酸的条件下,可以得到较高产率的6a(70% yield)和6b(65% yield).而对于吸电子基取代的苯甲醛(6c和6d)而言,在相同条件下产率并不高,分别为11%和10%.延长反应时间或提高反应温度对产率影响不大.如果改变催化剂为三水合硝酸铜,其他条件不变,产率有明显提高(6c和6d的产率为45%和47%).催化剂为三水合硝酸铜,提高反应温度对产率影响比较小,延长反应时间(18 h)产率提高,再延长时间(21 h)产率基本不变.
2.1.3 结构表征
(E)-5-(3-(3,4-dihydroxyphenyl)acryloyl)-4-(4-hydroxy-3-methoxyphenyl)-6-methyl-3,4-dihydropyrimidin-2(1H)-one(6a)1H-NMR (400 MHz,d-DMSO)δ:2.38(s,3H),3.78(s,3H),5.56(s,1H),6.76(d,2H,J=4.0 Hz), 6.91(d,3H),6.96(s,3H),7.10(d,2H),7.35(d,1H,J=16.0 Hz),8.15(s,1H),8.31(s,1H),8.48(s,1H);13C-NMR(100 MHz,d-DMSO)δ:18.4,55.9,56.1,111.2,112.4,115.0,115.6,115.8,116.0,118.9,120.0,122.3,128.0,135.3,141.5,142.9,145.9,146.9,148.1,148.3,175.6,189.0.
(E)-3-(3,4-dihydroxyphenyl)-1-(4-(4-hydroxy-3-methoxyphenyl)-6-methyl-2-thioxo-1,2,3,4-tetrahydropyrimidin-5-yl)prop-2-en-1-one(6b)1H-NMR(400 MHz,d-DMSO)δ:2.27(s,3H),3.71(s,3H),5.34(s,1H),6.64(dd,1H,J=4 Hz),6.72(m,2H),6.87(m,2H),6.93(d,1H,J=16Hz),7.01(s,1H),7.24(d,1H,J=16 Hz),9.12(d,2H),9.61(d,2H),10.16(s,1H);13C-NMR(100 MHz,d-DMSO)δ:18.6,54.2,55.7,110.0,111.3,114.8,115.5,115.8,118.8,121.3,122.6,126.5,135.7,141.1,145.6,146.0,146.1,147.5,148.0,152.2,187.7.
(E)-5-(3-(3,4-dihydroxyphenyl)acryloyl)-6-methyl-4-(4-(trifluoromethyl)phenyl)-3,4-dihydropyrimidin-2(1H)-one(6c)1H-NMR(400 MHz,d-DMSO)δ:2.28(s,3H),5.51(s,1H),6.75(d,1H),7.03(m,3H),7.23(d,1H,J=15.2Hz),7.50(d,2H,J=7.6Hz),7.71(d,2H,J=7.6Hz),7.92(d,2H,J=16.4Hz),8.13(s,1H),9.24(s,1H);13C-NMR(100 MHz,d-DMSO)δ:18.8,53.8,109.9,114.9,115.7,121.3,122.6,125.4,126.3,127.1,141.5,145.5,146.8,149.0,152.1,187.4;IR(KBr)ν:3 422.09(O-H),2 923.37(saturatedC-H),1 694.25(C=O),1 685.58(C=O),1 654.94,1 637.22,1 594.55,1 560.91(phenylring),1 543.20,1 523.84,1 509.58,1 458.75,1 236.44(CF3),1 117.88,671.96.
(E)-3-(3,4-dihydroxyphenyl)-1-(6-methyl-2-thioxo-4-(4-(trifluoromethyl)phenyl)-1,2,3,4-tetrahydropyrimidin-5-yl)prop-2-en-1-one(6d)1H-NMR(400 MHz,CD3OD)δ:2.32(s,3H),5.39(s,1H),6.71(s,1H),6.85(m,1H),6.95(s,1H),7.02(s,1H),7.39(d,1H,J=15.6Hz),7.81(s,1H),8.22(s,1H);13C-NMR(100 MHz,CD3OD)δ:19.2,31.5,57.7,114.1,115.9,116.4,117.4,120.3,124.2,127.2,129.1,132.1,136.8,143.3,146.2,147.3,147.6,150.6,176.5,186.5,193.0.
图4 DPPH·自由基
2.2 药物分子的抗氧化活性
作为脂质自由基模型的1,1-二苯基-2-三硝基苯肼自由基DPPH·图4是一种稳定的自由基,其甲醇溶液在517 nm下有特征吸收,通过检测DPPH· 的光谱衰减情况我们可以评价化合物的氢转移能力,即抗氧化活性[12].EC50值是光谱衰减50%时化合物的浓度,EC50值越小,化合物的氢转移能力越强,其抗氧化活性越好.

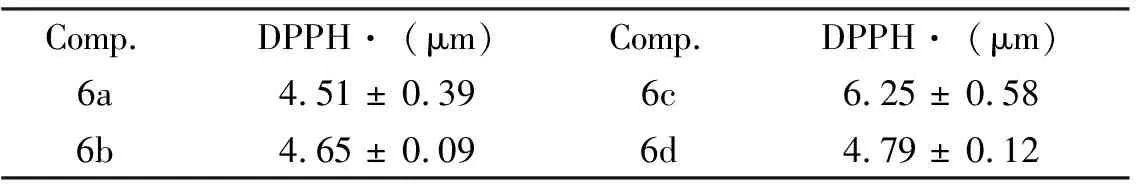
表1 药物分子6a-d清除DPPH自由基活性(EC50值)
由表1可知:4个药物分子都具有优异的抗氧化活性.相对于常见的天然抗氧化剂姜黄素(15.9 μm),本文合成的新药物分子的抗氧化活性都有显著提高,其中化合物6a的抗氧化活性是姜黄素的3.5倍.C环上是供电子基时,6a的抗氧化活性稍优于6b,说明嘧啶酮和嘧啶硫酮结构对化合物的抗氧化活性影响不大; 6d的抗氧化活性是6c的1.3倍,表明C环上是吸电子基时,B环上取代基的改变对化合物的抗氧化活性影响较大;对比6a和6c的EC50值发现:C环上取代基是供电子基时的抗氧化活性大于C环上取代基是吸电子基时的抗氧化活性.
3 总结
本文合成了4个新的嘧啶酮-肉桂酸杂合体药物分子,通过反应条件优化,得出最优的反应条件:以氨基磺酸(6a和6b)或三水合硝酸铜(6c和6d)为催化剂,乙醇为溶剂,363 K分别反应12 h或18 h.通过DPPH自由基清除实验,研究了该类药物分子的抗氧化活性,对比天然抗氧化剂姜黄素,合成的新化合物具有优异的抗氧化活性.结果表明,利用杂合理念设计杂合体药物分子具有好的研究价值.
