雉鸡微卫星多态性分析
2020-05-21赵乐乐袁红艳张春华陆雪林
邢 磊 赵乐乐 袁红艳 张春华 陆雪林*
1.上海市动物疫病预防控制中心,上海201103;2.上海欣灏珍禽育种有限公司,上海201408
微卫星(SSR)标记技术对加快畜禽性状选育有很大的优势[1],关于雉鸡的分子标记研究以前尚未有过,而且雉鸡的基因组信息也是未知的。因此,本研究利用高通量测序技术以雉鸡基因组为研究对象对雉鸡的SSR 分子标记进行开发,构建出雉鸡SSR 分子标记数据库,迈开了进行雉鸡分子标记遗传研究的第一步。通过设计特异性引物并经过样本群体的多态性验证[2],得到了可靠的多态性SSR 标记,旨在为雉鸡种质资源遗传多样性研究、基因定位以及分子标记辅助育种提供分子水平上的有效工具[3]。
1 材料与方法
1.1 试验动物
试验动物来源于上海欣灏珍禽育种有限公司饲养的中华环颈雉(RN)、蒙古雉(MX)和国内雉鸡(D)的纯种后代。3 个品种在同一鸡舍、相同管理条件下饲养。
1.2 血液样本采集及基因组提取
第20 周时,从试验群体中随机挑选105 只母鸡采集血样,各样本翅静脉取血3 mL,4% EDTA抗凝剂抗凝,-20 ℃保存。利用试剂盒法(天根生化(DP318)血液基因组提取试剂盒)提取血样基因组,采用TBS380 结合picogreen 进行浓度和纯度检测,再根据浓度检测结果利用0.8%琼脂糖凝胶电泳检测样本DNA 的完整性,电压120 V,时间20 min。所得DNA 于-20 ℃储存备用。
1.3 微卫星标记的引物设计及筛选
通过454 平台高通量测序,利用MISA 程序在序列中搜索SSR 位点,利用primer3_2.2.3 对搜索得到的SSR 位点设计特异性引物。扩增目标片段为重复序列前1 个碱基到后5 个碱基的片段,扩增产物长度在100~400 bp 之间。设计引物时,遵循一般的引物设计原则,并对PCR 产物长度及范围、引物退火温度范围、GC 含量、长度等进行严格限定,从而进行相关参数的调整。然后选择分布均匀的SSR 位点通过90 个样本逐级PCR 反应筛选多态性位点。PCR 反应体系总体积为20 μL,其中ddH2O 14 μL,10×Buffer 2 μL,DNA 模板1 μL,上、下游引物各0.50 μL,dNTP 0.5 μL,Taq 酶0.5 μL。PCR 扩增反应程序为:95 ℃预变性5 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,35 次循环;最后72 ℃延伸5 min,4 ℃保存。
1.4 微卫星标记的基因型判定及数据分析
利用确定的8 对多态性SSR 设计荧光引物上ABI 3730XL 测序仪进行毛细管电泳,进而进行基因型判定并进行数据分析。用POPGENE3.2 统计观测等位基因数(Na)、有效等位基因数(Ne)、观测杂合度(Ho)、期望杂合度(He)等。多态信息含量(PIC)用软件LittlePrograme 计算。
2 结果与分析
经过逐级多态性验证,最终确定8 条多态性SSR 序列,具体信息见表1。8 对微卫星在所有雉鸡个体中均能成功扩增。
观测等位基因数、有效等位基因数、观测杂合度、期望杂合度见表2,多态信息含量见表3。由表2可知,RN 群体中,观测等位基因数平均为5.38,每个位点从1(zll-12)到9(zll-30 和zll-68)不等,有效等位基因数平均为3.64。MX 群体中,观测等位基因数平均为5.75,每个位点从2(zll-12)到10(zll-68)不等,有效等位基因数平均为3.65。D 群体中,观测等位基因数平均为5.13,每个位点从2(zll-12)到11(zll-30)不等,有效等位基因数平均为3.45。对8个微卫星标记群体杂合度计算结果(表2)显示,RN群体平均观察杂合度、期望杂合度、Nei 期望杂合度分别为0.60、0.60、0.59;MX 群体平均观察杂合度、期望杂合度、Nei 期望杂合度分别为0.60、0.62、0.61;D 群体平均观察杂合度、期望杂合度、Nei 期望杂合度分别为0.56、0.61、0.59。
根据表3 统计结果可知,8 个位点在RN、MX、D 三个群体中,除zll-12、zll-61 的PIC 小于0.5 外,其余6 个位点的PIC 值均高于0.5,说明所选取的位点大多为高多态位点(图1)。zll-30 与zll-68 的多态信息含量在3 个群体中均较高,zll-30 在D 群体中多态信息含量达0.89,zll-68 的多态信息含量在3 个群体中均超过了0.83。
3 讨论
因为国内雉鸡品种(D)和由美国引进的原种雉鸡2 个品种中华环颈雉(RN)和蒙古雉(MX)属于同一物种,因此从3 个品种中随机选择国内雉鸡品种(D)的1 个样本进行高通量测序,从而得到雉鸡所拥有的SSR 位点。雉鸡并没有基因组序列和注释信息可进行参考,只能按照无参考基因组序列的物种进行SSR 分子标记的开发,然后通过PCR 和一代测序试验验证方法筛选出可用的SSR 分子标记。针对未知基因组信息的雉鸡群体,采用454 测序平台结合SSR 富集文库测序的高通量测序方法进行雉鸡SSR 分子标记的开发,很好地解决了近缘物种引物交叉扩增所带来的无PCR 产物的高风险,而且454 平台能够提供足够的侧翼序列用于特异性PCR引物设计[4]。SSR 富集文库的构建能够减少测序数据量,降低测序成本,提高开发效率,分析手段目标更明确、更经济、快速、高效,也为研究其他未知基因组信息的物种的分子标记提供了思路和方法。

表1 多态性SSR 引物信息
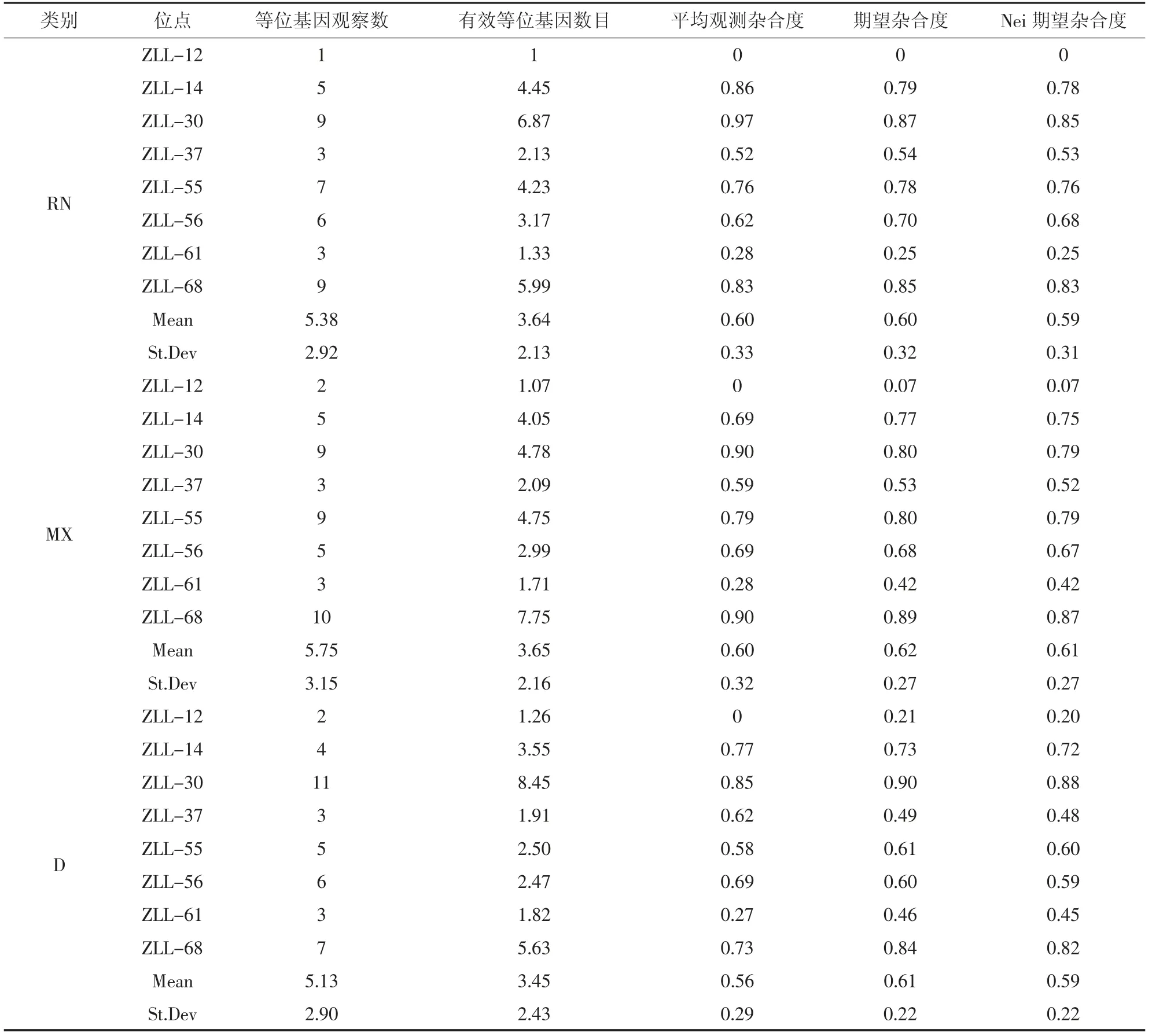
表2 雉鸡群体的等位基因数和杂合度
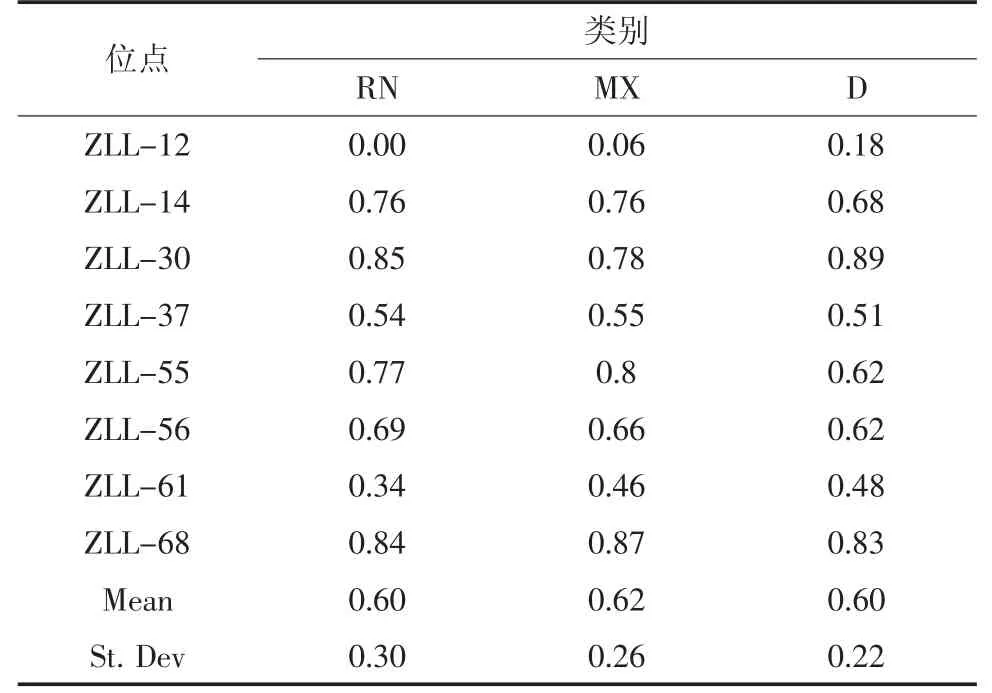
表3 雉鸡群体的多态信息含量
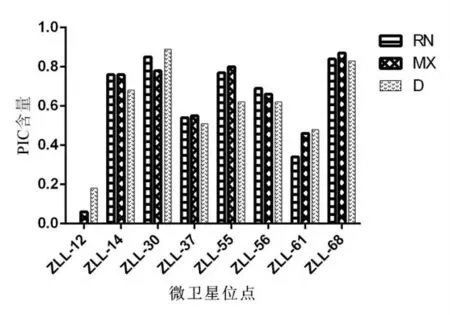
图1 三个群体中8 个微卫星位点PIC 含量分布
有效等位基因数越接近所检测到的等位基因的绝对数,表明等位基因在群体中分布越均匀[5]。本研究中8 个微卫星标记在雉鸡群体中有效等位基因数最小为1,最大为8.45,反映出8 个微卫星标记的等位基因在群体中分布不均匀。基因杂合度被认为是度量群体遗传变异的最适参数。杂合度越低,表明该群体遗传一致性越高,遗传多样性也越低[6]。对于分子遗传标记,Helentjaris 等[7]提出用多态信息含量值(PIC)衡量基因变异程度高低、反映遗传信息的多少。多态信息含量是等位基因频率和等位基因数的变化函数。当位点PIC>0.5 时,该位点为高度多态位点;当位点0.25<PIC<0.5 时为中度多态位点;当PIC<0.25 时为低度多态位点。zll-30 与zll-68的多态信息含量在3 个群体中均较高。多态信息含量(PIC)和遗传杂合度(He)都是表示群体内遗传变异的指标。从保种的角度来考虑,我们要保持品种的遗传多样性,只有PIC 和He 数值大,才能说明群体遗传多样性比较丰富。所以,由表2 和图1 可知,本研究所选雉鸡群体的遗传多样性非常丰富,这与雉鸡的实际繁养情况相符合。因为国内雉鸡养殖长期处于散养状态,并且没有受到高强度的选择。
4 结论
在雉鸡生产中,雉鸡羽色、颈环大小、产蛋性能等都是影响雉鸡企业经济效益的重要因素。采用传统育种与分子标记结合的选择育种,可有效提高雉鸡生产的经济效益。本研究利用8 对微卫星标记对雉鸡群体进行多态性检测,旨在为下一步指导雉鸡分子育种提供科学依据和数据支撑。
