EM菌对小鼠肠道病变的修复作用
2020-05-21阎春晖牛浩强
余 然 李 瑞 阎春晖 牛浩强
河南师范大学,河南新乡453000
肠道病变是一种已被世界卫生组织列为具有挑战性的病症,肠道的患病主要与微生物、寄生虫、病毒感染、遗传、自身免疫反应、神经精神等因素有较大关联[1]。在实际试验中可用DSS(葡聚糖硫酸钠)来创建结肠炎模型[2]。对于养殖业来说,一旦动物患有肠道疾病将给养殖户带来巨大损失,不仅会导致动物饲养期延长,产量下降,而且病情极易反复,为养殖工作带来巨大隐患。针对肠道疾病对养殖业的危害性,研制出一种有效的治疗或防御结肠炎的药物意义重大。而传统的治疗肠道疾病的药物主要为化学药剂或者激素制剂,如泼尼松等,甚至是抗生素治疗。传统药物的使用容易带来各种各样的副作用,如使用化学药剂容易造成胃肠道损伤,出现拉稀、消化不良、食欲降低、肠道平滑肌松弛、蠕动缓慢甚至出现出血性损伤,使动物生长期延长,料比下降;药源性肝损伤,肝脏是解毒器官,同时也导致药物中的毒素主要作用于肝脏,出现肝损伤[3]。而由于长期的不科学、不合理地使用,甚至违规添加,导致了耐药性问题和肉中抗生素残留超标问题。抗生素在消灭病菌的同时,也消灭了对动物机体有益生理性细菌,破坏肠道微生态平衡,使动物机体产生了抗药性细菌,危害食用者身体健康[4]。2015年9月,农业部发布公告,禁止在食用动物中使用如洛美沙星等4 种抗生素,2020年饲料将全面禁抗。因此,无抗养殖将是大势所趋。
在众多替代抗生素的治疗方案中,益生菌疗法是有效治疗肠道疾病的重要方案之一。研究表明[5],肠道微生物菌群分布情况可影响个体健康状况,肠道内的益生菌可以创造极端环境或者分泌相关因子掌控有害菌的存活繁衍。选用无耐药性的益生菌不会带来化学污染,或者肠胃肾脏肝脏损伤,也不会堆积在体内造成残留,故而使用益生菌治疗结肠炎具有巨大现实意义,本研究采用多种混合菌种制成EM 菌剂来改善治疗结肠炎。本研究选用这6 种微生物及其原因:地衣芽胞杆菌是需氧型益生菌,使用后可以让其进入肠道中抢夺氧气以此来制造无菌环境,促进肠道内其他正常厌氧菌的生存而且可以抑制有害细菌的繁殖[6];凝结芽孢杆菌主要生存空间位于结肠和盲肠中,服用后会在结肠和盲肠中生存与大量繁殖,且随其生长会产生大量于机体有益的和可以抗菌的小分子物质[7];德氏乳杆菌保加利亚亚种与酿酒酵母可分别大量产生乳酸和二氧化碳;屎肠球菌可以抑制肠道菌群菌氨的产生,降低肠道内pH,使有害菌无法生存;丁酸梭菌具有高效的调理肠道的作用,可以调节肠道内微生物菌落平衡,促进肠道内益生菌群增殖[8],减少毒性分子胺类和硫化氢等的产生,从而降低各种疾病的发生[9]。为了研究上述组合的EM 菌在动物肠道疾病修复中的作用,本研究以小鼠肠道为模型,采用葡聚糖硫酸钠(DSS)诱导小鼠肠道发生病变,并用EM 菌修复小鼠肠道,检测小鼠体重、免疫酶活力、肛门便血情况以及肠道结构变化,从而探索EM 菌对小鼠肠道病变的修复作用。
1 材料与方法
1.1 试验材料
1)试验动物:昆明小鼠。
2)药物与试剂:EM 菌剂、多聚甲醛粉末、液体石蜡、碱性磷酸酶(AKP)试剂盒、谷丙转氨酶(GPT)试剂盒、葡聚糖硫酸钠(DSS)。
3)仪器:高速冷冻离心机、电动切片机、分光光度计、恒温水浴锅、蜡箱、液氮罐、-80 ℃冰箱。
1.2 试验方法
1)DSS 浓度的确定[10]。本试验目的在于检测EM菌剂中6 种菌是否对患有结肠炎的小鼠有缓解治疗作用,故首先需要得到小鼠的肠道病变模型。选取12 只昆明小鼠(体重(30±3)g),分为3 组,每组4只,分别用3%、4%、5%的葡聚硫酸钠混水代替清水喂食3 组小鼠,每天早上08:00 给药,期间不给清水,其他喂养条件正常,每天观察小鼠精神状态及体重变化,7 d 后解剖观察肠道形态。根据试验结果,选择合适的DSS 浓度,建立小鼠肠道病变模型。
2)EM 菌修复小鼠肠道病变。根据上述试验结果,选择合适浓度的DSS 为小鼠给药,且根据试验目的设计试验如下:将24 只昆明小鼠(30±3)g 分为3 组,每组8 只,分别为正常组、EM 菌组、自然恢复组,将3 组小鼠在同样室温下饲养。将EM 菌组、自然恢复组小鼠每天17:00 给予DSS 混水饮服,给药饮服7 d,待其发病;正常组小鼠每天17:00 给予正常清水。EM 菌组小鼠发病后开始给EM 菌治疗,每天17:00 饮服5 mL EM 菌液,设恢复期为7 d,观察恢复期内小鼠生理形态变化。将自然恢复组小鼠发病后不给予药物治疗,让其根据自身免疫力自然恢复,观测其与EM 菌组小鼠的生理变化差别。且试验在第7 天、第14 天用摘眼球取血法分别各自采集正常组、EM 菌组、自然恢复组小鼠的血液,静置凝固后,低温离心,取上层血清待测,解剖取出肝脏液氮封存待测,将血清、肝脏分别按照试剂盒给定说明书方法用分光光度计测小鼠碱性磷酸酶(AKP)、谷丙转氨酶(GPT)的酶活性。取出结肠处理包埋,于切片机上制8 μm 石蜡横切切片[11],并且在试验期间每天观察和记录小鼠的各种身体状况变化。
2 结果与分析
2.1 DSS 浓度对小鼠肠道病变的影响
分别采用不同浓度的DSS 喂食小鼠,结果显示(图1),采用3%的DSS 喂食小鼠,解剖后观察发现肠道出现变化,肠道内壁微微发炎,但无明显血便,毛色暗淡,无明显怕冷发抖症状,且停药后很快恢复正常,故3% DSS 浓度不符合试验需要,排除3%DSS 浓度攻毒;4% DSS 浓度的小鼠攻毒4 d 后出现血便,毛色暗淡,小鼠行动不再活跃,且不停发抖,单个小鼠时喜欢往木屑里藏,有明显怕冷现象,饮水饮食量明显下降,7 d 后解剖发现肠道有明显发炎现象;5%持续1 周后全部死亡,判断5%浓度过大,排除5%的浓度,故根据预试验结果决定正式试验选用4%的DSS 来攻毒昆明小鼠,建造小鼠结肠炎模型。
2.2 小鼠体重及肛门便血情况变化

图1 DSS 浓度对小鼠肠道形态的影响
各组小鼠体重及肛门便血情况如图2 和图3所示,可知正常组的小鼠体重在饲养期间不停地上升,而给DSS 组的小鼠前3 d 体重变化不明显,3 d后体重开始大幅下降,并且肛门较正常小鼠颜色深,从浅粉色变为深红色,粪便颜色也稍有变化,较之前粪便颜色变深发黑。随给DSS 时间延长,个别小鼠便血愈发严重,出现脱肛现象,且小鼠精神萎靡不振。7 d 后未给EM 菌的自然恢复组小鼠便血越发严重,且在停止给DSS 后的4 d 内全部死亡;而给EM 菌的试验组小鼠有部分便血过于严重的在给EM 菌第2 天就已经死亡,其余小鼠在给EM 菌的前2 d 体重持续下降或维持不变,后期体重略有回升,第10 天开始部分小鼠停止血便,但其中2 只在给EM 菌的第5 天和第6 天相继死亡,死亡时已停止血便。

图2 试验过程中小鼠体重的变化
2.3 小鼠免疫酶活力变化
根据图4 可知血清碱性磷酸酶、血清谷丙转氨酶、肝脏谷丙转氨酶活性在给DSS 期间均在不断上升,但给EM 菌后血清谷丙转氨酶、血清碱性磷酸酶、肝脏谷丙转氨酶都开始以不同幅度下降。有研究表明[12-14],碱性磷酸酶可以缓解小鼠肠道病变,故在给DSS 诱导小鼠患病时,由于小鼠自身免疫力促进小鼠分泌合成碱性磷酸酶,所以测得的小鼠碱性磷酸酶活性不断升高,后期由于给予EM 菌缓解治疗小鼠的肠道病变,所以小鼠体内的碱性磷酸酶活性下调。谷丙转氨酶多分泌于肝脏受损时[15],随着给DSS 时间增长,小鼠的肝脏也受到了一定损伤,肝脏细胞通透性增加,从肝脏渗透到血清中的谷丙转氨酶增多,后期随着小鼠逐渐恢复,谷丙转氨酶活性下降,但并未恢复到正常水平,同时解剖后的小鼠肝脏也证明了肝脏有受伤后恢复现象,从图5中可以看到由于肝界板破坏,炎细胞浸润,纤维组织增生包绕坏死组织形成的局限性坏死,呈白色颗粒状[16]。

图3 试验过程中小鼠肛门及粪便变化
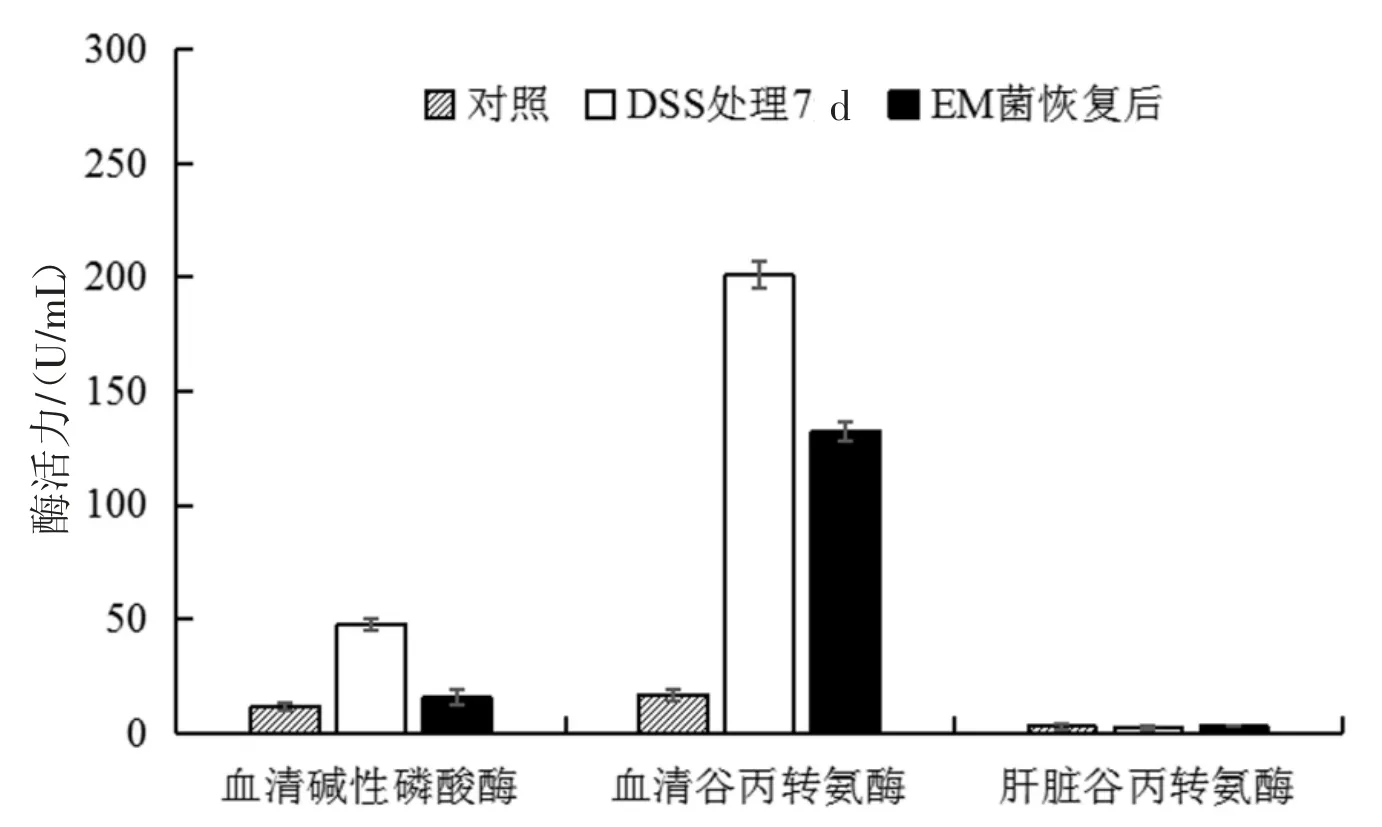
图4 小鼠酶活力变化

图5 小鼠肝脏变化
2.4 小鼠肠切片观察
从图6 中可以明显看出,经由DSS 攻毒后的肠道损伤严重,肠道上的绒毛几乎消失,且肠壁变薄,而给EM 菌恢复后的肠道开始好转,肠壁明显变厚,且有部分肠道绒毛重新出现,由此可见EM 菌对于结肠炎的恢复具有一定作用。
3 结论
4%的DSS 连续喂食小鼠可以很好地建立肠道病变模型,小鼠在停药后病情依然持续加重,很快出现死亡现象。而在肠道发生病变后,及时喂食EM菌,小鼠的体重逐步恢复、免疫酶活力几乎恢复正常、肠道内壁结构也与正常小鼠相似,小鼠死亡率大大降低。因此,EM 菌在肠道病变的修复方面具有显著作用,该结果为EM 菌在动物肠道疾病治疗方面的应用提供了重要依据。

图6 小鼠肠切片
