CYP-EET信号通路对大鼠MCAO缺血再灌注后血管新生影响的研究
2020-05-21刘阳郑小龙喻志源王伟谢敏杰
刘阳,郑小龙,喻志源,王伟,谢敏杰
血管新生在脑缺血后神经修复中具有重要作用。脑缺血时血流中断引起氧和营养物质供给障碍,细胞能量代谢紊乱,离子稳态失衡,细胞凋亡。脑缺血后新生血管的形成增加了缺血区血流供应,促进了新生血管网络的形成,为缺血缺氧组织提供能量,促进神经损伤的修复[1]。细胞色素P450(cytochrome P450, CYP450)表氧化酶可代谢花生四烯酸而生成一种小分子活性物质—环氧二十碳三烯酸(epoxyeicosatrienoic acids,EETs)。根据环氧基位置的不同,EETs分为4种亚型: 5,6-EET、8,9-EET、11,12-EET、14,15-EET。研究报道,EETs主要由CYP表氧化酶家族中CYP2C和CYP2J 2种亚型代谢花生四烯酸而生成。EETs在体内被表氧化物水解酶(soluble epoxidehydrolase, sEH)代谢生成没有活性或活性很低的二羟基二十碳三烯酸(dihydroxyeicosatrienoic acids, DHET)从而构成一个完整的系统发挥生理作用。既往研究报道,EET具有非常广泛的生物学功能,包括扩张血管,促进细胞增殖,抑制细胞凋亡,细胞迁移及抗炎等[2]。然而,脑缺血后CYP-EET信号系统对梗死边缘区血管新生的影响及其相关机制目前尚不清楚。本研究采用外源性14,15-EET或sEH选择性抑制剂12-(3-金刚烷-1-基-脲基)十二烷酸[12-(3-adamantan-1-yl-ureido)dodecanoic acid,AUDA]增加内源性EETs的含量,研究CYP-EETs信号系统对大鼠大脑中动脉闭塞(MCAO)缺血再灌注后血管新生及相关信号通路的影响,报道如下。
1 材料与方法
1.1 材料 (1)动物:SPF 级健康成年SD 雄性大鼠80 只,体质量220~250 g,由华中科技大学同济医学院附属同济医院实验动物中心提供。所有动物实验均严格遵循实验动物伦理委员会的相关规定,并获得华中科技大学实验动物伦理委员会同意;(2)试药试剂:p-Erk兔多克隆抗体、p-Akt兔多克隆抗体(购自美国Cell Signaling 公司),GAPDH鼠单克隆抗体(购自武汉谷歌生物科技有限公司),vWF兔多克隆抗体(购自美国Abcam公司),VEGF鼠单克隆抗体(购自美国Abcam公司),VEGFR兔多克隆抗体(购自美国Cell Signaling公司), cy3 标记山羊抗兔IgG(购自美国Jackson ImmunoResearch公司),IRDye 800-conjugated山羊抗兔IgG,Alexa Fluor700-conjugated 山羊抗小鼠IgG(购自美国LI-COR Biosciences公司),RIPA强蛋白裂解液(购自美国Pierce公司),BCA蛋白定量试剂盒(购自美国Thermo公司),蛋白酶抑制剂cocktail,磷酸化蛋白酶抑制剂(购自美国Roche公司),蛋白Marker(1811)(购自美国Fermentas公司),凝胶配置试剂盒(购自武汉谷歌生物科技有限公司),NC膜(购自美国Millipore公司),14,15-DHET ELISA试剂盒(购自美国Detroit R&D公司);(3)仪器设备:Alzet给药微泵2001型、Alzet Brain Infusion Kits 2(购自美国 Durect公司),SR-6N 立体定位仪(购自日本Narishige 公司),CM1900 冰冻切片机(购自德国Leica 公司),Odyssey IR成像系统(购自美国LI-COR Biosciences公司),激光共聚焦显微镜(购自日本Olympus公司)。
1.2 动物分组及造模 2017年6月—2018年4月于华中科技大学同济医学院附属同济医院进行实验。
1.2.1 动物分组:研究分为2部分。(1)研究大鼠MCAO后不同时间点脑内14,15-EET的变化,大鼠分为假手术组和缺血(MCAO)组,分别于缺血再灌注后1 d、3 d、7 d检测各组大鼠脑组织14,15-EET;(2)研究CYP-EET信号系统对大鼠MCAO缺血再灌注后血管新生、VEGF/VEGFR、Erk、Akt信号通路的影响,大鼠分为假手术组、溶剂对照组、14,15-EET干预组、AUDA干预组,分别于缺血再灌注后1 d、3 d、7 d进行检测,其中1 d、3 d检测VEGF、p-Erk、p-Akt蛋白水平;7 d检测vWF、VEGFR阳性的微血管密度。
1.2.2 动物造模:以参考文献[3]的方法建立大鼠MCAO模型。采用右侧颈内动脉插入线栓的方法阻断同侧大脑中动脉血流,首先腹腔注射氯胺酮和异丙嗪复合麻醉大鼠,采用仰卧位并固定,暴露右侧颈总动脉;结扎颈外动脉及颈总动脉近心端,用动脉夹夹闭颈内动脉;在颈总动脉远心端用显微剪做一切口,将线栓由此切口缓慢插入颈内动脉,直至线栓头部到达右侧大脑中动脉处;激光多普勒血流监测可见血流下降值约为基线水平的 70%~80%即造模成功[4];缺血1 h后缓慢拔出线栓实施缺血后再灌注。假手术组不插入线栓,其余操作与上述一致。手术期间,利用保温垫使直肠温维持在(37.0±0.5)℃。干预组缺血前30 min采用Alzet给药微泵持续侧脑室给药,药物浓度为14,15-EET 10 μmol/L,AUDA 1 mmol/L,溶剂对照组注射含有相同浓度二甲基亚砜(DMSO)的生理盐水,给药剂量参照文献[5],给药时间为7 d,Alzet给药微泵的使用严格按照说明书操作。
1.3 观测指标与方法
1.3.1 14,15-EET检测:采用14,15-DHET ELISA竞争性试剂盒检测大鼠MCAO缺血再灌注后1、3、7 d脑组织匀浆中14,15-DHET含量,最终换算为脑组织14,15-EET的水平。测定严格按照仪器和试剂盒要求进行。
1.3.2 vWF及VEGFR阳性的微血管密度检测:采用免疫荧光技术检测。大鼠深度麻醉后断头取脑,-80℃异戊烷速冻,-20 ℃冰冻切片机切片,厚度为10 μm,贴于多聚赖氨酸包被的玻片上。4%多聚甲醛磷酸盐缓冲液固定15 min,0.01 mol/L PBS 漂洗后0.25%Triton-X100 破膜,10%BSA 室温封闭2 h,加入一抗vWF(1∶400)、 VEGFR(1∶100)4℃孵育过夜。阴性对照采用抗体稀释液孵育过夜,0.01 mol/L PBS漂洗后避光加入二抗cy3 标记山羊抗兔抗体(1∶400),室温孵育1 h。Olympus激光共聚焦显微镜采集图像。每张切片随机选取5个视野,同一曝光参数下采集图像,Image-J软件统计分析每个视野下vWF及VEGFR阳性的微血管密度。
1.3.3 脑组织蛋白浓度检测: 采用Western-bolt法测量。大鼠深度麻醉后断头取脑,取缺血边缘区大脑皮质,RIPA 裂解液提取总蛋白,离心取上清,蛋白变性后制备SDS 聚丙烯酰胺凝胶并加样电泳,将蛋白转膜至0.45 μm 醋酸纤维膜,5%脱脂奶粉室温封闭2 h,p-Erk兔多克隆抗体(1∶500)、p-Akt兔多克隆抗体(1∶500),VEGF 鼠单克隆抗体(1∶500),GAPDH 鼠单克隆抗体(1∶1 000)4℃孵育过夜,0.5% TBST 漂洗(6 min×4 次),IRDye 800-conjugated 羊抗兔二抗(1∶5 000), Alexa Fluor700-conjugated山羊抗小鼠二抗(1∶5 000)室温避光孵育1 h;用Odyssey IR红外显像系统检测蛋白条带的免疫活性,记录平均吸光度(mean optical density),并以GAPDH为内参进行校正。
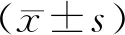
2 结 果
2.1 大鼠MCAO后不同时间点脑内14,15-EET的变化 大鼠MCAO缺血再灌注后1、3、7 d脑组织匀浆中总的14,15-EET比较,第1 d缺血组低于假手术组(P<0.05);第3、7 d缺血组均高于假手术组(P<0.05),见表1。
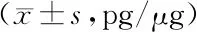
表1 大鼠MCAO后不同时间点脑内14,15-EET水平比较
2.2 各组脑组织vWF及VEGFR阳性的微血管密度比较 采用血管内皮细胞特异性标志物vWF标记微血管内皮细胞, 第7天,溶剂对照组明显低于假手术组(P<0.05),14,15-EET干预组、AUDA干预组明显高于溶剂对照组(P<0.05)。
采用VEGFR标记新生血管,第7天,溶剂对照组明显高于假手术组(P<0.05),14,15-EET干预组明显高于溶剂对照组(P<0.05);AUDA干预组虽然较溶剂对照组增多,但差异无统计学意义(P>0.05),见图1、表2。
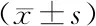
表2 干预后vWF和VEGFR阳性微血管密度比较
2.3 各组脑组织VEGF蛋白表达比较 采用Western-bolt方法检测VEGF蛋白表达,第1天及第3天时,溶剂对照组明显高于假手术组(P<0.05),14,15-EET干预组、AUDA干预组明显高于溶剂对照组(P<0.05),见图2、表3。
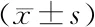
表3 各组干预后VEGF蛋白表达水平比较
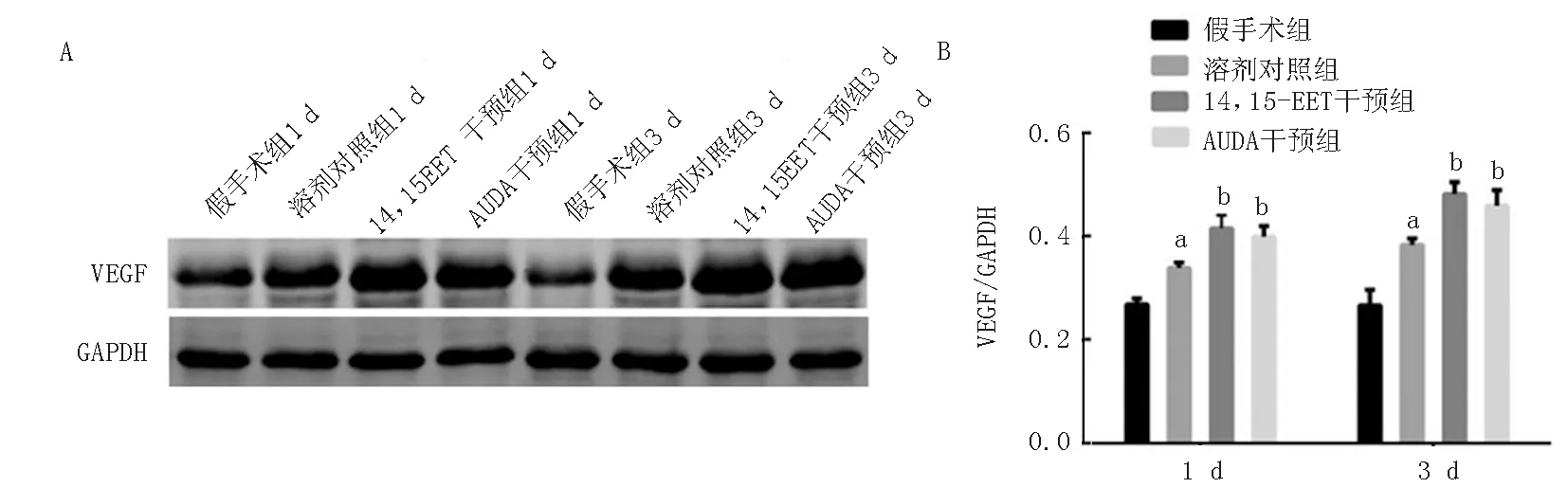
注:与假手术组比较,aP< 0.05;与溶剂对照组比较,bP< 0.05
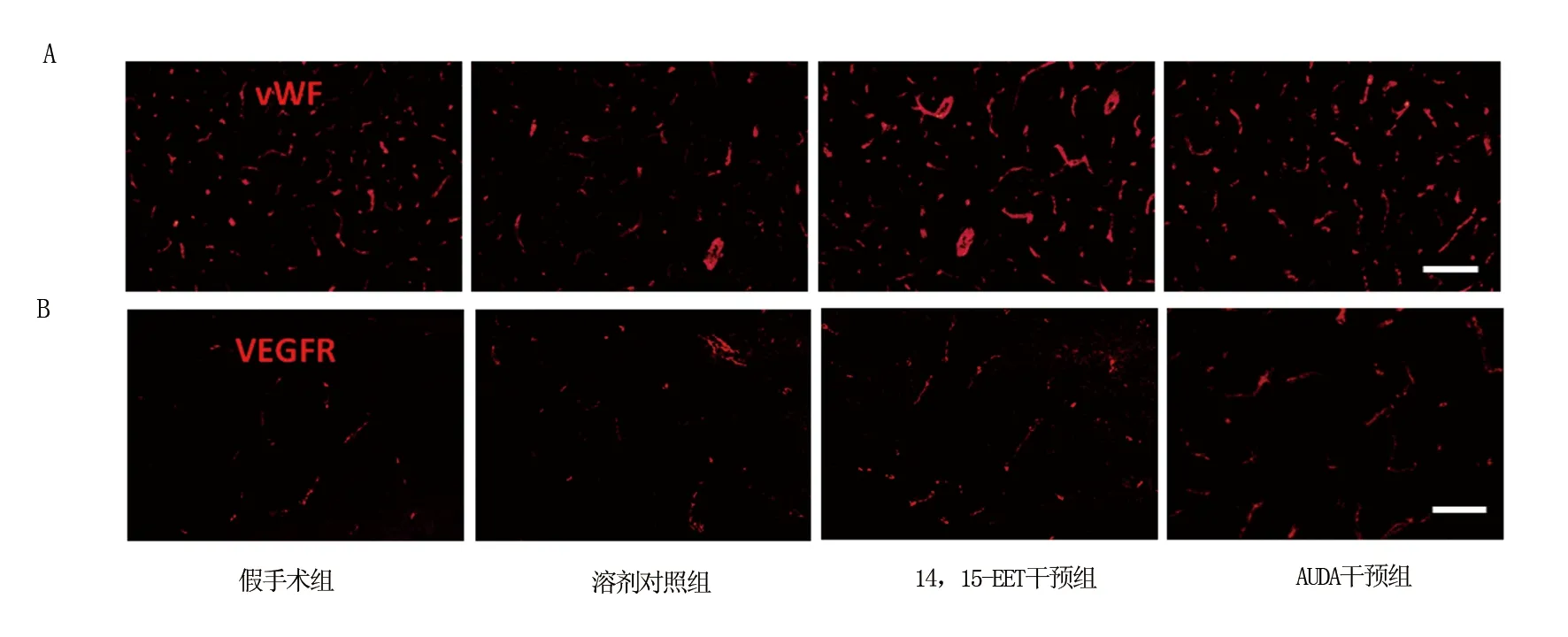
2.4 各组脑组织干预后p-Akt和p-Erk蛋白表达比较 Western-bolt结果显示,第3天时,溶剂对照组p-Akt及p-Erk蛋白水平均明显高于假手术组(P<0.05),14,15-EET干预组、AUDA干预组明显低于溶剂对照组(P<0.05),见图3、表4。
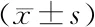
表4 各组干预后p-Akt和p-Erk蛋白表达水平比较
注:A.红色荧光代表血管内皮细胞标志物vWF,标尺=100 μm;B.红色荧光代表VEGFR阳性新生血管,标尺=50 μm
图1 各组vWF及VEGFR阳性的微血管密度比较
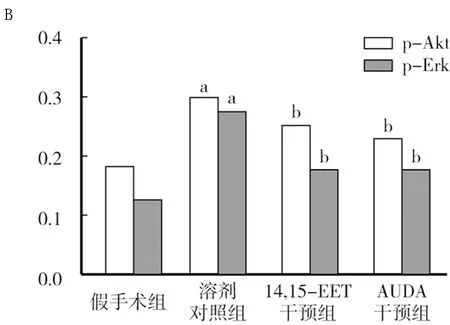
注:与假手术组比较,aP<0.05;与溶剂对照组比较,bP<0.05
图3 各组干预后p-Akt、p-Erk蛋白表达比较
3 讨 论
CYP表氧化酶-EETs信号系统在中枢神经系统的正常生理和多种神经系统疾病中都具有重要的作用。生理情况下,EETs被认为是突触传递的重要调节因子,参与脑血流的调节、皮质血管新生、抗细胞凋亡、调节神经激素的生成等[6]。Li等[7]研究发现,在小鼠全脑缺血模型中,脑组织及血浆中14,15-DHET水平较对照组显著升高,过表达CYP2J2小鼠脑缺血后梗死体积、细胞凋亡较野生型小鼠显著减少,说明EETs在脑缺血过程中发挥神经保护作用。本研究也发现,MCAO后3、7 d时脑内14,15-EET含量显著升高,但是1 d时14,15-EET含量却减少,推测该变化可能的原因是脑缺血急性期大量细胞坏死,导致EETs生成减少,而后期胶质细胞增殖活化,血管内皮细胞新生后EETs的生成代偿增多。
研究发现,EETs发挥神经保护作用的机制主要与抗凋亡、抗炎性反应、抗血栓形成等有关。Geng等[8]研究发现,EETs通过抑制Caspase-3的激活、细胞色素C释放发挥抗凋亡作用,减少梗死体积。Liu等[9]发现EETs通过减少缺血后炎性因子TNF-α、IL-6、NF-κB、iNOS分泌,发挥神经保护作用。此外,也有研究发现EETs在肿瘤、心肌梗死、视网膜等疾病中具有促进血管新生的作用[10-11],然而EETs信号系统在脑缺血中是否具有促进血管新生的作用尚不清楚。故本研究建立MCAO缺血再灌注模型,分别通过侧脑室注射外源性14,15-EET和AUDA增加内源性EETs,观察其对血管新生的影响。结果发现,外源性加入14,15-EET或sEH抑制剂AUDA可显著增加缺血边缘区微血管密度。VEGF参与脑缺血后一系列神经损伤修复的过程,包括促进神经元存活、血管新生、神经前体细胞的增殖、迁移和分化[12-13]。 VEGFR-2作为VEGF的重要受体表达于内皮细胞和神经元,VEGF/VEGFR信号通路在血管新生及神经损伤与修复中扮演了重要角色[14]。Sommer等[15]研究发现,EETs可显著增加VEGF表达,促进缺血诱导的创伤处血管新生;Zhao等[16]报道,EETs增加心肌梗死后VEGF的表达,促进血管新生。此外,Zhang等[17]研究发现,sEH抑制剂可促进缺氧缺糖时星形胶质细胞分泌VEGF,激活神经元VEGFR,减少神经元凋亡,发挥神经保护作用。研究表明,有丝分裂原活化蛋白激酶(Erk)及磷脂酰肌醇3激酶/蛋白激酶B(PI3K/Akt)磷酸化等机制可能是VEGF/VEGFR的下游通路[18-20]。与此类似,本研究发现外源性加入14,15-EET或sEH抑制剂AUDA可显著上调缺血边缘区VEGF和VEGFR的表达,同时抑制Erk和Akt的蛋白磷酸化水平,说明EET的血管新生作用与上调VEGF/VEGFR的表达密切相关,Erk及Akt信号通路可能是其重要机制之一。
综上所述,本研究在MCAO缺血再灌注模型中发现,CYP-EET信号系统可以增加缺血边缘区微血管密度,可能与VEGF/VEGFR信号通路激活有关。后期尚需要更多体外细胞水平的信号通路研究加以证实。
利益冲突:所有作者声明无利益冲突
作者贡献声明
刘阳:设计研究方案,实施研究过程,论文撰写;郑小龙:提出研究思路,分析试验数据,论文审核; 喻志源、王伟、谢敏杰:实施研究过程,资料搜集整理,论文修改
