血管腔内支架成形术治疗孤立性肠系膜上动脉夹层的疗效
2020-05-21张文广任建庄陈鹏飞王家兴毕永华韩新巍段旭华李应敬许琳惠
张文广,万 里,任建庄,陈鹏飞,王家兴,毕永华,韩新巍,段旭华,李应敬,许琳惠
郑州大学第一附属医院放射介入科 郑州 450052
孤立性肠系膜上动脉夹层(isolated superior mesenteric artery dissection,ISMAD)是指不伴随主动脉夹层及内脏动脉夹层,只发生在肠系膜上动脉(superior mesenteric artery dissection,SMA)的夹层,这是一种罕见但可能致命的动脉疾病。随着影像技术的发展,特别是CTA的广泛应用,该病的发现及确诊日益增加[1]。目前,对该病的治疗规范尚未达成共识,主要治疗方法有内科保守治疗、外科开放治疗和血管介入治疗[2]。我们采用血管腔内支架成形术治疗11例ISMAD,取得良好临床疗效,现总结报道如下。
1 临床资料
1.1病例资料回顾性分析2013年1月至2018年1月于我院行血管腔内支架成形术治疗的ISMAD患者11例的临床资料,其中男10例,女1例,年龄39~70(51.0±6.5)岁。首发症状均表现为上腹部或脐周急性持续性疼痛,其中8例伴有腹背部胀痛、恶心、呕吐、腹胀等其他症状,合并原发性高血压6例、高脂血症3例、动脉粥样硬化3例、2型糖尿病2例、腹部外伤1例。经腹部平片、实验室检查等排除胃肠道穿孔、消化道出血、急性肠坏死等急腹症,经由CTA及DSA明确诊断。
1.2影像学分型Yun等[3]分型标准I型:真腔和假腔均通畅,假腔有入口和出口;Ⅱa型:真腔内血流通畅,假腔有入口,没有出口;Ⅱb型:真腔内血流通畅,假腔内血栓形成;Ⅲ型:真腔假腔均闭塞(图1)。本组Ⅱa型5例,Ⅱb型5例,Ⅲ型1例。
1.3治疗方法
1.3.1 术前准备 本组11例患者经确诊后,给予禁食水、胃肠减压、静脉营养、低分子肝素抗凝、解痉镇痛等基础治疗,并完善相关介入术前准备。
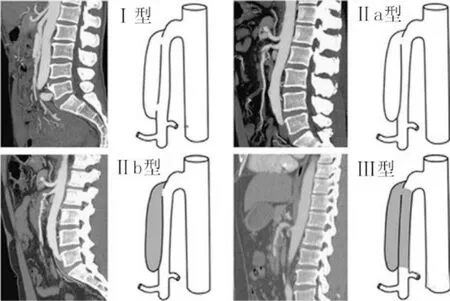
图1 Yun影像学分型示意图
1.3.2 介入手术 经股动脉或左侧肱动脉入路,经鞘引入5F猪尾导管(美国COOK)置于腹主动脉上段,正位及左前斜60°高压造影明确SMA开口及夹层累及范围;交换引入5F Cobra导管(美国COOK)并定位于SMA开口,再次造影显示夹层开口位置、累及范围、真腔大小及远端血运情况;引入0.035英寸(0.889 mm)超滑导丝(日本Terumo)超选择至真腔远端较大分支内,造影证实后交换引入加硬导丝及7F导引导管(美国COOK)与5F Cobra导管同轴系统并定位于SMA主干内,退出Cobra导管,沿加硬导丝引入支架输送系统,定位于夹层病变区域准确释放,后再次造影明确夹层封堵情况。支架类型取决于夹层开口位置、累及范围、真腔大小、远端血运情况及术者习惯等,对于夹层开口离分支血管较远且累及范围小者行覆膜支架植入,对于夹层累及范围广、真腔受压狭窄且远端分支血管血运受影响者先行单层裸支架植入,复查造影了解血流通畅及夹层假腔情况,若假腔仍有对比剂进入或体积不缩小,则采用支架重叠技术(支架重叠部分覆盖夹层破口)植入第2枚裸支架。
1.3.3 术后处理及随访 术后常规抗凝治疗(低分子肝素钙5 000 U皮下注射,每2 h 1次)3~7 d及抗血小板治疗(氯吡格雷75 mg+阿司匹林100 mg口服,1次/d)6个月。术后密切观察患者并发症发生情况及症状缓解情况,腹痛症状缓解后可逐步过渡为普通饮食,症状好转后出院。院外继续抗血小板治疗,术后第3、6、12个月复查肠系膜上动脉CTA,此后每年复查1次。
1.4治疗效果11例患者均成功植入支架;其中1例经股动脉入路支架输送未成功,改经左侧肱动脉入路成功植入支架。单层裸支架植入3例,双层裸支架植入7例,覆膜支架植入1例。术中造影显示SMA主干远端及分支血管血流通畅,真腔扩大,残余假腔不显影或对比剂滞留。无操作部位血管破裂、穿刺点部位血肿及假性动脉瘤等术后并发症发生。
1.5随访随访3~24个月。术后20 d内患者腹痛等症状先后得到完全缓解,此后未见复发。术后复查肠系膜上动脉CTA,2例双层裸支架植入患者出现支架内狭窄,狭窄率均<30%。未见支架移位、分支及远端血管闭塞等支架相关并发症发生。所有患者支架内血流通畅,假腔消失或血栓形成,夹层重塑(图2)。11例临床资料及随访情况见表1。
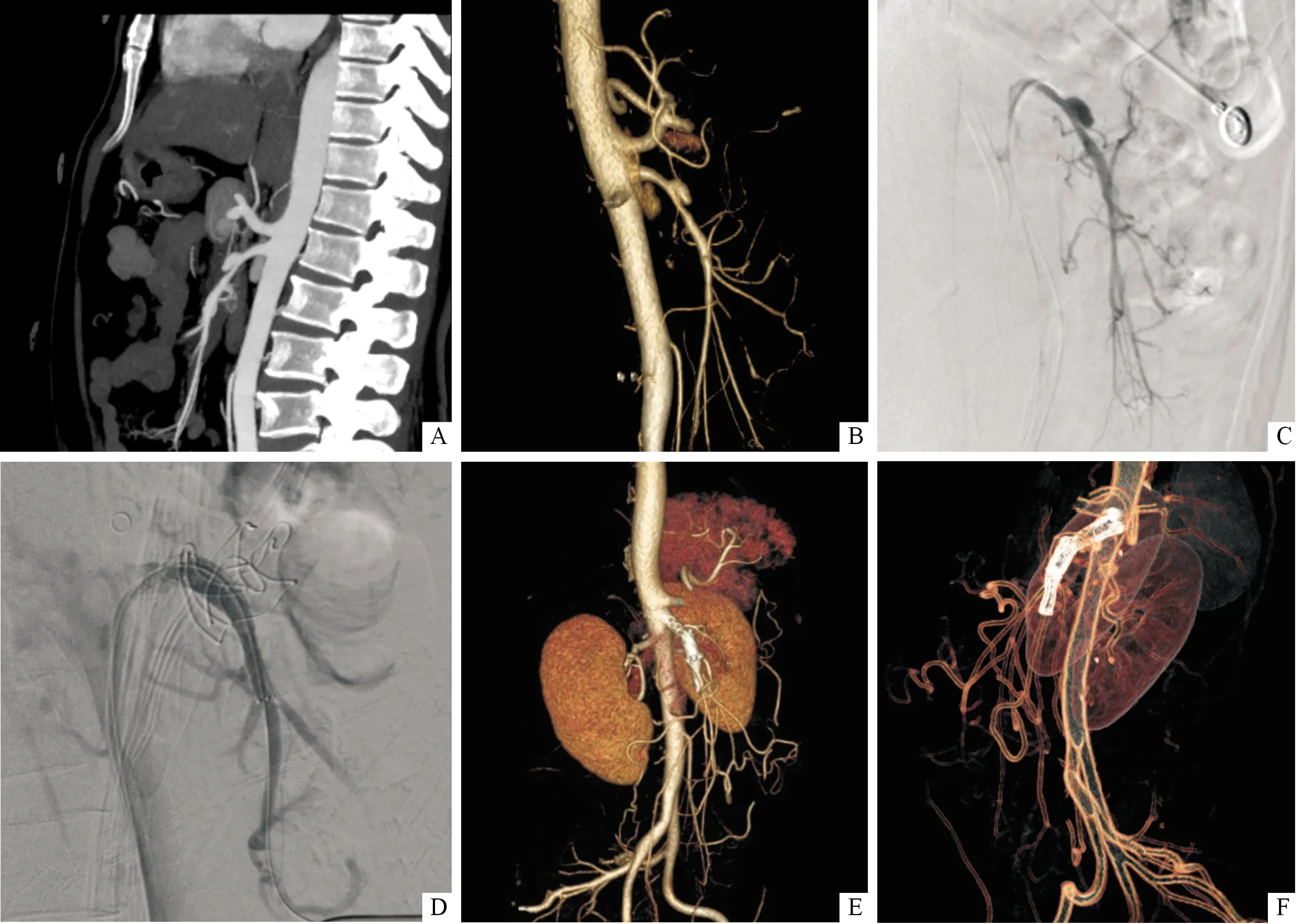
A、B、C:术前CTA及DSA明确诊断为ISMAD Ⅱa型,真腔受压狭窄,远端主干轻微瘤样扩张,分支血流未受影响;D:术中双层裸支架释放后造影示真腔扩大,假腔消失;E、F:术后3个月复查CTA示支架内血流通畅,假腔消失,夹层重塑,支架无明显移位,支架内狭窄率<20%
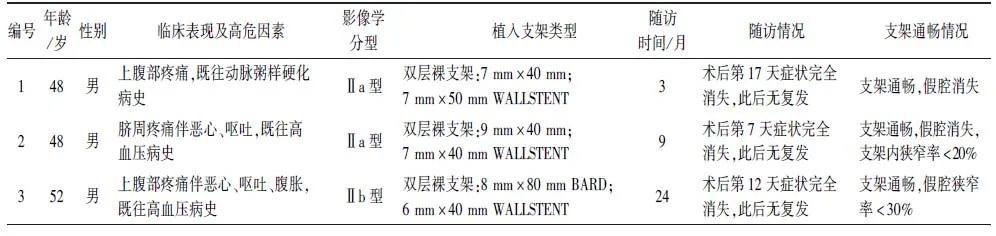
图2 Yun分型Ⅱa型患者双层裸支架重叠技术
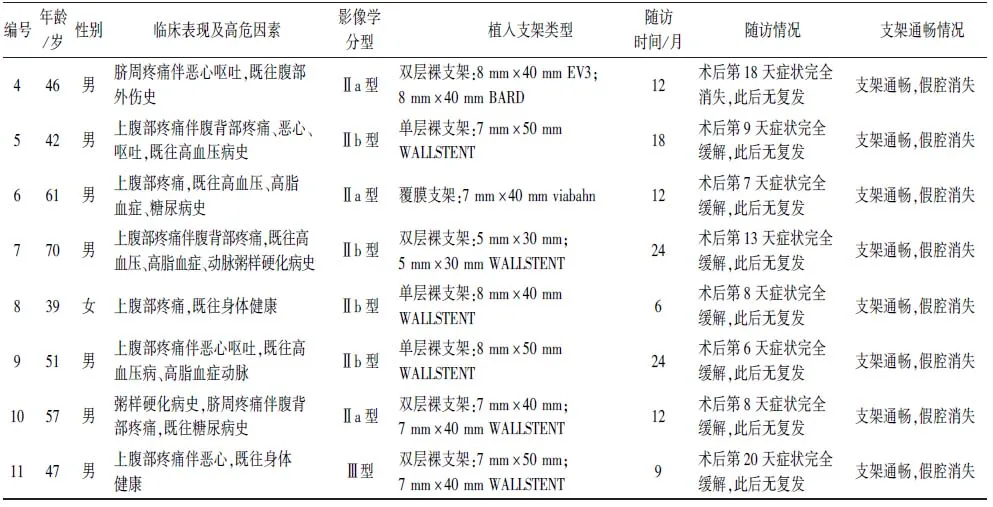
续表1
2 讨论
ISMAD临床上较为少见,国外文献报道尸检发现率仅0.06%[4],但SMA仍是最易发生夹层的内脏动脉[5]。1947年Bauersfeld[6]首次对该病进行了描述。研究[3, 7-8]报道ISMAD多发于50岁左右的男性。本研究11例中男性10例,平均年龄51岁。ISMAD的病因和发病机制尚不明确,高血压、吸烟等已被认为是高危因素[1]。动脉壁的病理学改变被认为是ISMAD的根本原因,包括动脉粥样硬化、血管纤维肌性发育不良、动脉中膜囊性坏死或退变、外膜炎症、穿透性动脉溃疡、假性动脉瘤、创伤等[9]。本研究中1例(病例4)于车祸腹部外伤后诊断为ISMAD,提示对于外伤患者不可忽视夹层这一重要并发症。有学者从解剖学角度解释该病的发病机制,提出“剪切应力”学说,即SMA走行于胰腺后方,并被周围组织包绕,位置相对固定,而远端向下弯折走行于肠系膜内,二者移行部弯曲程度大,且可随肠道蠕动而出现相对位移,容易使血流形成湍流,产生剪切力,从而损伤血管内膜导致夹层[7]。
ISMAD无特异性临床表现,主要症状为突发上腹部或脐周疼痛,多为绞痛或隐痛,疼痛程度与夹层撕裂长度呈正相关[3],并伴有不同程度的腹胀、恶心、呕吐等,临床上较难与其他急腹症相鉴别。增强CT是发现及确诊ISMAD的主要手段[1],其典型的CT表现包括:SMA呈现“双腔征(真腔与假腔)”,其中可见游离的内膜片、附壁血栓或壁间血肿[10]等。CTA有助于观察夹层累及范围、真假腔的位置。判断夹层开口位置、真腔大小、远端血运情况等需要进行DSA检查。尽管目前认为DSA是诊断ISMAD的“金标准”,但其为有创性操作,并非临床首选诊断方法[10-11]。近年来,腹部超声广泛应用于体检,使得越来越多的无症状性ISMAD被检出,说明超声对ISMAD的早期诊断有重要价值[12]。诊断ISMAD的其他方法还包括磁共振血管成像、剖腹探查等。ISMAD患者实验室检查可表现为外周血白蛋白水平升高、C反应蛋白水平升高、血清淀粉酶升高,但发生率不高,特异度和敏感度均较低[10]。
ISMAD的分型主要根据其影像学表现。最早Sakamoto等[8]于2007年分析了12例ISMAD的增强CT表现,提出将ISMAD分为4型:Ⅰ型,假腔有入口和出口;Ⅱ型,假腔只有入口而无出口;Ⅲ型,假腔内可见血栓伴溃疡样龛影(从真腔突入假腔的有血流充盈的囊袋状影);Ⅳ型,假腔内完全为血栓。Sakamoto分型仅基于SMA的影像学表现,未虑及SMA主干通畅情况。近年来,有多名学者在Sakamoto分型基础上加以改进,提出了新的分型方式。Yun等根据夹层假腔开口和血流通畅性以及真腔的通畅性将ISMAD分为3型,其中Ⅱ型根据假腔内有无血流分为Ⅱa和Ⅱb两个亚型。Yun分型较为简便,临床应用较为广泛。2010年,Zerbib等[13]增加了“夹层动脉瘤形成伴肠系膜上动脉狭窄”与“肠系膜上动脉完全或部分血栓”两种类型,并进一步细分Ⅱ型和Ⅲ型,将ISMAD分为8型。上述分型均以真假腔的关系作为分型依据,而ISMAD的临床表现常与夹层长度有关[3]。2013年,Luan等[11]根据夹层的位置及累及范围提出了新的分型方式。后来,Li等[14]对Luan分型进行补充,但是分型太复杂并且没有提供适当的夹层长度信息。2018年,Yoo等[15]提出了一种新的分型方法,根据形态特征将SMAD分为4型,并通过添加亚型来区分疾病严重程度。更多新的分型不断被提出,但哪种分型更适用于临床尚存在争议。
到目前为止,ISMAD的治疗策略尚无统一标准,治疗策略的选择取决于临床表现和影像学分型。本研究采用了Yun分型方法,Ⅰ型由于SMA血流动力学受影响小,夹层破裂风险低,可以给予禁食水、静脉营养、镇痛、控制血压以及抗凝、抗血小板等保守治疗。血管内介入治疗多应用于Ⅱa及Ⅱb型患者,主要是因为夹层真腔受压迫狭窄会导致腹痛等症状的持续不缓解[16]。Ⅲ型患者保守治疗无效可尝试血管内介入治疗,但因其真腔闭塞降低了介入治疗的成功率。外科手术主要针对夹层破裂出血及疑似肠缺血坏死的患者,方式主要为SMA血管重建术、旁路移植术、单纯肠切除术和切开取栓术,可作为保守治疗和血管内介入治疗失败后的最终手段[17]。本组11例影像学分型属于Ⅱa、Ⅱb或Ⅲ型,确诊后均接受保守治疗,症状持续不缓解,行血管内支架成形术均成功。
Leung等[18]于2000年首先报道了1例血管腔内支架植入治疗ISMAD。随着介入技术的发展,相关报道日渐增多,目前效果良好[16-19]。腔内介入治疗的优势在于能够快速、有效重建SMA血运,短时间内防止夹层进一步进展,可迅速改善临床症状,缩短住院时间[11]。腔内治疗入路的选择可能直接决定介入手术的成败。本研究11例均常规采用右侧股动脉入路,由于SMA与主动脉的夹角成锐角,如果此角度过小,则支架输送系统可能较难越过夹角通过SMA狭窄段,且容易导致相关并发症发生。本组1例YunⅢ型患者经股动脉入路支架输送失败,且由于SMA真腔闭塞,导丝超选择至远端真腔耗费时间较多,改为左侧肱动脉入路后成功植入支架。我们认为,对于SMA与主动脉夹角过小、YunⅢ型SMA真腔闭塞的患者,可优先考虑肱动脉入路。
关于支架的选择目前尚无统一认识。我们认为应当综合考虑ISMAD类型、夹层两端血管的直径、支架及其输送系统的顺应性、支架自身的径向支撑力、贴壁性、支架对分支血管的影响。本组病例大多采用了颈动脉自膨式裸支架,其优势在于支架输送器顺应性较好,支架自身与血管壁的贴合性能良好,有良好径向支撑力且不会阻断SMA分支动脉的血流。当应用双支架重叠技术时,先行单层裸支架植入,复查造影了解血流通畅及夹层假腔情况,若假腔仍有对比剂进入或体积不缩小,则采用支架重叠技术植入第2枚裸支架。本研究中2例双层裸支架植入患者出现支架内狭窄,狭窄率均<30%,考虑可能与支架直径相差过大有关。这提示我们双层裸支架重叠应用时,双支架尺寸不宜相差过大,且术后抗血小板药物的应用尤为重要。有文献[20-21]报道采用覆膜支架植入治疗ISMAD容易引起SMA分支血管的阻断,可能导致肠缺血坏死。我们认为,对于夹层开口离分支血管较远且累及范围小的YunⅡa型患者可考虑行覆膜支架植入,但其长度必须尽量短,以达到隔绝夹层破口的目的即可。覆膜支架夹层封堵效果可能优于单层裸支架及双层裸支架,且远期通畅率较高。
综上所述,血管腔内支架成形术是治疗ISMAD是一种安全、有效的办法,应用前景广阔,但远期支架通畅率及长期疗效有待进一步研究。
