CNQX拮抗断尾诱发小鼠前扣带回皮质神经元c-fos基因的表达
2020-05-20李娜然商丽宏杨宇姚阳吴敏范
李娜然,商丽宏,杨宇,姚阳,吴敏范
(沈阳医学院 1.机能与形态实验中心;2.生理学教研室,沈阳 110034)
研究[1-2]表明,截肢手术后有50%~60%以上的患者伴有幻肢痛(phantom limb pain,PLP)。前扣带回皮质(anterior cingulate cortex,ACC)已被大量的研究[3-4]证明是痛觉的重要中枢,在疼痛感知、认知和情绪等关键大脑功能中发挥重要作用。PLP患者ACC的脑血容量显著增加,与疼痛强度密切相关[5];截肢后大鼠ACC对外周刺激与中枢刺激的反应增强[6];神经元的c-fos基因表达[7]、NK-1受体[8]、AMPA/Kainate受体[9]与痛觉有关。目前,PLP的发病机理尚不清楚。将小鼠尾末端截断常用于PLP产生机制的研究[4]。研究[8]表明,NK-1受体参与断尾引起小鼠ACC神经元c-fos基因表达显著增强的过程。但是,AMPA/Kainate受体是否参与此过程尚未见报道。因此,本研究采用免疫组化方法探讨PLP的产生机理,为治疗PLP提供实验依据。
1 材料与方法
1.1 实验分组
沈阳医学院实验动物中心提供雌性成年昆明种小鼠36只,体质量(27±6)g[动物生产许可证编号:SCXK(辽)2010-0001]。1%戊巴比妥钠40 mg·kg-1体质量腹腔麻醉小鼠,随机均分为6组,每组6只:空白对照组(不做任何处理);断尾(尾末端2.5 cm用剪刀截断)后0.5 h组;iv CNQX组(尾静脉注射1%CNQX 1 mg·kg-1体质量后10 min+断尾后0.5 h);iv NS组(尾静脉注射同体积生理盐水后10 min+断尾后0.5 h);ith CNQX组(蛛网膜下腔注射CNQX 10 μg·10 μL-1生理盐水后10 min+断尾后0.5 h);ith NS组(蛛网膜下腔注射同体积生理盐水后10 min+断尾后0.5 h)。
1.2 ACC c-fos基因表达的检测
断尾后0.5 h,将上述各组小鼠断头,取脑,置于4 ℃ 4%多聚甲醛中过夜固定。连续冠状面-20 ℃冰冻切片,厚度为15 μm,用免疫组化方法常规染片及洗片等,最后使用树胶封片。使用显微图像分析仪(×400放大倍数)检测切片ACCc-fos阳性细胞的积分光密度(integrated optical density,integrated OD)和面积百分比。
1.3 统计学分析
2 结果
2.1 iv CNQX对断尾诱发小鼠ACC神经元c-fos基因表达的影响
空白对照组正常小鼠ACC神经元有少量c-fos基因表达,而断尾后0.5 h小鼠ACC神经元c-fos基因表达显著增强,阳性细胞OD和面积百分比显著高于空白对照组(P< 0.01);iv CNQX拮抗断尾诱发的ACC神经元c-fos基因表达显著增强,阳性细胞OD和面积百分比与空白对照组比较无统计学差异(P>0.05),但显著低于断尾后0.5 h组(P< 0.01),而ivNS组断尾诱发的ACC神经元c-fos基因表达显著增强没有影响,阳性细胞OD和面积百分比显著高于空白对照组及iv CNQX组(P< 0.01),见表1,图1。
2.2 ith CNQX对断尾诱发小鼠ACC神经元c-fos基因表达的影响
表1 尾静脉或蛛网膜下腔注射CNQX对断尾诱发小鼠ACC神经元c-fos基因表达的影响Tab.1 Effect of iv or ith CNQX on tail amputation induced c-fos gene expression in the ACC neurons in mice
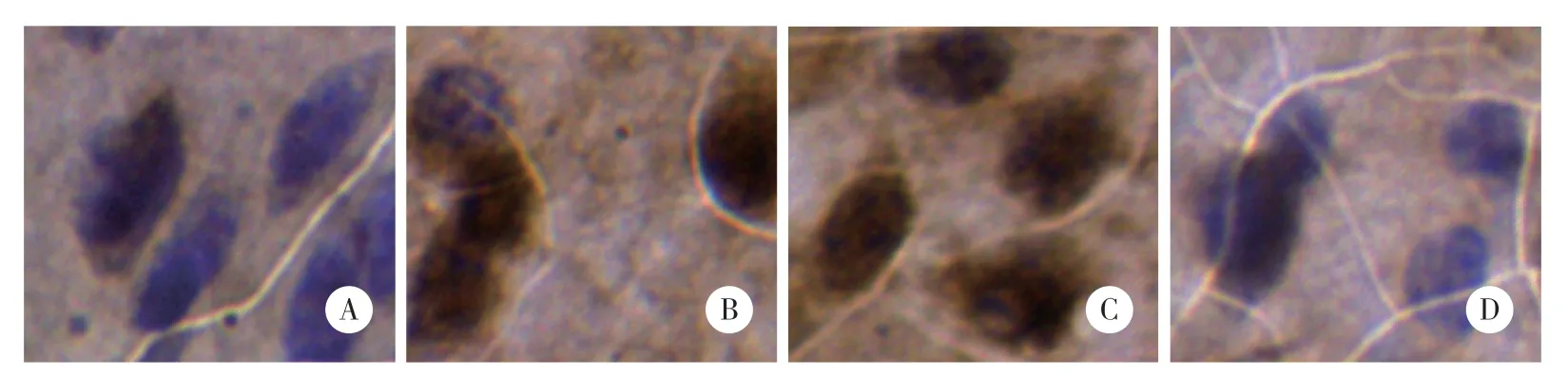
图1 iv CNQX对断尾诱发小鼠ACC神经元c-fos基因表达的影响 ×400Fig.1 Effect of iv CNQX on tail amputation induced c-fos gene expression in the ACC neurons in mice ×400
与空白对照组正常小鼠比较,断尾后0.5 h小鼠ACC神经元c-fos基因表达显著增强(P< 0.01);ith CNQX拮抗断尾诱发的ACC神经元c-fos基因表达显著增强,阳性细胞OD和面积百分比与空白对照组比较无统计学差异(P> 0.05),但是,显著低于断尾后0.5 h组(P< 0.01),而ith NS组对断尾诱发的ACC神经元c-fos基因表达显著增强没有影响,阳性细胞OD和面积百分比显著高于空白对照组及ith CNQX组(P<0.01),见表1,图2。
3 讨论
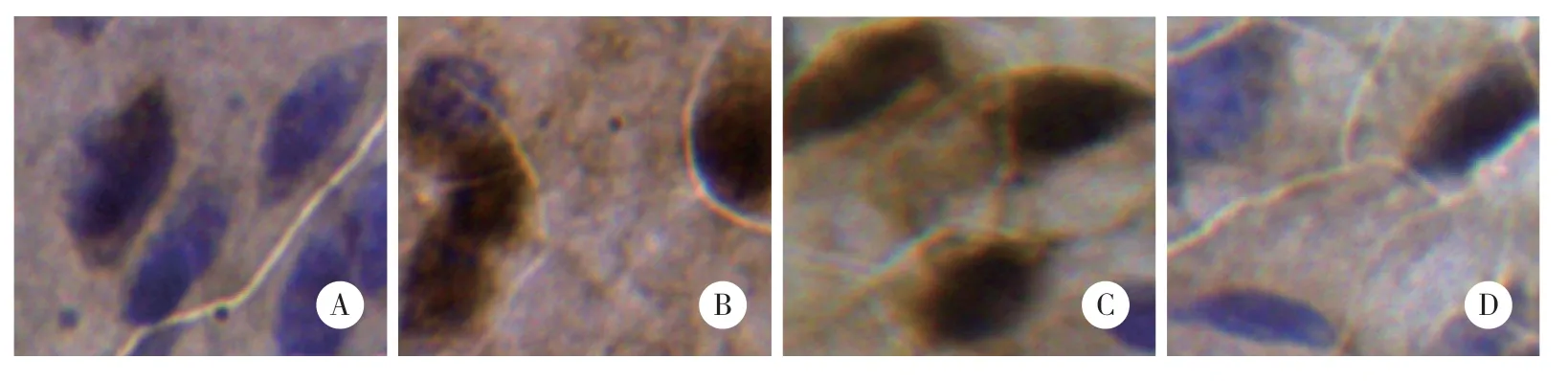
图2 Ith CNQX对断尾诱发小鼠ACC神经元c-fos基因表达的影响 ×400Fig.2 Effect of ith CNQX on tail amputation induced c-fos gene expression in the ACC neurons in mice ×400
c-fos基因及Fos蛋白在中枢神经系统表达的部位与伤害性信号的传导、整合分析有关[7-8];大鼠截肢后ACC对外周刺激与中枢刺激的反应增强[6]。本研究发现,断尾后0.5 h小鼠ACC神经元c-fos基因表达显著增强,表明小鼠ACC的神经元能接受伤害信号的传入,参与断尾产生的中枢神经系统的可塑性改变。本研究结果为深入研究PLP提供了新的实验依据。
PLP是截肢者术后常见的并发症。目前,PLP的发病机理尚不明确。NK-1受体、AMPA/Kainate受体与痛觉有关[8-9]。NK-1受体参与断尾引起小鼠ACC神经元c-fos基因表达显著增强的过程[8]。但是,AMPA/Kainate受体是否参与此过程尚未见报道。本研究观察到iv CNQX AMPA/Kainate受体拮抗剂拮抗断尾诱发的ACC神经元c-fos基因表达显著增强,说明外周AMPA/Kainate受体参与此过程。CNQX不易透过血脑屏障,因此本文深入研究了ith CNQX对断尾诱发的ACC神经元c-fos基因表达显著增强的影响。发现ith CNQX拮抗了断尾诱发的ACC神经元c-fos基因表达的显著增强,说明中枢AMPA/Kainate受体也参与了此过程,外周与中枢AMPA/Kainate受体可能作为镇痛药物治疗PLP的候选靶点。
