胞外信号调节激酶通路活化促进埃克替尼耐药的非小细胞肺癌侵袭和转移
2020-05-20杨旸王一喆郑春雷侯科佐王晓楠胡雪君
杨旸,王一喆,郑春雷,侯科佐,王晓楠,胡雪君
(中国医科大学附属第一医院 1.老年呼吸感染科;2.肿瘤内科,辽宁省抗肿瘤药物与生物治疗重点实验室,沈阳 110001)
肺癌的发病率和死亡率在我国乃至世界范围内均居恶性肿瘤之首,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)约占所有类型肺癌的85%。由于缺乏早期临床表现,40%的NSCLC发现时已经转移(Ⅳ期),晚期NSCLC是癌症相关死亡的主要原因。传统的以铂类为基础的治疗方案对NSCLC的疗效目前已达到平台期,随着对癌症相关基因及通路的进一步深入研究,表皮生长因子受体-酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitor,EGFR-TKI)成为晚期NSCLC的主要治疗手段。EGFR-TKI能够显著延长EGFR突变的NSCLC患者的无进展生存期,并改善患者生活质量。埃克替尼是口服选择性EGFR-TKI,是我国第一个拥有自主知识产权的EGFR-TKI,也是全球第3个上市的EGFR-TKI。2011年6月被美国食品药品监督管理局批准用于晚期NSCLC的治疗。在NSCLC的治疗中,埃克替尼发挥了良好的抗肿瘤作用[1],尤其对晚期NSCLC复发的疗效良好。目前,埃克替尼已成为中国治疗晚期NSCLC的标准药物之一[2]。
虽然EGFR-TKI在NSCLC中疗效显著,但接受靶向治疗的患者经过10~14个月无进展生存期后大多数还是会出现耐药和肿瘤复发。因此,深入探讨EGFR-TKI耐药肺癌细胞的生物学特性,对于理解耐药机制及探索新的耐药逆转策略具有重要意义。研究报道,化疗药物和TKI等靶向药物耐药后,肿瘤细胞的转移能力增强[3-4],其机制与上皮间质转化(epithelial-mesenchymal transition,EMT)表型和细胞干性增强相关[5]。然而,埃克替尼耐药细胞的转移能力是否增强以及其促转移机制目前尚不十分明确。研究[6-9]表明,在TKI耐药的NSCLC、慢性粒细胞白血病和黑色素瘤中均存在胞外信号调节激酶(extracellular signal-regulated kinase,ERK)通路持续活化。在EGFR-TKI耐药的NSCLC细胞中,抑制ERK通路可以有效逆转耐药[6]。然而,关于ERK通路是否促进埃克替尼耐药的肺癌细胞转移的研究甚少。本研究探讨了NSCLC中ERK通路活化对埃克替尼耐药细胞迁移和侵袭能力的影响,旨在为逆转EGFRTKI耐药提供新的可能途径。
1 材料与方法
1.1 试剂
埃克替尼由浙江贝达药业提供,PD98059、EGFR、phosph-EGFR、ERK、phosph-ERK抗体购自美国Cell Signaling Technology公司,RPMI 1640培养基购自美国Gibco公司,β-actin抗体购自美国Santa Cruz公司。
1.2 细胞培养与耐药细胞系建立
人肺腺癌细胞株PC9和PC9/IcoR培养于含10%胎牛血清(以色列Biological Industries公司)、1%青霉素和链霉素的RPMI 1640培养基,培养箱条件为5%CO2、37 ℃恒温。PC9细胞株购自中科院上海细胞库。耐药细胞株PC9/IcoR的获得:使PC9细胞株持续暴露于初始浓度为0.05 μmol/L的埃克替尼中,逐渐增加药物浓度,直到药物浓度达到10 μmol/L,筛选此时稳定存活的细胞。PC9和PC9/IcoR细胞株每2~3 d传代1次,取对数生长期细胞用于后续实验。
1.3 MTT检测细胞增殖能力
采用MTT比色法测定埃克替尼对细胞活力的影响,将PC9和PC9/IcoR细胞以3 000/孔的密度接种于96孔板,培养至细胞贴壁后加入不同浓度(0、0.1、1、10和20 μmol/L)的埃克替尼继续培养96 h。检测ERK通路对PC9/IcoR细胞活力的影响,分别用不同浓度(0、10、20和40 μmol/L)的ERK通路抑制剂PD98059(PD98059组)以及上述浓度的PD98059与10 μmol/L埃克替尼联合(两药联用组)作用细胞24 h,每个药物浓度设置4个复孔并设置对照孔。之后每孔加入20 μL MTT(5 g/L),继续培养4 h后吸弃上清,加入DMSO 200 μL/孔,震荡15~20 min。酶标仪检测570 nm波长的吸光度值,计算药物作用下的细胞活力。
1.4 Transwell迁移实验检测细胞迁移能力
采用孔径为8 μm的Transwell小室和配套的24孔板。将对数生长期的PC9和PC9/IcoR细胞消化并用PBS清洗后,用无血清培养基悬浮细胞,调整细胞浓度,制备上室细胞悬液200 μL(3.0×104个细胞),下室加入2.5%血清的培养基500μ L。检测ERK通路对PC9/IcoR细胞迁移能力的影响,分别用10 μmol/L的埃克替尼(埃克替尼组)、20 μmol/L的PD98059(PD98059组)和两药联合(两药联用组)预处理细胞4 h,并设置对照组。分别于上室和下室加入相应浓度的药物,常规培养24 h后,弃去小室中培养液清洗并风干,瑞氏-吉姆萨染色法染色固定。显微镜下观察拍照,每个小室随机选取3个视野计数,每个实验至少重复3次。
1.5 基质胶侵袭实验检测细胞侵袭能力
将基质胶与RPMI 1640培养基以1 ∶30比例稀释后,铺于小室中,置于37 ℃培养箱中30~40 min使其凝固。将PC9和PC9/IcoR细胞胰蛋白酶消化并用PBS洗涤后,以3.0×104/孔接种于Transwell小室的上室,终体积200 μL。下室加入含2.5%血清的RPMI 1640培养液,终体积500 μL。检测ERK通路对PC9/IcoR细胞侵袭能力的影响,分别用10 μmol/L的埃克替尼(埃克替尼组)、20 μmol/L的PD98059(PD98059组)和两药联合(两药联用组)预处理细胞4 h,并设置对照组。分别于上室和下室加入相应浓度的药物,24孔板于培养箱中培养24 h,清洗风干后用瑞氏-吉姆萨染色法染色固定45 min~1 h。再次清洗晾干后于显微镜下观察,每个小室随机选取3个视野拍照、计数。
1.6 Western blotting检测细胞蛋白表达
将PC9和PC9/IcoR细胞冰上裂解,裂解后的细胞悬液于4 ℃超声离心后取上清,BCA法测定蛋白浓度。检测ERK通路对PC9/IcoR细胞蛋白表达的影响,分别用10 μmol/L的埃克替尼(埃克替尼组)、20 μmol/L的PD98059(PD98059组)和两药联合(两药联用组)作用细胞24 h再收集细胞蛋白,并设置对照组。定量后取20~40 μg蛋白在聚丙烯酰胺凝胶上进行电泳,并湿法转印到PVDF膜上。室温下5%脱脂牛奶封闭PVDF膜1 h,加入相应的一抗于4 ℃过夜。1×PBS清洗一抗4次后,加入二抗室温封闭30~40 min,再用PBS清洗4次并显像分析。
1.7 统计学分析
采用SPSS 16.0软件进行数据分析。数据均为3次独立实验结果,用表示,2组间比较采用t检验,P< 0.05为差异有统计学意义。
2 结果
2.1 埃克替尼对细胞增殖能力的影响
MTT实验验证埃克替尼对PC9和PC9/IcoR细胞的增殖抑制作用。结果显示,埃克替尼作用96 h后,不同浓度(0.1、1、10、20 μmol/L)的埃克替尼均对PC9细胞产生增殖抑制作用,且增殖抑制作用随着埃克替尼浓度的增加而增加,与PC9/IcoR细胞比较差异有统计学意义(均P< 0.05),而在埃克替尼作用下PC9/IcoR细胞的增殖未受到明显抑制。见图1。结果提示,PC9/IcoR细胞具有较强且较稳定的埃克替尼耐药特性。

图1 埃克替尼对PC9和PC9/IcoR细胞增殖能力的影响Fig.1 Effect of icotinib on the proliferation of PC9 and PC9/IcoR cells
2.2 PC9和PC9/IcoR细胞迁移和侵袭能力的比较
Transwell小室法检测PC9和PC9/IcoR细胞的迁移和侵袭能力。结果显示,24 h后穿过小室和基质胶的PC9/IcoR细胞数量明显多于PC9细胞(24 h PC9与PC9/IcoR细胞的增殖能力并无明显差异),差异有统计学意义(P< 0.05)。结果提示,与亲本细胞PC9相比,耐药细胞PC9/IcoR具有更强的迁移和侵袭能力。见图2。
2.3 PC9和PC9/IcoR细胞中蛋白的表达情况

图2 PC9和PC9/IcoR细胞迁移和侵袭能力的比较Fig.2 Comparison of the migration and invasion abilities between PC9 and PC9/IcoR cells
Western blotting检测PC9和PC9/IcoR细胞中ERK、phosph-ERK、EGFR、phosph-EGFR蛋白的表达水平。PC9细胞虽然均有一定程度的EGFR和ERK磷酸化(phosph-EGFR、phosph-ERK),但是PC9/IcoR细胞中phosph-EGFR和phosph-ERK水平明显升高。见图3。由此可见,ERK通路活化可能与耐药细胞侵袭和转移能力增强相关。
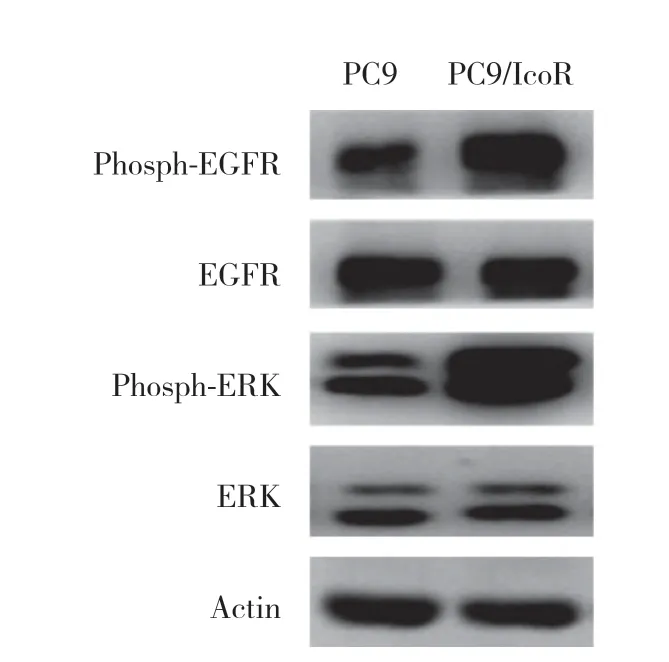
图3 PC9和PC9/IcoR细胞的蛋白表达Fig.3 The expression of proteins in PC9 and PC9/IcoR cells
2.4 PD98059对PC9/IcoR细胞增殖能力和ERK通路的影响
Western blotting结果显示,PD98059组phosph-ERK蛋白表达水平明显降低,两药联用组phosph-ERK蛋白下调最明显(P< 0.05,图4A)。MTT结果显示,无论在何种药物浓度作用下,PD98059组和两药联用组细胞增殖能力均无明显下降(P> 0.05,图4B)。结果提示,ERK通路对PC9/IcoR细胞增殖无影响。
2.5 抑制ERK通路对PC9/IcoR细胞迁移和侵袭能力的影响
与对照组相比,埃克替尼组穿过小室及基质胶的细胞数量未见明显变化,结果均无统计学差异(P>0.05);PD98059组迁移和侵袭的细胞数量明显减少,差异均有统计学意义(P< 0.05);两药联用组细胞迁移和侵袭能力被抑制最为明显,差异均有统计学意义(P< 0.05)。结果提示,ERK通路活化促进PC9/IcoR细胞的迁移和侵袭。见图5。

图4 抑制ERK对PC9/IcoR细胞增殖和蛋白表达的影响Fig.4 Effect of ERK inhibition on the proliferation and protein expression of PC9/IcoR cells
3 讨论
虽然EGFR-TKI可以明显提高EGFR突变的NSCLC患者的生存率,耐药仍然是治疗中的主要障碍。常见的耐药机制包括T790M突变、MET扩增、胰岛素样生长因子1受体通路激活等。现有研究[10]显示,EGFR-TKI耐药的肺腺癌细胞除对TKI的敏感性降低之外,还获得了更强的侵袭和迁移能力。进一步的机制研究表明,EMT、EGF通路激活和MET扩增均促进了EGFR-TKI耐药NSCLC的迁移和侵袭。本研究结果与既往研究一致,与PC9细胞系相比,PC9/IcoR耐药细胞系迁移和侵袭能力明显增强,提示肿瘤细胞的迁移和侵袭是埃克替尼耐药的特征之一。
ERK通路是调节细胞增殖、存活、分化和运动的主要微环境调节级联信号通路之一,在人类肿瘤中常被激活。在某些情况下,ERK通路活化可以刺激正常组织细胞的增殖和运动失控进而向恶性转化。目前已有多项研究报道,在TKI耐药的肿瘤细胞中存在ERK通路的持续活化。HANLY等[11]的研究表明,维罗非尼耐药的甲状腺乳头状癌细胞中ERK过度活化。伊马替尼耐药的慢性粒细胞白血病中存在ERK通路持续活化,吉非替尼耐药的NSCLC中ERK通路过度活化[12]。JANMAAT等[13]报道了吉非替尼耐药的NSCLC细胞系中存在EGFR非依赖性Ras/ERK通路持续活化。本研究结果显示,PC9/IcoR耐药细胞中ERK磷酸化水平明显高于PC9细胞,提示耐药细胞中ERK通路活化程度更高,与上述研究结果一致。
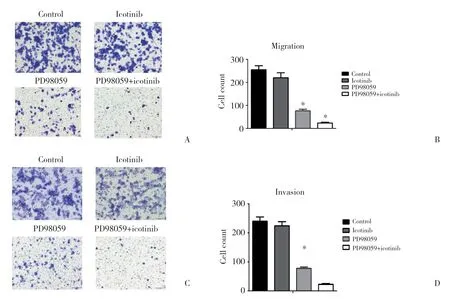
图5 抑制ERK对PC9/IcoR细胞迁移和侵袭的影响Fig.5 Effect of ERK inhibition on the migration and invasion abilities of PC9/IcoR cells
除在TKI耐药的肿瘤中持续活化外,ERK通路还可以调控肿瘤的转移。研究[14]显示,ERK通路的激活在乳腺癌细胞的侵袭和转移中发挥重要作用。在胃癌中抑制MAPK/ERK信号通路可以阻止肿瘤细胞的迁移和侵袭[15]。2017年的一项研究[16]表明,在PD-L1/BAG-1高表达的NSCLC患者中,联合应用TKI与ERK抑制剂可以克服PD-L1介导的肿瘤侵袭和TKI抗性。由于在PC9/IcoR耐药细胞系中ERK活化与细胞迁移和侵袭能力增强变化趋势一致,本研究采用PD98059作用于PC9/IcoR细胞后,观察细胞迁移和侵袭能力的变化,进一步探究两者之间是否存在关联。结果显示,在不影响细胞增殖情况下,ERK活性被抑制后,PC9/IcoR细胞迁移和侵袭能力明显下降,当PD98059与埃克替尼联用时,细胞迁移和侵袭能力被抑制最明显。由此可见,在埃克替尼耐药的NSCLC中,ERK通路活化促进耐药细胞的迁移和侵袭。
综上所述,本研究明确了ERK通路活化与EGFR-TKI耐药细胞迁移和侵袭之间的关联。研究结果提示,在EGFR-TKI耐药的NSCLC中,抑制ERK通路可以抑制肿瘤的侵袭和转移,也为逆转TKI耐药提供新的思路,可在临床治疗中试验性应用。
