转染三磷酸腺苷酶家族蛋白2 shRNA的人骨肉瘤细胞株U2-OS增殖、凋亡能力观察
2020-05-20于云祥龚泰芳刘小涛柯文李彬彬
于云祥,龚泰芳,刘小涛,柯文,李彬彬
十堰市太和医院,湖北十堰 442000
成骨肉瘤简称为骨肉瘤,典型的骨肉瘤起源于骨内,骨肉瘤具有恶性程度高、易复发等特点,研究骨肉瘤细胞生长机制对于骨肉瘤的治疗具有重要意义[1]。肿瘤细胞恶性增殖与细胞周期紊乱和凋亡减少有关,而肿瘤细胞生长、凋亡和周期受到细胞内癌基因和抑癌基因的调控作用[2]。三磷酸腺苷酶家族蛋白2(ATAD2)具有ATP结合位点和溴区功能结构域,参与调控下游基因的转录和表达,是一种重要的细胞周期、生长和信号转导调控因子[3]。ATAD2在胶质瘤、胆管癌、膀胱癌等多种肿瘤组织或细胞中表达上调,参与调控肿瘤细胞的增殖、迁移和侵袭等生物学行为,与肿瘤复发转移及预后不良密切相关[4~6]。近年研究[7]显示,ATAD2在骨肉瘤组织中高表达,而对于其在骨肉瘤细胞生长中的作用尚不明确。2018年6月~2019年10月,我们观察了转染ATAD2 shRNA慢病毒载体对人骨肉瘤细胞生长、细胞周期和凋亡的作用,以期为研究骨肉瘤细胞恶性表型分子发生机制提供参考。
1 材料与方法
1.1 细胞、质粒及主要试剂 人骨肉瘤细胞株U2-OS、MG-63、SaOS-2购自上海名劲生物科技有限公司,人正常成骨细胞h FOB1.19购自武汉普诺赛生命科技有限公司。ATAD2 shRNA慢病毒载体和阴性对照慢病毒载体购自吉满生物科技(上海)有限公司。剪切的含半胱氨酸的天冬氨酸蛋白水解酶3(C-Caspase-3)抗体、ATAD2抗体购自美国Abcam公司;细胞周期依赖性蛋白激酶2(CDK2)抗体、细胞周期蛋白D1(CyclinD1)抗体、剪切的含半胱氨酸的天冬氨酸蛋白水解酶9(C-Caspase-9)抗体购自北京百奥莱博科技有限公司;引物由金斯瑞生物科技有限公司合成。
1.2 骨肉瘤细胞株的选择 采用定量即时聚合酶链锁反应法(qRT-PCR法)和蛋白质免疫印迹(Western blotting)检测U2-OS、MG-63、SaOS-2、h FOB1.19细胞中ATAD2 mRNA、蛋白。U2-OS、MG-63、SaOS-2、h FOB1.19细胞中ATAD2 mRNA分别为2.98±0.30、1.75±0.16、2.14±0.25、1.00±0.11,ATAD2蛋白分别为0.36±0.04、0.22±0.04、0.28±0.02、0.13±0.02,U2-OS、MG-63、SaOS-2细胞与h FOB1.19细胞比较,U2-OS细胞与MG-63、SaOS-2细胞比较,P均<0.05。根据以上结果,选择U2-OS细胞作为本研究的实验细胞。
1.3 U2-OS细胞ATAD2 shRNA慢病毒载体转染 将U2-OS细胞分为3组,U2-OS-shATAD2、U2-OS-shNC组分别转染ATAD2 shRNA慢病毒载体、阴性对照慢病毒载体,U2-OS-wt组为没有转染慢病毒载体的U2-OS细胞。慢病毒转染步骤:将细胞种植到24孔板中,细胞密度为40%时将上清吸除,添加感染复数(MOI)=20的慢病毒液,培养24 h后换液,荧光显微镜下观察转染效率高于90%可用于后续实验。转染后24 h,采用qRT-PCR法和Western blotting法检测细胞中ATAD2 mRNA、蛋白。取转染后24 h的U2-OS-wt、U2-OS-shNC、U2-OS-shATAD2细胞用于后续实验。
1.4 转染ATAD2 shRNA慢病毒载体的U2-OS细胞增殖能力观察 以细胞存活率和克隆形成数目表示细胞增殖能力。①细胞存活率:采用CCK8法。U2-OS-wt、U2-OS-shNC、U2-OS-shATAD2组细胞按照每孔3 000个细胞种植到96孔板中,在培养48 h以后,在每孔中添加10 μL的CCK8反应液,放在37 ℃,5%CO2培养箱中培养1 h。检测450 nm的吸光度值(A值),并用空白孔调零,结果以细胞存活率表示。U2-OS-shNC、U2-OS-shATAD2组细胞存活率=(U2-OS-shNC/U2-OS-shATAD2组A值÷U2-OS-wt组A值)×100%。②细胞克隆形成数目:采用平板克隆实验。用胰蛋白酶消化U2-OS-wt、U2-OS-shNC、U2-OS-shATAD2组细胞,离心后收集细胞沉淀,进行细胞计数。将单细胞接种到培养皿内,每个培养皿中接种300个细胞,放在37 ℃培养箱中培养,每隔2 d换液1次,14 d后出现肉眼可见的细胞克隆,添加磷酸缓冲盐溶液(PBS),将细胞洗涤2次,用4%的多聚甲醛在室温中孵育20 min,添加瑞姬氏复合染料,放在室温中孵育8 min,经清水冲洗以后,将≥50个细胞克隆团记为1个细胞克隆,观察计数各组细胞克隆形成数目,结果以细胞克隆形成数目表示。
1.5 转染ATAD2 shRNA慢病毒载体的U2-OS细胞凋亡能力观察 以细胞周期和凋亡率表示细胞凋亡能力。①细胞周期:采用碘化丙啶(PI)单染法。U2-OS-wt、U2-OS-shNC、U2-OS-shATAD2组细胞接种到6孔板中,细胞密度为80%时,用胰蛋白酶消化各组细胞,离心后收集细胞沉淀,用预冷后的乙醇(75%)将细胞悬浮以后,放在4 ℃孵育2 h。将固定好的细胞在室温1 000 g离心10 min以后,PBS洗涤,添加500 μL的染色缓冲液,再添加25 μL的PI染液,放在37 ℃孵育30 min,置于低温避光处保存,用流式细胞仪检测细胞周期变化,结果以G1、S、G2期细胞所占百分比表示。②细胞凋亡率:采用膜联蛋白 V-FITC(Annexin V-FITC)/PI双染法。U2-OS-wt、U2-OS-shNC、U2-OS-shATAD2组细胞接种到6孔板中,细胞密度为80%时,用胰蛋白酶消化各组细胞,离心后收集细胞沉淀,添加500 μL的结合缓冲液,添加Annexin V-FITC和PI染液各5 μL,用流式细胞仪检测细胞凋亡变化。结果以细胞凋亡率表示。
1.6 转染ATAD2 shRNA慢病毒载体的U2-OS细胞C-Caspase-3、C-Caspase-9、CDK2、CyclinD1蛋白检测 采用Western blotting法。U2-OS-wt、U2-OS-shNC、U2-OS-shATAD2组细胞接种到6孔板中,细胞密度为80%时,采用Western blotting法检测细胞中凋亡相关蛋白C-Caspase-3、C-Caspase-9和周期相关蛋白CDK2、CyclinD1。C-Caspase-3/C-Caspase-9/CDK2/CyclinD1蛋白相对表达量=C-Caspase-3/C-Caspase-9/CDK2/CyclinD1灰度值÷β-actin灰度值。
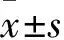
2 结果
2.1 各组U2-OS细胞ATAD2 mRNA、蛋白相对表达量比较 各组U2-OS细胞ATAD2 mRNA、蛋白相对表达量比较见表1。

表1 各组U2-OS细胞ATAD2 mRNA、蛋白相对表达量比较
注:与U2-OS-shNC、U2-OS-wt组比较,*P<0.05。
2.2 各组U2-OS细胞存活率和细胞克隆形成数目比较 各组U2-OS细胞存活率和细胞克隆形成数目比较见表2。

表2 各组U2-OS细胞存活率和克隆形成数目比较
注:与U2-OS-shNC、U2-OS-wt组比较,*P<0.05。
2.3 各组U2-OS细胞周期、凋亡率比较 各组U2-OS细胞周期、凋亡率比较见表3。
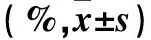
表3 各组U2-OS细胞周期、凋亡率比较
注:与U2-OS-shNC、U2-OS-wt组比较,*P<0.05。
2.4 各组U2-OS细胞凋亡相关蛋白C-Caspase-3、C-Caspase-9和周期相关蛋白CDK2、CyclinD1相对表达量比较 各组U2-OS细胞C-Caspase-3、C-Caspase-9、CDK2、CyclinD1蛋白相对表达量比较见表4。

表4 各组U2-OS细胞C-Caspase-3、C-Caspase-9、CDK2、CyclinD1蛋白相对表达量比较
注:与U2-OS-shNC、U2-OS-wt组比较,*P<0.05。
3 讨论
骨肉瘤是青少年中最常见的原发性恶性骨癌,骨肉瘤多发生于长管状骨的干骺端,如股骨远端、胫骨近端和肱骨近端,偶尔也发生在脊柱、骨盆和骶骨。多数患者为单发病灶,且发病初期无典型临床症状,常见症状主要是局部疼痛和肿胀,偶尔伴有关节功能障碍[8]。虽然手术切除和化疗等治疗手段的进步已使骨肉瘤患者的5年内的存活率在60%~70%,但仍然不能满足需求[9]。骨肉瘤细胞株MG-63、U2-OS、SaOS-2是常见的体外研究骨肉瘤的细胞模型[10]。我们的实验探讨了ATAD2在骨肉瘤细胞株MG-63、U2-OS、SaOS-2和人正常成骨细胞h FOB1.19中的表达化,选取了表达水平最高的U2-OS细胞作为实验对象,以更为直观的观察ATAD2在骨肉瘤细胞增殖、克隆、周期和凋亡中的作用。
ATAD2基因编码的蛋白质中含有ATP酶、溴结构域,参与调控下游靶基因的转录和表达,ATAD2在睾丸组织中高表达,而在其他正常组织中的表达水平极低,ATAD2参与细胞生长分化和组织发育[11]。ATAD2在胰腺癌、宫颈癌等组织中表达上调,其在肿瘤发生中扮演癌基因的作用,下调ATAD2抑制肿瘤细胞体外增殖和克隆形成能力,抑制肿瘤生长[11~13]。之前的研究[7]报道显示,ATAD2在骨肉瘤组织样本中表达升高,ATAD2可能是骨肉瘤发生和发展的促进因子。本文结果显示,转染ATAD2 shRNA慢病毒载体后的骨肉瘤细胞体外增殖和克隆形成能力均下降,这与上述实验报道结果一致,均说明ATAD2在骨肉瘤中发挥癌基因的作用。
细胞周期调控因子主要有Cyclins、CDK等,其中CDK是细胞周期调控网络的核心,Cyclins能够正调控CDK,Cyclin D1是一种原癌基因,主要作用于G1期向S期转换[14~16]。CDK2是细胞周期中重要的正调控因子,其可以促进细胞周期有序进展[17]。目前研究显示,ATAD2具有调控细胞周期影响细胞生长作用,转染ATAD2能够有效提高胃癌细胞、宫颈癌细胞等多种细胞G1期比例,下调细胞中Cyclin D1蛋白表达,阻碍细胞从G1期向S期发展[13,18]。Caspase-3是细胞凋亡的执行因子,其活化后能够促进细胞发生不可逆的凋亡反应,Caspase-9是Caspase凋亡反应的上游启动因子,其活化后能够迅速激活Caspase级联反应[19,20]。Shin等[21]发现,在肺癌细胞中,转染ATAD2表达可激活肺癌细胞中Caspase级联反应,诱导肺癌细胞凋亡。本研究显示,转染ATAD2 shRNA慢病毒载体后的骨肉瘤细胞G1期比例升高,细胞中Cyclin D1、CDK2蛋白表达水平降低,提示转染ATAD2 shRNA慢病毒载体能够下调细胞周期正调控因子Cyclin D1、CDK2的表达将骨肉瘤细胞周期阻滞在G1期,这证实了ATAD2在骨肉瘤细胞周期中的作用,说明下调其表达能够阻滞细胞周期进程,这与在胃癌等肿瘤中的研究结果一致[13,18]。本实验还表明,转染ATAD2 shRNA慢病毒载体后的骨肉瘤细胞凋亡率升高,细胞中活化的Caspase-3和Caspase-9蛋白表达水平也升高,说明转染ATAD2 shRNA慢病毒载体具有诱导骨肉瘤细胞凋亡的作用。
总之,ATAD2在骨肉瘤细胞中高表达,转染ATAD2 shRNA慢病毒载体能够通过阻滞细胞周期、诱导细胞凋亡,发挥抑制骨肉瘤细胞生长的作用,但目前对于ATAD2具体的靶向调控作用尚不清楚。
