高剂量异丙酚腹腔注射对阿尔茨海默病模型大鼠学习记忆能力的改善作用及其机制
2020-05-20宋云飞
宋云飞
辽宁中医药大学附属医院,沈阳110032
阿尔茨海默病(AD)是好发于65岁以上老年人的神经退行性疾病之一,又名老年痴呆症。随着人口的老龄化,AD的发病率呈逐年上升的趋势。目前对AD的发病机制较为公认的是β-淀粉样蛋白(Aβ蛋白)脑内沉积引起神经元丢失及神经激素调节、氧化损伤和胆碱能不足等病理过程有关[1~3]。目前治疗AD比较有效的药物有乙酰胆碱酯酶抑制剂(AchE,如多奈哌齐、石杉碱甲等)[4]、NMDA受体拮抗剂(如美金刚等)[5],但这些药物只能改善轻至中度AD患者的症状,且不良反应较多,因此开发一种治疗AD安全有效的药物尤为重要。异丙酚(PPF)是临床上用于静脉全麻常用药物之一,具有醒脑快、持续输注、无蓄积等优点。近年来研究[6]发现,PPF对大脑、肾脏及肝脏等器官具有较好的保护作用。赵冬梅等[7]发现,PPF预处理能改善AD模型大鼠的学习记忆能力,减少细胞凋亡,发挥脑保护作用。倪天辉等[8]也报道PPF预处理能增强胆碱能神经元表达,达到脑保护目的。然而,PPF是否通过抗炎作用来改善AD大鼠的学习与记忆能力尚不清楚。2019年6月3日~2019年12月5日,本研究用腹腔注射D-半乳糖(D-gal)联合灌胃三氯化铝(AlCl3)制备AD模型大鼠,观察高剂量PPF对AD模型大鼠学习记忆能力的改善作用,并探讨其机制。
1 材料与方法
1.1 大鼠、试剂和仪器 SPF级SD大鼠购自辽宁长生生物技术有限公司,合格证号:SCXK(辽)2010-001。雌雄不限,体质量(200±20)g。所有大鼠被安置在一个符合SPF级标准的动物房间里,温度18~24 ℃,相对湿度55%~65%,12小时亮/暗循环,每笼4只大鼠,可自由取用食物和水。所有本研究中使用的实验方案均得到了实验动物福利伦理委员会的批准。异丙酚(PPF)购自Sigma公司,生理盐水购自沈阳志鹰制药厂,D-gal购自Reanta Scientific Technology company,AlCl3购自国药集团化学试剂有限公司,盐酸多奈哌齐片购自卫材药业有限公司,IL-1β、IL-6和TNF-α ELISA试剂盒购自上海酶联生物科技有限公司,AchE试剂盒购自南京建成生物工程研究所,兔抗Aβ、磷酸化NF-κB(p-NF-κB)和GAPDH抗体购自北京博奥森生物技术有限公司,辣根过氧化物酶标记驴抗兔IgG购自北京鼎国昌盛生物技术有限责任公司,蛋白提取试剂盒购自江苏凯基生物技术股份有限公司,BCA蛋白浓度测定试剂盒和SDS-PAGE蛋白上样缓冲液购自碧云天生物技术研究所。Morris 水迷宫MT-200购自成都泰盟科技公司,超低温冰箱购自青岛海尔集团,WB电泳仪和转膜仪购自Bio-Rad生命医学产品有限公司,多功能酶标仪购自南京德铁实验设备有限公司。
1.2 AD模型的制备、分组及PPF给予方法 SD大鼠每日1次腹腔注射D-gal,剂量为60 mg/kg,同时每日1次灌胃AlCl3,剂量为40 mg/kg,连续给药60 d,建立大鼠AD模型[9]。将造模成功的大鼠随机分为4组,即模型组、多奈哌齐组、PPF低剂量组、PPF高剂量组,每组6只。多奈哌齐组腹腔注射1.5 mg/kg的多奈哌齐,PPF低剂量组腹腔注射50 mg/kg的PPF,PPF高剂量组腹腔注射100 mg/kg的PPF,模型组腹腔注射等体积生理盐水,每日1次,连续给药30天。各组大鼠腹腔注射药物或生理盐水的同时,继续按照造模要求每日进行D-gal腹腔注射和AlCl3灌胃。另选取6只正常SD大鼠,记为空白对照组。
1.3 各组大鼠学习记忆能力评估 采用Morris水迷宫实验,包括定位航行实验、空间探索实验。①定位航行实验。将大鼠由平台所在象限的对侧且头朝池壁放入水中,记录大鼠找到且爬上平台所需的时间,即为大鼠的逃避潜伏期;观察大鼠逃避潜伏期的运动轨迹,采用MT-200 Morris水迷宫视频分析系统自动采集并导出运动轨迹图像。若逃避潜伏期超过60 s,则引导大鼠爬上平台并停留10 s,并将其逃避潜伏期记录为60 s。定位航行实验共进行5天,以第5天的实验数据为本研究的最终数据。②空间探索实验。定位航行实验结束后,撤除平台,按定位航行实验方法将大鼠放入水中,记录大鼠60 s内穿越平台次数和在原平台所在象限停留时间。
1.4 各组大鼠海马组织中Aβ和p-NF-κB蛋白检测 采用Western blotting法。Morris水迷宫实验结束后,断头处死大鼠,分离大鼠双侧海马组织放入玻璃匀浆器中匀浆,加入蛋白裂解液和终浓度为1 mmol/L的PMSF在冰上裂解30 min,然后将液体转移至EP管中,4 ℃条件下离心,取少量上清液用BCA试剂盒进行蛋白定量并调整至等浓度,用等体积的蛋白上样缓冲液稀释,SDS-PAGE电泳分离,转移到0.22 μm PVDF膜,用5%脱脂奶粉室温封闭1 h,加入1∶500稀释的Aβ、p-NF-κB和GAPDH一抗4 ℃孵育过夜,TBST洗膜3次后,加入二抗至摇床上室温孵育1 h,ECL发光后胶片暗室曝光显影,用Image J软件对图像进行分析,以目的蛋白与内参蛋白GAPDH的光密度比值表示海马组织中目的蛋白的相对表达量。
1.5 各组大鼠海马组织中AchE活力检测 采用比色法。取大鼠海马组织用预冷的生理盐水制成10%组织匀浆,按照AchE测试盒说明书要求,检测大鼠海马组织中AchE活力。
1.6 各组大鼠海马组织中IL-1β、IL-6和TNF-α蛋白检测 采用ELISA法。取大鼠海马组织,严格按照ELISA试剂盒说明书所示步骤检测各组大鼠海马组织中IL-1β、IL-6和TNF-α蛋白水平。
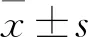
2 结果
2.1 各组大鼠学习记忆能力比较 各组大鼠学习记忆能力比较见表1。大鼠逃避潜伏期典型游动轨迹见图1。

表1 各组大鼠学习记忆能力比较
注:与空白对照组相比,aP<0.05;与模型组相比,bP<0.05;与多奈哌齐组相比,cP<0.05;与PPF低剂量组相比,dP<0.05。

图1 大鼠逃避潜伏期典型游动轨迹
2.2 各组大鼠海马组织中Aβ蛋白相对表达量、AchE活力比较 各组大鼠海马组织中Aβ蛋白相对表达量、AchE活力比较见表2。
2.3 各组大鼠海马组织中p-NF-κB蛋白相对表达量和IL-1β、IL-6、TNF-α蛋白表达水平比较 各组大鼠海马组织中p-NF-κB蛋白相对表达量和IL-1β、IL-6、TNF-α蛋白表达水平比较见表3。

表2 各组大鼠海马组织中Aβ蛋白相对表达量、AchE活力比较
注:与空白对照组相比,aP<0.05;与模型组相比,bP<0.05;与多奈哌齐组相比,cP<0.05;与PPF低剂量组相比,dP<0.05。

表3 各组大鼠海马组织中p-NF-κB蛋白相对表达量和IL-1β、IL-6、TNF-α蛋白表达水平比较
注:与空白对照组相比,aP<0.05;与模型组相比,bP<0.05;与多奈哌齐组相比,cP<0.05;与PPF低剂量组相比,dP<0.05。
3 讨论
AD是一种病因复杂且呈进行性发展的神经退行性疾病,在全球人口老龄化的趋势下,AD发病率逐年上升。关于AD的发病机制,学者们提出了多种假说,包括胆碱能假说、淀粉样蛋白假说、基因突变假说、炎症免疫假说等。基于上述假说,学者们建立了开展AD研究的多种动物模型。研究[10]显示,D-gal可造成动物亚急性衰老,其代谢产物半乳糖醇在细胞内堆积可引起细胞代谢紊乱,致体内活性氧增多,可引起机体多器官、多系统功能衰退,与人体老龄变化非常相似。此外,D-gal还能引起脑内神经元数目减少、脑组织中炎症因子释放增多等变化,而这些变化与AD患者脑内的病理变化十分类似。不同研究者使用的D-gal剂量为60~180 mg/kg,给药时间从6周到3个月不等。本研究中采用的是60 mg/kg、连续给药90天的方法。此外,早在1990年即有研究[11]报道AD患者脑组织中铝的含量明显升高,其含量超过4 mg/g时即可引起神经细胞变性,后续的研究也证实了这一点。有学者将两种药物联合给予动物,结果动物相继出现与AD密切相关的症状及病理改变,如学习障碍、AchE活性的增强、老年斑的沉积等,故本研究中采用D-gal联合AlCl3同时给予大鼠,结果表明,大鼠连续给予两种药物90天后,出现明显的学习记忆能力下降,其海马组织中Aβ蛋白表达增加。研究[12]发现,不断增多的Aβ蛋白可刺激正常脑组织产生炎症反应,释放IL-1β、IL-6和TNF-α等炎症因子,造成脑内炎症微环境。除此之外,研究[13]发现过度沉积的Aβ蛋白能够激活AchE的表达。AchE是胆碱能神经递质乙酰胆碱(Ach)的水解酶,直接参与大脑的思维和学习记忆等功能,当AchE活力升高时,能够导致Ach被大量破坏,从而降低学习记忆能力。我们的实验结果也证实了这一点,说明D-gal联合AlCl3可成功建立大鼠AD模型。本研究结果显示,给予腹腔注射低高剂量的PPF治疗的AD大鼠不仅能够缩短平均逃避潜伏期,还可延长其60 s内穿越平台的次数;此外,PPF还能显著抑制Aβ蛋白沉积,并且抑制由Aβ蛋白沉积所致的AchE过度活化;与低剂量PPF组相比,高剂量的PPF对AD大鼠学习记忆能力改善效果更佳,且抑制Aβ蛋白的过度沉积,减弱AchE的活力。不仅如此,我们采用了多奈哌齐作为阳性对照药来评价PPF的药效,结果发现高剂量PPF与多奈哌齐的治疗效果相当,无显著性差异。
在本研究中,我们还测定了海马组织中的炎症生物标志物IL-1β、IL-6、TNF-α、p-NF-κB的表达。众所周知,脑内炎症的发展也是AD等神经退行性疾病的一个显著病理特征。脑内炎症主要由于星形胶质细胞和小胶质细胞的活化。Aβ蛋白过度沉积会刺激细胞产生并释放多种促炎细胞因子,导致神经元受到损伤[14]。p-NF-κB蛋白本身在Aβ蛋白诱导的促炎细胞因子的产生和释放中起着关键作用,p-NF-κB发生核转移可引起炎症反应,包括微循环改变和炎性细胞(巨噬细胞和粒细胞)聚集。当巨噬细胞分泌炎性细胞因子,包括急性细胞因子(IL-1、IL-6和TNF-α)和慢性细胞因子(转化生长因子-β)时,炎症反应开始,这些细胞因子刺激内皮细胞和成纤维细胞等基质细胞释放的炎症介质,引起局部微血管扩张和毛细血管通透性增加,这反过来又通过释放趋化因子和表达细胞粘附分子促进炎症区域的白细胞聚集。本研究发现,模型组大鼠的海马组织内IL-1β、IL-6、TNF-α水平显著升高,NF-κB信号通路被激活产生p-NF-κB,导致p-NF-κB蛋白相对表达量显著升高;而低高剂量的PPF可降低IL-1β、IL-6、TNF-α水平,减轻p-NF-κB蛋白的相对表达量达到抑制炎症的作用。在此基础上,我们也比较了低高剂量PPF和阳性药物多奈哌齐的抑制炎症反应的效果,结果表明,与低剂量PPF组相比,高剂量的PPF和多奈哌齐对AD可抑制p-NF-κB蛋白相对表达量,降低IL-6、IL-1β、TNF-α的分泌;而高剂量PPF与多奈哌齐的抑制炎症反应的效果相当,无显著性差异。
综上所述,高剂量PPF腹腔注射可显著改善AD模型大鼠的学习记忆能力,其机制可能与抑制海马组织中Aβ蛋白沉积、增强胆碱能功能、抑制NF-κB蛋白磷酸化、减轻脑内炎症反应有关。其具体作用的分子机制尚未十分明确,需要进一步探讨研究。
