腹腔镜袖状胃切除对病态肥胖病人糖脂代谢的影响
2020-05-19张怀波马荣龙张德景
张怀波, 马荣龙, 张德景
(河南省濮阳市油田总医院普外三科,河南 濮阳 457001)
肥胖是临床常见代谢紊乱型疾病,病人往往合并高胰岛素血症、胰岛素抵抗及糖脂代谢紊乱等问题,是公认导致糖尿病的主要危险因素[1]。近年来随着经济发展、生活水平提高及饮食习惯改变,世界范围内肥胖病人数呈逐年增加趋势[2]。单纯饮食控制、运动干预甚至药物治疗往往难以有效控制体重在理想水平,这在病态肥胖人群中尤为明显[3]。近年来包括胃旁路手术、腹腔镜袖状胃切除术(laparoscopic sleeve gastrectomy,LSG)等减重手术已被证实可有效降低病态肥胖病人体重,预防或改善糖尿病病情,但对于该类手术在改善胰岛素抵抗和其他代谢紊乱方面是否具有效果仍存在争议[4]。本研究回顾性分析我院2012年1月至2017年6月收治病态肥胖病人共82例行LSG手术的临床资料,分析LSG手术对病态肥胖病人糖脂代谢指标的影响及相关作用机制,旨在探讨LSG手术是否可进一步增加病人在脂代谢紊乱、胰岛素敏感性及胰岛素分泌模式方面的临床获益,现报道如下。
资料与方法
一、临床资料
回顾性分析我院2012年1月至2017年6月收治行LSG手术病态肥胖病人共82例临床资料,其中合并 2型糖尿病 (type 2 diabetes mellitus,T2DM)25例,合并糖耐量异常30例,血糖和糖耐量正常27例,并选择同期体质量指数 (body mass index,BMI)正常健康人群 50例。 病人年龄 18~65岁;符合肥胖诊断,BMI≥30[5];合并 T2DM 病人病程<5年,仅接受口服降糖药物治疗,T2DM诊断依据美国糖尿病协会 (American Diabetes Association,ADA)标准[5];完成术后6个月随访。本研究不包括以下:①合并严重脏器功能不全;②酒精或药物依赖;③精神系统疾病;④智力障碍。
二、手术方法
使用超声刀或切割吻合器从距幽门上5 cm开始至左侧膈肌角,紧靠胃壁处游离、切断大网膜。必须充分游离胃大弯侧至左侧膈肌脚,以便完整切除胃底。拔除胃管并置入36F支撑胃管,前端沿胃小弯侧置入十二指肠。再用腹腔镜直线切割闭合器由胃大弯侧距幽门5 cm处开始,向胃底方向沿支撑胃管连续切割闭合。保证切割闭合过程中,支撑胃管可自由移动。胃底游离和切割过程中,注意保护脾门血管和脾完整性。完全切除后,切缘出血点以3-0可吸收线缝合加固。残胃腔内注入亚甲蓝溶液,检查有无渗漏。
三、观察指标
由专业医师行身高、体重及腰围测量。采用欧姆龙HBF-300型简易体脂测量仪检测体脂比例。均空腹10 h以上,清晨抽取静脉血4~5 mL检测糖脂代谢相关指标。其中空腹血糖 (fasting blood glucose,FBG)和餐后 2 h血糖 (2 h postprandial blood glucose,2 hPG)检测采用葡萄糖氧化酶法(罗氏ACCU-CHEK血糖仪);血清胰岛素检测采用电化学发光法 (ADVIA Centaur XP全自动化学发光分析仪);糖化血红蛋白A1c(hemoglobin glycosuria A1c,HbAlc)检测采用高压液相法;总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、低密度脂蛋白胆固醇 (low density lipoprotein-cholesterol,LDL-C)、 高密度脂蛋白胆固醇 (high density lipoprotein-cholesterol HDL-C)及尿酸(uric acid,UA)检测采用化学酶法(罗氏Cobas C300型全自动生化分析仪);肿瘤坏死因子 α(tumor necrosis factor α,TNF-α)检测采用化学发光法检测试剂盒。胰岛素抵抗的稳态模型评估(homeostasis model assessment of insulin resistance,HOMA-IR)计算公式为FBG×空腹胰岛素/22.5。多余体重减少率 (percentage of excess weight loss,EWL)计算公式为:[(术后体重-术前体重)/(术前 BMI-23)]×100。
四、统计学方法
结 果
一、术后减重效果比较
肥胖病人术后6个月BMI和腰围均显著低于术前(P<0.05);但肥胖病人术后6个月BMI和腰围仍显著高于体重正常者(P<0.05)。合并T2DM的肥胖病人术后EWL水平显著高于血糖和糖耐量正常的肥胖者(77.85 比 61.92,P<0.05)(见表 1)。
二、手术前后血糖指标水平比较
合并糖耐量异常和T2DM的肥胖病人术前血糖和HbAlc水平均显著高于体重正常者(P<0.05)。血糖和糖耐量正常的肥胖病人与体重正常者相比,以上指标比较差异无统计学意义(P>0.05)。肥胖病人术后6个月FBG、2 hPG及胰岛素水平均显著低于术前 (P<0.05)。肥胖病人术后6个月FBG和2 hPG水平与体重正常者比较,差异无统计学意义(P>0.05)。肥胖病人术后6个月HOMA-IR 水平显著低于术前(P<0.05);但组内比较差异无统计学意义(P>0.05)(见表 1)。
三、手术前后血脂指标、UA、TNF-α水平比较
肥胖病人术后6个月TG水平显著低于术前,而HDL-C水平显著高于术前(P<0.05)。肥胖病人所有LDL-C水平均显著高于体重正常者(P<0.05);但肥胖与体重正常者TG、HDL-C水平比较,差异无统计学意义(P>0.05)。同时肥胖病人术后6个月体脂比例显著低于术前(P<0.05)。肥胖病人术前UA和TNF-α水平均显著高于体重正常者(P<0.05);肥胖病人术后6个月时UA和TNF-α水平均显著低于术前(P<0.05)(见表 1)。
四、手术前、后胰岛素分泌状态比较
①血糖和糖耐量正常的肥胖病人术前血清胰岛素分泌节律正常,仅胰岛素水平过高。②合并糖耐量异常和T2DM的肥胖病人术前可见胰岛素分泌高峰移至餐后120 min。③肥胖病人术后6个月餐后120 min和180 min胰岛素水平均显著低于术前(P<0.05),且与体重正常者比较差异无统计学意义(P>0.05)。④肥胖病人餐后30 min和60 min胰岛素水平显著高于体重正常者(P<0.05)。⑤合并糖耐量异常和T2DM的病人术前胰岛素分泌高峰移至餐后 120 min,术后恢复至餐后60 min,胰岛素分泌节律基本正常(见表2)。
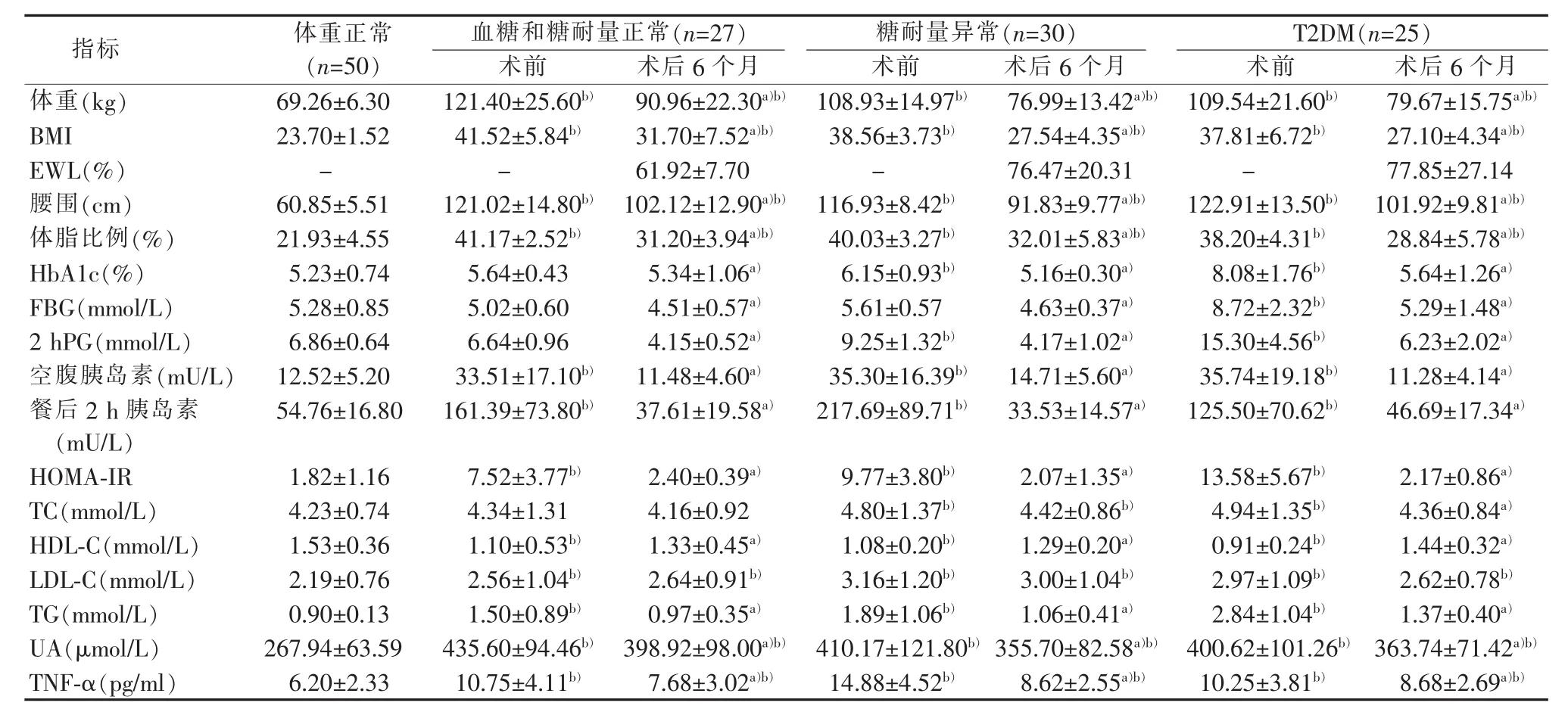
表1 3组围术期临床指标水平比较
五、HOMA-IR与相关代谢指标间相关性分析
术后6个月肥胖病人HOMA-IR与BMI、FBG及空腹胰岛素呈显著正相关 (P<0.05);HOMA-IR与HDL-C无相关性(P>0.05)。血糖和糖耐量正常的肥胖病人HOMA-IR与UA呈显著正相关(P<0.05),而与 TG 和 TNF-α 无相关性(P>0.05)。 合并糖耐量异常病人和T2DM肥胖病人HOMA-IR与TG、TNF-α 呈显著正相关(P<0.05)(见表 3)。
讨 论
肥胖病人除体重增加外,往往伴有胰岛素分泌曲线节律紊乱、胰岛素抵抗及微炎性反应(指低水平、持续炎症状态,主要表现为炎症细胞因子升高)[6]。以往临床对于胰岛素抵抗定义为,肌肉及其他胰岛素相关组织从血循环向细胞转运葡萄糖能力下降。但实际上胰岛素抵抗机制极为复杂,至今医学界对于其代谢紊乱状态及机制均未明确[7-8]。已有研究显示,胰岛素抵抗及代谢紊乱往往可导致肥胖人群胰岛素分泌曲线模式紊乱,诱发高胰岛素血症,胰岛素分泌节律出现异常[9-10]。以上变化可进一步加快肥胖人群向糖耐量异常甚至糖尿病转变,而糖代谢异常可反馈性加重胰岛素抵抗及胰岛素分泌异常,形成恶性循环。
国外报道显示,代谢性减重手术可有效延缓病态肥胖病人糖耐量异常及糖尿病发展进程[11]。本研究病态肥胖82例病人均行LSG手术治疗。该类手术操作相对简便,医源性创伤程度轻微,较其他类型减重手术并发症发生风险低。肥胖病人术后血糖水平均获得显著改善,且在术后6个月基本恢复正常。同时合并T2DM病人停用降糖药物,进一步显示该类手术在改善合并T2DM的肥胖病人病情方面效果良好。
代谢性减重手术用于糖尿病病人的治疗机制尚存在争议。目前大部分学者认为,可能与胰岛素抵抗及炎性状态改善密切相关[12]。已有研究显示,通过HOMA-IR胰岛素抵抗可用于大部分人群,无论体重或血糖水平是否正常[13]。本研究肥胖病人HOMA-IR 水平术后显著下降(P<0.05),其中合并T2DM组术后6个月HOMA-IR水平与血糖和糖耐量正常组比较差异无统计学意义(P>0.05),证实肥胖病人HOMA-IR水平与胰岛素的相关性。同时合并糖耐量异常和T2DM的肥胖病人胰岛素分泌曲线术前呈现高峰后移特点,分泌高点推迟至餐后120 min。但在术后6个月胰岛素分泌节律基本恢复至正常范围,分泌高点位于餐后60 min,其中血糖和糖耐量正常、糖耐量异常及T2DM的肥胖病人空腹胰岛素、餐后2 h胰岛素水平亦均处于正常范围,但餐后30 min和60 min胰岛素水平仍显著高于体重正常者(P<0.05)。笔者认为,这可能与肥胖病人HOMA-IR以及UA、TNF-α水平在术后6个月仍未完全恢复有关。

表2 手术前、后胰岛素分泌节律状态比较
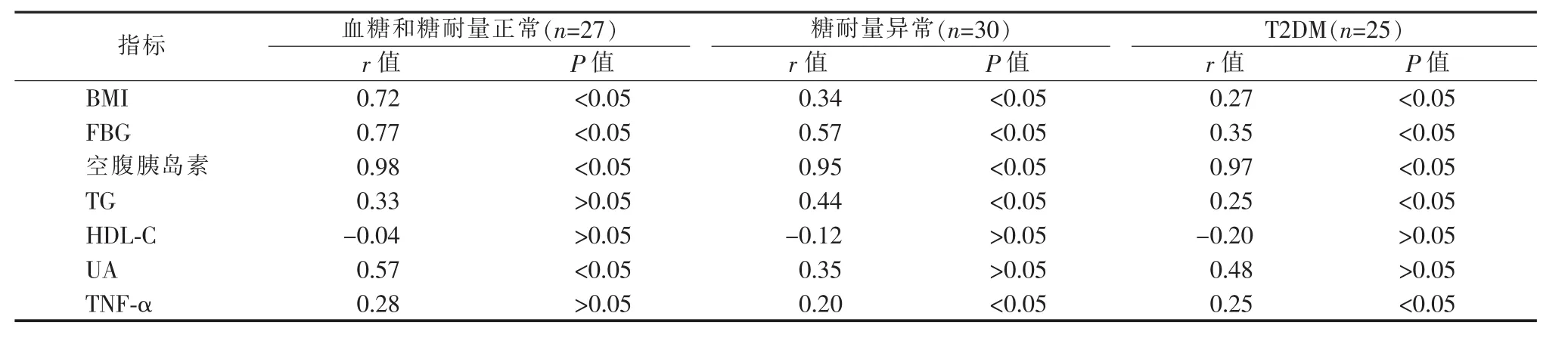
表3 术后6个月肥胖病人HOMA-IR与相关代谢指标间相关性分析
TNF-α是血清主要促炎细胞因子之一,多由脂肪细胞合成分泌。其在体内参与对ROS通路调节,通过激活介导多种转录因子诱发特异性炎性损伤[14]。相关实验研究证实,TNF-α水平异常升高可加快丝氨酸磷酸化,影响胰岛素分泌,加剧脂肪细胞及外周组织胰岛素抵抗状态,进而加快T2DM发生、发展进程[15-16]。本研究肥胖病人术前TNF-α水平较体重正常者显著升高,而术后呈下降趋势。采用Pearson法行相关性分析结果提示,肥胖病人TNF-α与HOMA-IR间呈正相关(P<0.05)。故笔者认为,LSG手术在降低肥胖病人体重的同时,还可改善胰岛素抵抗及微炎症状态。胰岛素抵抗和微炎症状态往往在肥胖病人体重恢复正常前即已明显改善,而血糖水平更是处于正常水平。基于此,笔者希望通过后续更长时间的随访,观察体重进一步下降并维持在正常水平,同时获得胰岛素分泌改善获益模式。
综上所述,病态肥胖病人采用LSG手术可有效促进胰岛素分泌曲线恢复,改善高胰岛素血症,纠正胰岛素抵抗和代谢紊乱。肥胖病人胰岛素抵抗发生与BMI、UA、TNF-α及脂代谢紊乱密切相关。
