复配亚麻籽油和辅酶Q10乳液的制备及表征
2020-05-19王云娟宋育聪吕奕文
黄 娟,王云娟,白 华,宋育聪,吕奕文,潘 挺,潘 芳
(1.常熟理工学院生物与食品工程学院,常熟215500;2.浙江大学生物系统工程与食品科学学院,杭州310058;3.东南大学成贤学院,南京210088)
0 引 言
亚麻籽油富含人体所必须的不饱和脂肪酸α-亚麻酸,其在体内可以转化成二十碳五烯酸 (eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA),它们为鱼油中的有效活性成分。α-亚麻酸对人类的健康具有重要作用,例如α-亚麻酸能够降低血脂和血压,抑制血栓和炎症等[1-3]。但是人体并不能合成这些多不饱和脂肪酸(polyunsaturated fatty acids,PUFA),因此,需要人为地在膳食中添加PUFA。在功能型膳食补充剂中添加PUFA是极具挑战的。由于PUFA分子中存在双键,这些脂肪酸易受氧化,导致产生不愉快的气味和潜在的毒性物质[4-5]。CoQ10是一种脂溶性醌类化合物,是生物体中线粒体重要组成成分之一,被美国FDA批准可用于治疗各种线粒体疾病,如糖尿病、充血性心力衰竭、癌症、帕金森病、牙周病和其他疾病等[6-11]。此外,CoQ10作为一种天然的抗氧化剂,亦可以清除自由基和抑制脂质过氧化[12-13]。CoQ10同样也存在着不溶于水,易于氧化,生物利用度低等问题[14]。
近年来,2种或2种以上的营养成分组合已成为一种潜在的营养补充策略。这些组合可以改善生物活性物质的溶解度和稳定性,引发协同作用,并使治疗效果最大化。乳液是目前应用最广泛的脂溶性成分共同传递的胶体分散系统之一。它是一种非均相体系,其中一种不互溶液体以液滴的形式分散在另一种表面活性剂稳定的液体中[15]。乳液能有效改善脂溶性活性成分的水分散性和口服生物利用度[16-18]。然而,乳液由于其乳化剂界面厚度薄、比表面积大、光穿透性高而不能有效抑制PUFA的氧化,通过在油相中加入合适的抗氧化剂,可以延缓PUFA在乳液中的氧化。没食子酸丙酯、二丁基羟基甲苯和丁基羟基茴香醚是食品工业中常用的合成抗氧化剂,能有效地抑制油脂氧化[19-20]。与这些合成的相比,使用天然抗氧化剂是一种更具前景的策略,因为它们可以为消费者提供绿色和健康的产品。CoQ10作为一种天然的抗氧化剂,已有报道可以清除自由基和抑制脂质过氧化[21]。因此,非常有必要采用乳液载体技术来传递亚麻籽油和CoQ10。本文创新性地使用一种天然抗氧化剂(辅酶Q10)来保护亚麻籽油,并将两者共同负载于乳液中,提高亚麻籽油和辅酶Q10在水性基质中的溶解度,从而提高两者的生物利用度。本文的研究有助于解决亚麻籽油和CoQ10的相关问题,更好地将其应用于功能性食品中,为消费者提供绿色健康的功能食品。
1 材料与方法
1.1 材料与试剂
冷榨亚麻籽油(ɑ-亚麻酸质量分数约57%),加拿大Ta Foods有限公司;辛酸癸酸甘油三酯(octyl and decyl glycerate,ODO),食品级,上海上德化工有限公司;辅酶Q10(纯度≥99%),西安皓天生物科技有限公司;甘油,食品级,济南世纪通达化工有限公司;阿拉伯胶,食品级,郑州凯盈化工有限公司;羧甲基纤维素钠(carboxymethyl cellulose sodium,CMCNa),天津市大茂化学试剂厂;胃蛋白酶、胰酶,美国Sigma公司;胆酸盐,德国Ruibio公司;过氧化氢异丙苯(纯度80%),上海Adamas公司;2-硫代巴比妥酸,国药集团化学试剂有限公司;1,1,3,3-四乙氧基丙烷(纯度97%),上海Adamas公司;其它试剂均为分析纯。
1.2 仪器与设备
电子天平,梅特勒-托利多仪器(上海)有限公司;磁力搅拌水浴锅,常州朗月仪器制造有限公司;RW20型数显悬臂搅拌器,德国IKA公司;高压均质机,ATS工业系统有限公司;高速离心机,长沙湘仪离心机仪器有限公司;高速剪切乳化机,上海弗鲁克机电设备有限公司;ZS90粒度仪,英国马尔文仪器有限公司;a-1900PC紫外可见分光光度计,上海浦元仪器有限公司;JEM-2100透射电子显微镜,日本电子株式会社。
1.3方法
1.3.1 复配亚麻籽油和CoQ10乳液的制备
准确称取6 g亚麻籽油、3 g ODO、5 g甘油和0.4 g的CoQ10置于50℃水浴条件中,300 r/min搅拌直至CoQ10完全溶解,得油相;称取10 g阿拉伯胶溶解于75.6 g去离子水中,50℃水浴,300 r/min搅拌至阿拉伯胶完全分散,得水相。在300 r/min搅拌条件下,将水相缓慢加入到油相中,继续搅拌30 min。随后3 000 r/min剪切10 min,得初乳。最后初乳在均质压力6×104kPa、循环次数3次的条件下均质得复配亚麻籽油和CoQ10的乳液。
1.3.2 平均粒径和Zeta电位
采用动态光散射技术(dynamic light scattering,DLS)测定乳液的平均粒径和PDI。为防止多重散射现象,乳液测定前需用去离子水稀释100倍。检测波长633 nm,温度25℃,角度90o。
采用动态光散射技术测定电泳迁移率,来测定乳液的Zeta电位。
1.3.3 形貌的表征
透射电子显微镜(transmission electron microscopy,TEM)来观察乳液的形貌。测试前乳液需用去离子水稀释50倍,然后取一滴滴到碳涂覆的铜栅上。用1%磷钨酸对样品进行负染色,并用滤纸吸去溢出的液体。待样品完全干燥后,在TEM下捕获图像。
1.3.4 CoQ10的负载量和包封率
采用乙醇提取法萃取乳液中的总CoQ10,于275 nm处紫外分光光度法测定吸光度值。采用高速离心法测定乳液中CoQ10的包封率。乳液在3 000×g的条件下离心15 min,由于CoQ10在水中的溶解度较低,离心后,未被包载的CoQ10将以结晶形式沉淀在离心管底部。乙醇提取离心后上层液体中的CoQ10,作为被包载的CoQ10。根据CoQ10紫外标准曲线计算总CoQ10和被包载CoQ10的含量。使用公式(1)和(2)计算CoQ10的负载量和包封率。

1.3.5 体外模拟消化
根据文献报道,采用两步法来进行复配亚麻籽油和CoQ10乳液的体外模拟消化试验[22]。根据Minekus等[22]报道的方法来制备模拟胃和小肠消化液。试验中所用到的所有溶液需在37℃温度下预热。
1)胃消化阶段
准确量取10 mL乳液,10 mL亚麻籽油CMCNa混悬液(亚麻籽油的浓度和乳液相等)和10 mL CoQ10 CMCNa混悬液(CoQ10的浓度和乳液相等)为对照,并加入7.5 mL的模拟胃消化液。随后加入5 μL 0.3 mol/L CaCl2溶液和1.6 mL的胃蛋白酶溶液(25 000 U/mL)。1 mol/L的盐酸调节溶液的pH值为1.2。最后加入模拟胃消化液保持总体积为20 mL,并在37℃条件下以100 r/min的转速孵育2 h。
2)肠消化阶段
向上一步胃消化后的溶液中加入11 mL的模拟肠消化液。随后,加入40 μL 0.3 mol/L CaCl2溶液和2.5 mL的胆酸盐溶液(69 mg/mL)。1 mol/L NaOH溶液调节溶液的pH值为7.0。然后加入5 mL胰酶溶液(800 U/mL),同时用0.04 mol/L NaOH溶液滴定,保持溶液的pH值为7.0,记录消耗的NaOH体积,滴定过程为2 h。NaOH消耗体积需扣除不含亚麻籽油的空白乳液消耗的NaOH体积。
每一步消化结束后,分别测定上清液中乳液的平均粒径和Zeta电位。
1.3.6 CoQ10的生物可给率
CoQ10的体外生物可给率可定义为肠消化结束后CoQ10进入磷脂和胆酸盐形成的混合胶束中的百分比[23]。肠消化后的溶液在3 000×g的离心力作用下离心15 min。随后,上层液体用乙醇稀释定容后于275 nm处测定吸光度值,并计算CoQ10的浓度。按以下公式计算CoQ10的体外生物可给率:

1.3.7 体外释放
采用透析袋法进行体外释放研究。透析袋截留分子量为12 000~14 000(Viskase,美国)。为保证漏槽条件,释放介质为无水乙醇和蒸馏水(体积比90:10)。将复配亚麻籽油和CoQ10的乳液及CoQ10乙醇溶液装入透析袋中,置于400 mL的释放介质中,搅拌速度100 r/min,温度37℃。释放过程中定期取3 mL的样品用于分析检测,同时补充等体积新鲜的释放介质。样品用紫外分光光度计于275 nm处测定吸光度值。
1.3.8 稳定性考察
1)稀释稳定性
将制备得到的复配亚麻籽油和CoQ10乳液用去离子水稀释成不同倍数(100~250倍),通过粒径测试的方式进行稀释稳定性的评价。
2)冻融稳定性
将制备得到的复配亚麻籽油和CoQ10乳液,平均分成6份,将这6份放入-20℃冰箱中冷冻0、60、120、180、240、300 min,取出室温自然解冻,去离子水稀释100倍后进行平均粒径和PDI的考察。
3)离子强度稳定性
考察不同的Na+、Ca2+离子浓度(食品中常见的离子)对乳液的平均粒径、PDI和Zeta电位的影响。分别向复配亚麻籽油和CoQ10的乳液中加入不同浓度的NaCl和CaCl2,Na+浓度为分别0.1、0.2、0.3、0.4和0.5 mol/L,Ca2+浓度为0.01、0.02、0.03、0.04 和0.05 mol/L,室温避光放置24 h后,取待测物测量其平均粒径、PDI和Zeta电位值。
4)光稳定性考察
室温条件下,取一定量的复配亚麻籽油和CoQ10乳液及CoQ10-ODO溶液于西林瓶中,放置于自然光条件下存贮30 d,分别于7、15、22和30 d,取样测定样品中CoQ10的保留率,并观察乳液的外观。
5)加速氧化稳定性
加速氧化稳定性实验来考察复配亚麻籽油和CoQ10乳液(不含CoQ10的亚麻籽油乳液为对照)中亚麻籽油的氧化稳定性。上述乳液分别放置于20 mL的玻璃瓶中。随后,所有样品置于55℃的恒温培养箱中培养15 d。分别测定油脂氧化的初级产物(过氧化值,PV)和次级产物(硫代巴比妥酸反应物,TBARs),并观察乳液的外观。
①PV
根据Uluata等[24]报道的方法测定PV值。0.2 mL的样品加入到1.6 mL异辛烷/2-丙醇(体积比3:1)的混合溶剂中,并剧烈震荡。上述混合物在3 400×g的条件下离心10 min,然后取上层溶剂0.2 mL与2.8 mL的1-丁醇/甲醇(体积比1:2)混合均匀。随后加入30µL Fe2+/3.94 mol/L硫氰酸铵溶液(体积比1:1)。0.132 mol/L BaCl2溶液和0.144 mol/L FeSO4溶液反应得到Fe2+溶液,Fe2+溶液需现配现用。迅速混匀上述混合溶液,置于避光处反应20 min。于510 nm处使用紫外可见分光光度法测定吸光度值,根据过氧化氢异丙苯标准曲线计算PV值。
②TBARs
根据Qiu等[25]报道的方法测定油脂的TBARs值。0.2 mL样品加入到3.8 mL的TBA反应液中,然后剧烈震摇试管,并将其置于沸水浴中加热15 min。室温完全冷却后,上述混合物在3 000×g的条件下离心10 min。上清液于532 nm处紫外可见分光光度法测定吸光度值,根据1,1,3,3-四乙氧基丙烷标准曲线计算TBARs值。
1.3.9 数据分析
所有结果用平均值±标准差(Mean±SD)表示,除已说明外,其他所有试验均平行操作3次。2组之间相同参数采用方差分析(ANOVA)及t检验(Student"s t-test)进行分析,以P<0.01或P<0.05表示差异有统计学意义。
2 结果与分析
2.1 物理化学性质的表征
本试验选用的甘油是无色、无臭、味甜,外观呈澄明黏稠液态,其具备较好的助乳化效果,还具备增溶作用,阿拉伯胶为古老的天然胶,具有良好的亲水亲油性,可作为主乳化剂,这些都有助于亚麻籽油和CoQ10在水性基质中的溶解,且符合天然、营养、多功能的方向。动态光散射测得的复配亚麻籽油和CoQ10乳液的平均粒径和PDI分别为(284±5.6)nm和0.112±0.025,PDI小于0.3表明乳液中的亚麻籽油可以均匀地在分散在水性基质中(图1)。乳液的Zeta电位为(-31.0±0.4)mV。
TEM分析复配亚麻籽油和CoQ10乳液的形貌特征(图2)。由于负染色,乳液的TEM照片显示为亮球形核和黑色背景,乳液的平均粒径和动态光散射技术测试的结果一致。
复配亚麻籽油和CoQ10乳液中CoQ10的负载量和包封率分别为0.392%±0.008%和97.08%±1.45%,同时,未见有任何亚麻籽油漂浮在液面上,以上结果表明亚麻籽油和CoQ10能很好地被包封于乳液中。

图1 复配亚麻籽油和CoQ10乳液的粒度分布图Fig.1 Particle size distribution of linseed oil and CoQ10 coloaded emulsions
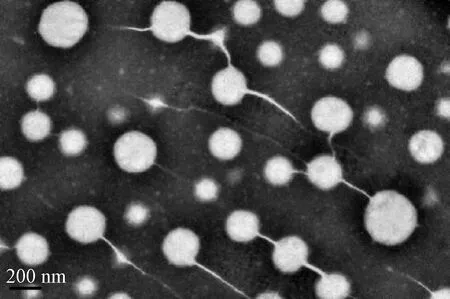
图2 复配亚麻籽油和CoQ10乳液的TEM照片Fig.2 TEM photograph of linseed oil and CoQ10 co-loaded emulsions
2.2 体外模拟消化
复配亚麻籽油和CoQ10乳液体外模拟消化后的平均粒径和Zeta电位如图3a和3b所示,从图中可以看出,在模拟胃消化阶段,乳液的平均粒径变化不明显,这就表明乳液的结构没有被破坏,乳液的油滴能够抵抗胃消化液低pH的环境。Zeta电位由-31变为-16 mV,低pH值条件及消化酶在乳滴表面的吸附都可能引起这种变化。在模拟肠消化阶段,乳液的平均粒径显著增大,这说明乳液在肠消化液中消化剧烈。肠消化阶段,油脂在油水界面脂肪酶的作用下水解,脂解产物(游离脂肪酸、表面活性剂和溶解的生物活性物质)、胆盐和磷脂被组装成混合胶束和囊泡,然后运输到肠道并被肠道细胞吸收[26-27]。肠消化后,乳液的Zeta电位由胃消化液中的-16变为-23.8 mV,这可能是由于胆酸盐、磷脂等阴离子覆盖在乳滴的表面,造成电位绝对值的增大。
图3c是复配亚麻籽油和CoQ10乳液及亚麻籽油CMCNa混悬液在模拟肠消化过程中NaOH溶液的体积消耗量。在脂肪酶的催化下,油脂在小肠消化液中被水解成游离脂肪酸,而NaOH能和游离脂肪酸发生中和反应,因此可以用消耗的NaOH溶液的体积来间接表示亚麻籽油被消化的量[28]。从图中可以看出,亚麻籽油CMCNa混悬液中亚麻籽油脂解的量比较少,这说明未载体化的亚麻籽油在水中的溶解度低限制了消化,而经过载体化后的亚麻籽油的消化速率和消化的量明显增大。这是由于载体化后的亚麻籽油具有更大的比表面积,脂肪酶和亚麻籽油之间的相互接触也就更多,导致更多的亚麻籽油被水解。复配亚麻籽油和CoQ10乳液中脂肪的快速消化对提高亚麻籽油的生物利用度有很大的意义。
图3d是肠消化后复配亚麻籽油和CoQ10乳液及CoQ10混悬液中CoQ10的生物可给率。复配亚麻籽油和CoQ10乳液中CoQ10的生物可给率明显高于CMCNa混悬液,这是由于载体化后体系中的亚麻籽油被水解,亚麻籽油中的长链脂肪酸能够形成具有高增溶能力的胶束,溶解大量亲脂性生物活性物质,使得CoQ10的生物可给率提高。
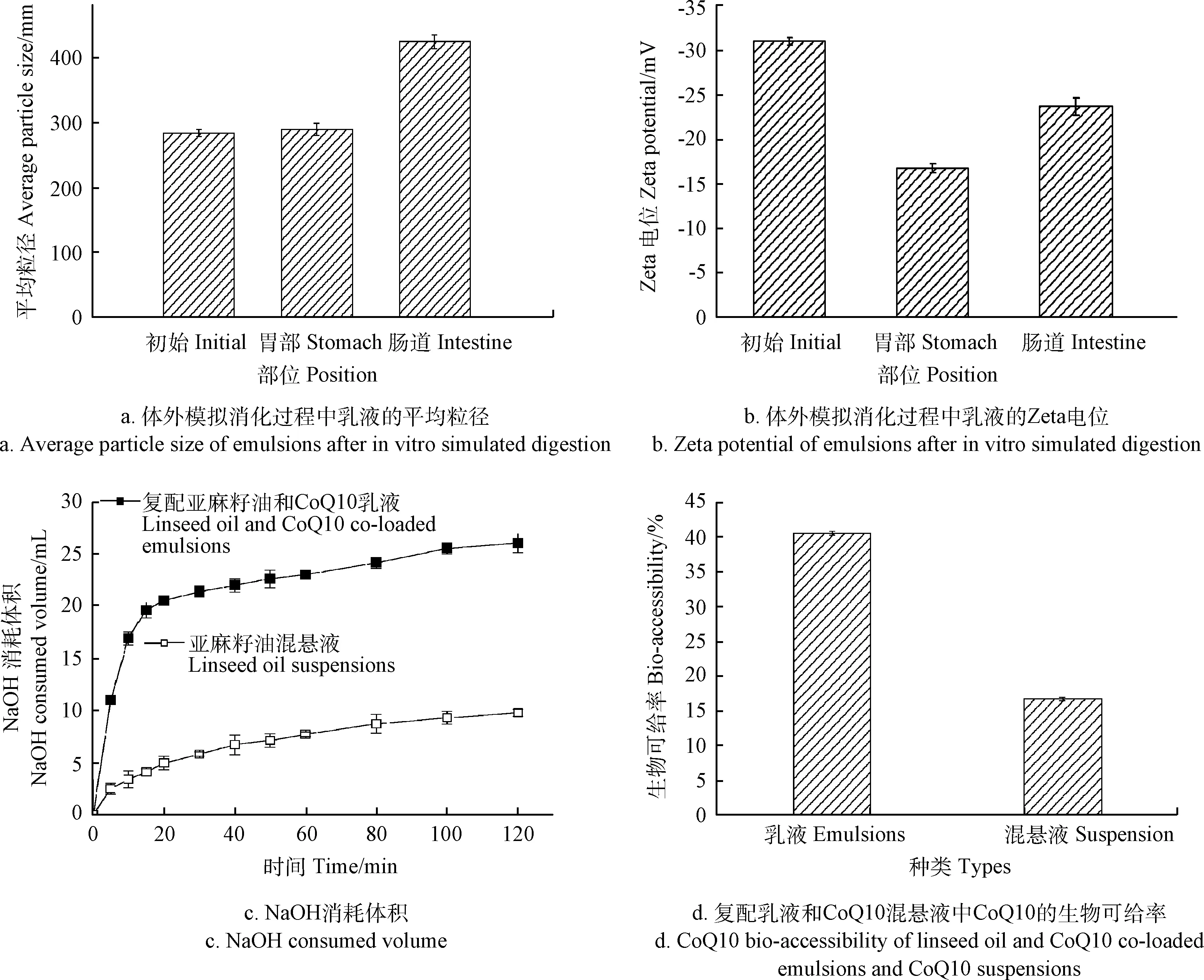
图3 体外模拟消化过程中复配亚麻籽油和CoQ10乳液的平均粒径、Zeta电位、油脂的消化和CoQ10的生物可给率Fig.3 Average particle size,Zeta potential,digestion of oil and CoQ10 bio-accessibility of linseed oil and CoQ10 co-loaded emulsions during in vitro simulated digestion
2.3 体外释放
复配亚麻籽油和CoQ10乳液及CoQ10乙醇溶液的体外释放曲线如图4所示。释放初始2 h,复配乳液和乙醇溶液中CoQ10快速释放,释放曲线几乎重合。乳液中CoQ10初始阶段快速释放的现象可能是由于少量吸附在乳液液滴表面的CoQ10快速释放造成的。释放2 h后,CoQ10乙醇溶液的释放仍然较快,24 h CoQ10释放达到94.0%±3.03%,几乎完全释放。而CoQ10乳液释放速度明显变缓,24 h CoQ10释放仅达到60.0%±3.59%。以上结果表明CoQ10包裹于乳液的液滴中能减缓CoQ10的释放速率,达到缓释效果,最终有望提高CoQ10的口服生物利用度。
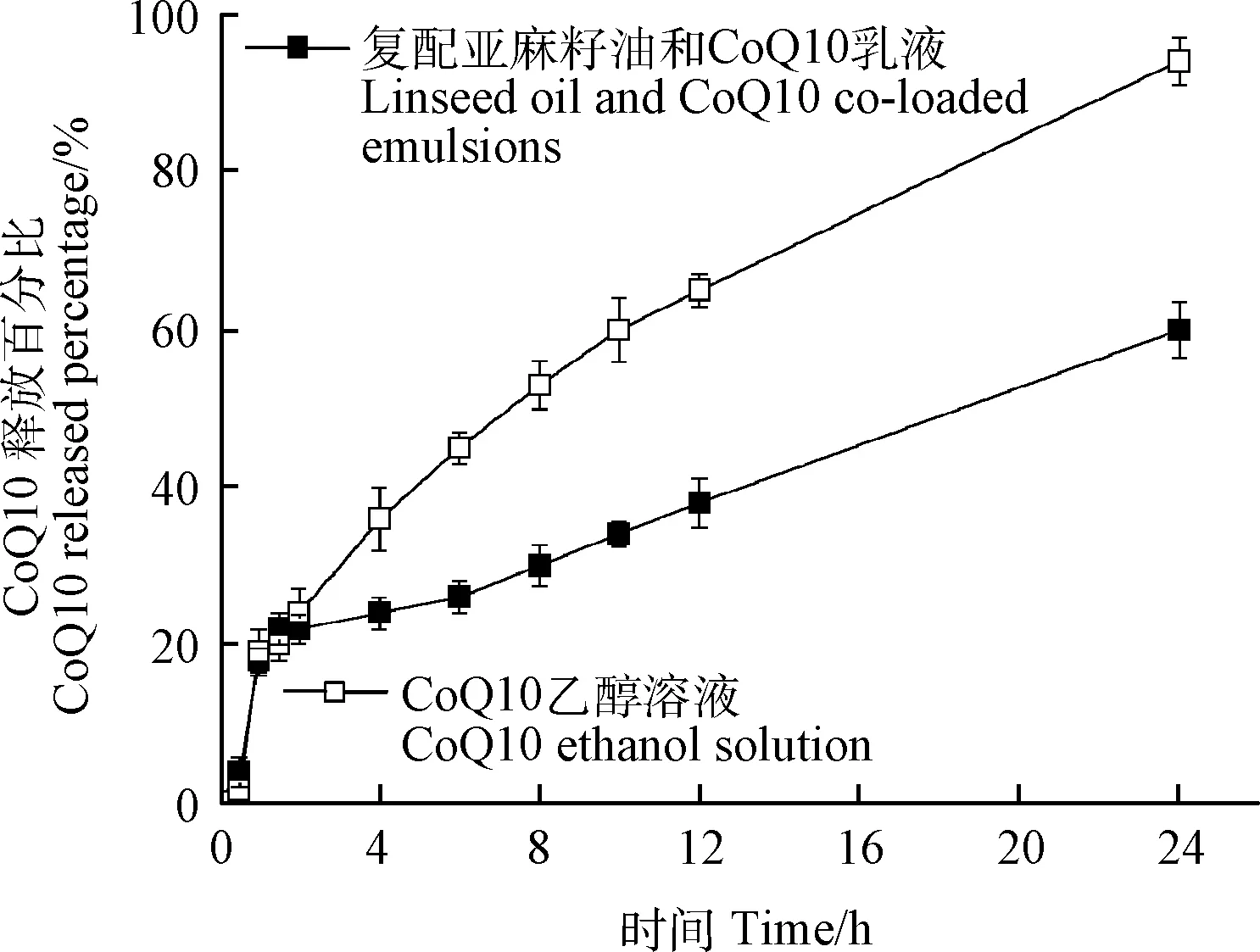
图4 复配亚麻籽油和CoQ10乳液及CoQ10乙醇溶液的体外释放曲线Fig.4 In vitro release profiles of prepared emulsions and CoQ10 ethanol solution
2.4 稀释稳定性
乳液应用于功能性食品中通常需要稀释。稀释稳定性对于乳液在功能食品中的应用具有重大意义。复配亚麻籽油和CoQ10乳液稀释100~250倍的稳定性如图5a所示。稀释后乳液的粒径和PDI保持在相同水平内,没有显著变化(P<0.05)。同时,稀释后未观察到乳液的分层或絮凝等不稳定现象。因此,可以得出结论,复配亚麻籽油和CoQ10的乳液稀释100~250倍后是稳定的。
2.5 冻融稳定性
在食品的储藏和运输过程中,经常需要处在一个比较低温的环境下,待使用时再取出恢复常温。冻融稳定性的考察对乳液的稳定性具有一定的应用价值,从图5b可以看出,冻融2 h内乳液的粒径和PDI随冷冻时间的增加并没有太大变化,总体是在同一水平上,说明制备的乳液可以承受一定范围内温度的变化。当冻融时间超过2 h后,乳液的粒径和PDI呈现轻微增长趋势,这是由于冷冻3 h后,乳液完全冷冻,快速复苏后因为环境剧烈变化造成小部分乳液膜破裂导致粒径增大。但乳液依然是比较稳定的,没有观察到分层、絮凝等不稳定现象。
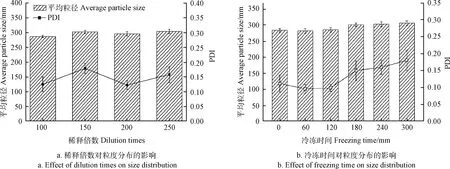
图5 复配亚麻籽油和CoQ10乳液的稀释稳定性和冻融稳定性Fig.5 Dilution and freeze-thaw stabilities of linseed oil and CoQ10 co-loaded emulsions
2.6 离子强度稳定性
Na+是常见的食品添加剂,也存在于人类的胃肠道中,因此,Na+可能影响载体在食品中或摄入到人体后的功能。本节研究了不同浓度的Na+(0~0.5 mol/L)对乳液性能的影响。如图6所示,添加NaCl并没有引起乳液粒径和PDI的明显变化,当Na+浓度从0.1 mol/L增加至0.5 mol/L时,Zeta电位绝对值出现了下降,该现象可能是由于氯化钠的静电屏蔽作用,抑制乳滴表面电荷电离,表面电荷的绝对值减小。
O/W乳液主要是通过静电相互作用和分子吸附来保持稳定,因此,水相的离子强度对控制静电斥力的Zeta电位有很强的影响,从而影响乳液的稳定性[29]。为了改善营养状况,食品工业常向食品中添加一些微量元素,Ca2+是常用的元素之一。因此,本节选择使用CaCl2(0.01~0.05 mol/L)研究Ca2+强度对乳液载体稳定性的影响。结果如图7所示,添加Ca2+对乳液载体的粒径和PDI影响不大,但是会减小载体的Zeta电位绝对值,当离子浓度为0.05 mol/L时,载体的Zeta电位绝对值降到最低,这说明高浓度氯化钙加入到乳液中,由于静电屏蔽作用,抑制乳滴表面电荷电离,导致其表面电荷的绝对值下降不能形成足够的静电斥力。
由图6b和图7b可知,在实际应用过程中要注意Na+和Ca2+的添加,高Na+和Ca2+的浓度会引起乳液体系的不稳定。Ca2+Zeta电位绝对值下降幅度较Na+大,表明Ca2+对乳液稳定性的影响较Na+大。
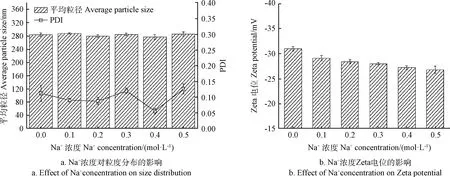
图6 不同Na+浓度对复配亚麻籽油和CoQ10乳液粒度分布和Zeta电位的影响Fig.6 Influences of different Na+concentrations on size distribution and Zeta potential of linseed oil and CoQ10 co-loaded emulsions
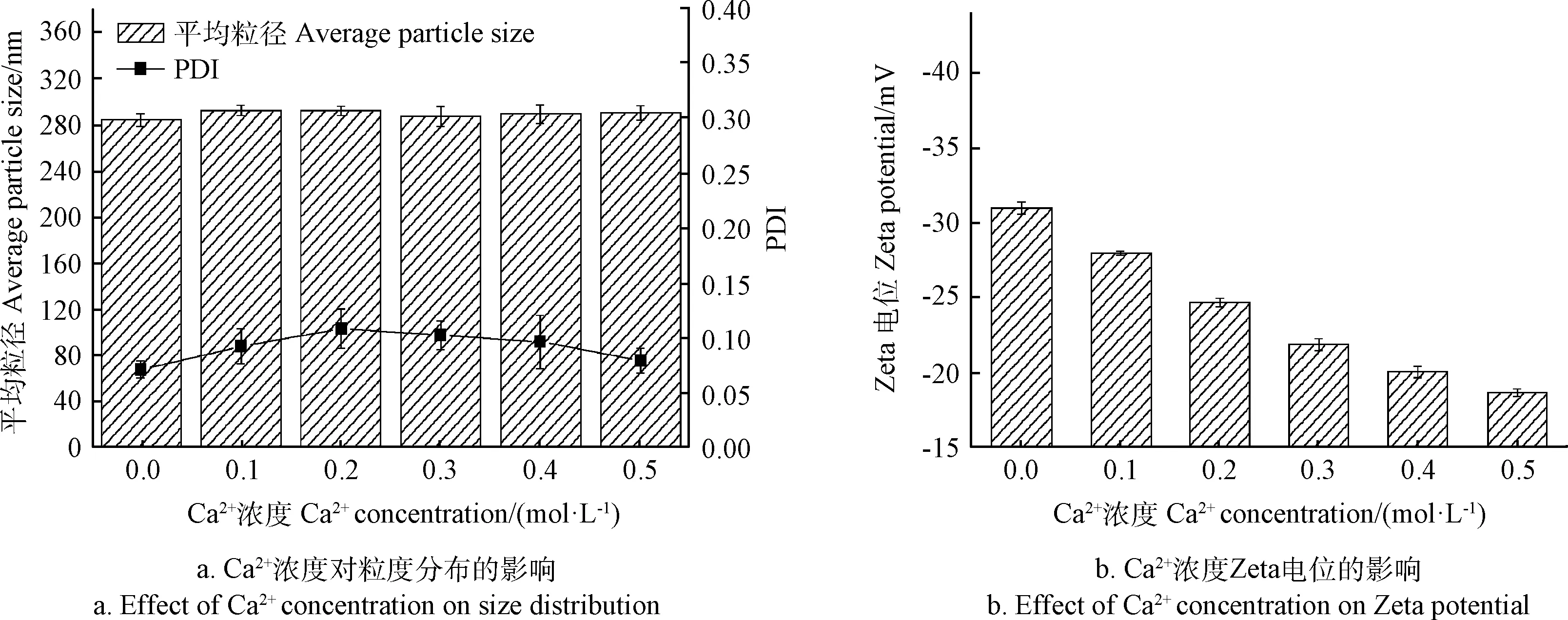
图7 不同Ca2+浓度对复配亚麻籽油和CoQ10乳液粒度分布和Zeta电位的影响Fig.7 Influences of different Ca2+concentrations on size distribution and Zeta potential of linseed oil and CoQ10 co-loaded emulsions
2.7 光稳定性
复配亚麻籽油和CoQ10乳液及CoQ10-ODO溶液的光稳定性结果如图8所示。储存1个月后,乳液的外观并未观察到分层、絮凝等不稳定现象。CoQ10乳液中CoQ10的保留率为63.2%±1.8%,而作为对照的CoQ10-ODO溶液CoQ10保留率仅为47.8%±1.9%,这说明当CoQ10被包裹于乳液中,CoQ10受光降解的影响减弱,光稳定性较好,CoQ10乳液形式明显可以提高CoQ10的光稳定性。
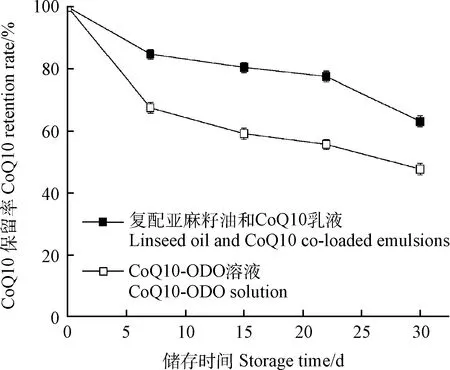
图8 复配亚麻籽油和CoQ10的乳液及CoQ10-ODO溶液的光稳定性Fig.8 Photostability of prepared emulsions and CoQ10-ODO solution
2.8 加速氧化稳定性
复配亚麻籽油和CoQ10乳液中亚麻籽油的氧化稳定性结果如图9所示。加速氧化15 d的过程中,乳液的外观并未观察到分层、絮凝等不稳定现象。此外,亚麻籽油乳液的初级和次级氧化产物迅速上升,表明乳液中的亚麻籽油氧化稳定性较差,这是由于乳化后乳滴粒径较大,乳滴中的亚麻籽油和水中氧气的接触面积较大,导致乳液中的亚麻籽油容易被氧化,亚麻籽油乳液产品货架期较短[30]。向亚麻籽油乳液中复配上CoQ10,复配后乳液的氧化产物在储存过程中基本不变,表明复配乳液中亚麻籽油的氧化稳定性较好,CoQ10强烈的抗氧化作用能够较好的保护亚麻籽油。以上结果表明制备的复配亚麻籽油和CoQ10乳液具有良好的氧化稳定性。图9 亚麻籽油乳液、复配亚麻籽油和CoQ10乳液55℃储存15 d的氧化稳定性
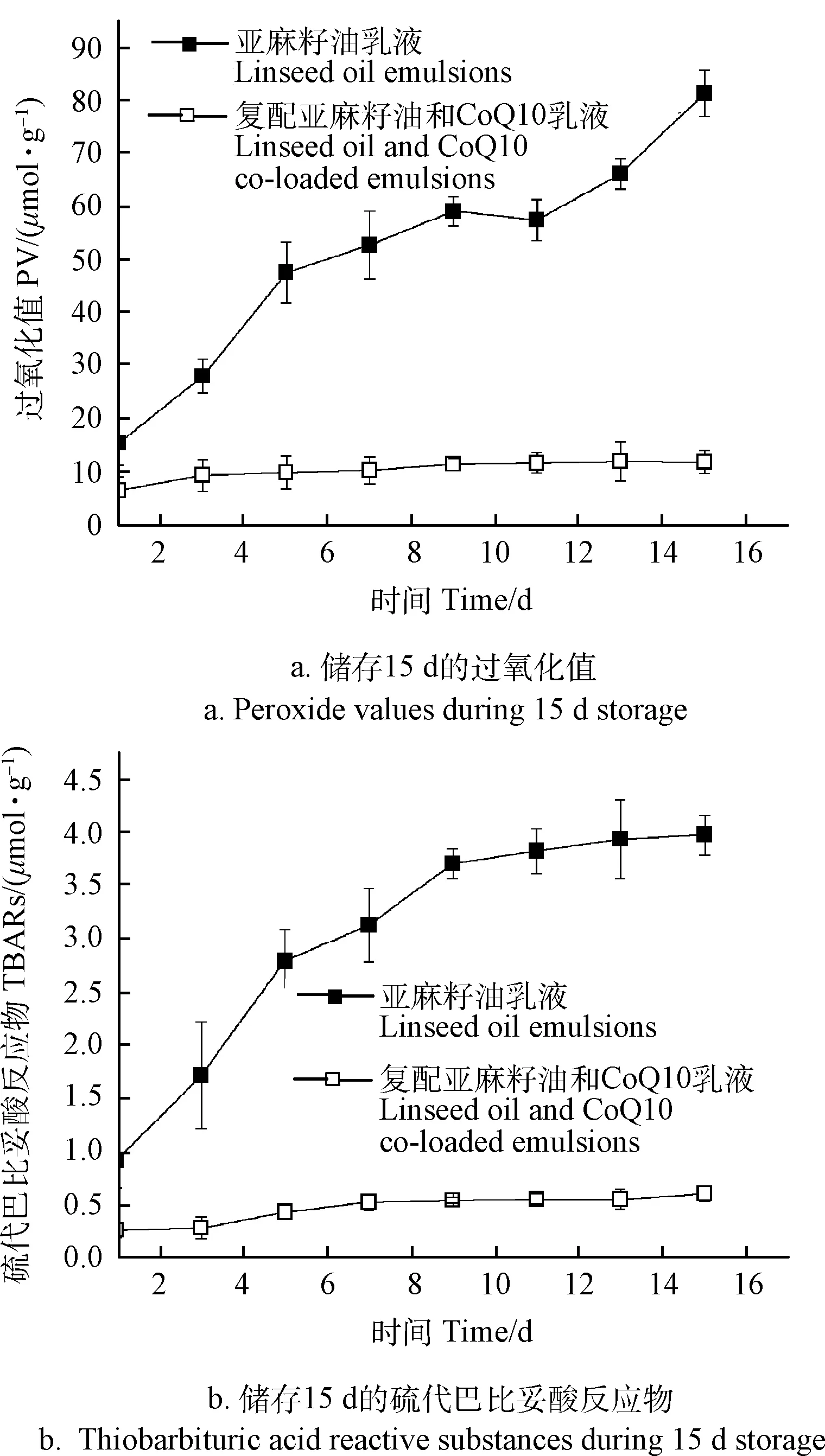
图9 亚麻籽油乳液、复配亚麻籽油和CoQ10乳液55℃储存15 d的氧化稳定性Fig.9 Oxidation stability of linseed oil emulsions and linseed oil and CoQ10 co-loaded emulsions stored at 55℃for 15 days
3 结 论
本文采用高压均质法制备复配亚麻籽油和CoQ10的乳液。结果表明,制备得到的乳液粒径约280 nm左右,PDI小于0.3表示乳液能在水中均匀分散。CoQ10的负载量为0.392%±0.008%,和未载体化的原料相比,乳液能提高其在水中的溶解度。体外模拟消化试验表明乳液主要在小肠中消化降解,和混悬液相比,乳液中亚麻籽油的消化率和CoQ10的生物可给率得到了很大的提高。乳液中CoQ10的释放表现出明显的缓释效果。制备的乳液具有良好的稀释和冷冻稳定性。离子稳定性实验表明Na+和Ca2+对乳液的物理稳定性具有一定的影响,Ca2+的影响要大于Na+,应用过程中要注意阳离子的添加使用量。加速氧化稳定性试验表明乳液中的亚麻籽油较容易氧化变质,CoQ10对于亚麻籽油有较好的保护作用,制备的复配乳液具有较好的氧化稳定性。本研究为亚麻籽油和CoQ10的载体化提供了一种新颖而有效的策略,为今后在功能性食品开发中的应用奠定了基础。
