肝癌模型小鼠中线粒体源外泌体 基因的差异性表达分析
2020-05-18龙晓芳李根亮唐玉莲倪安妮陆瑞群李曙波韦海闻蓝丹陈荣彬
龙晓芳 李根亮 唐玉莲 倪安妮 陆瑞群 李曙波 韦海闻 蓝丹 陈荣彬

【摘要】 目的 探討线粒体源外泌体基因参与肝细胞癌(HCC)病理过程的可能分子机制。
方法 通过RNA-seq和生物信息学手段,分析HCC中差异表达的线粒体源外泌体基因(DEMEs)及其生物学功能。
结果 HCC组织中共鉴定出93个DEMEs,其中74个表达下调,19个表达上调。表达下调的DEMEs经功能富集,共富集到4个生物学过程(biological process,BP)、4个细胞组分(cellular component,CC)、2个分子活性(molecular function,MF)、1个信号通路(KEGG pathway,KG)和4个蛋白位点序列特征(UP_SEQ_FEATURE,US)。它们参与了氧化还原、脂质代谢等过程,且大量DEMEs还具有线粒体转运肽功能。而上调表达的DEMEs,除了富集到1个CC,即线粒体组分,还发现其中一些参与了跨膜转运、对过氧化氢和对机械刺激的反应过程,有些还具有转移酶活性和ATP结合能力,并参与癌症的发生和转移等病理过程。
结论 线粒体源外泌体基因在HCC肿瘤组织与非肿瘤组织存在差异性表达,生物信息学分析显示这种差异性表达的基因涉及多个生物学过程,提示它们可能通过多种途径影响HCC的发生。
【关键词】 肝细胞癌;外泌体;线粒体;差异表达基因
中图分类号:R735.7 文献标志码:A DOI:10.3969/j.issn.1003-1383.2020.04.002
Analysis of differential expression of mitochondrion-derived exosomal genes in hepatocellular carcinoma model mice
LONG Xiaofang1,LI Genliang2,TANG Yulian2,NI Anni2,LU Ruiqun2,LI Shubo2,WEI Haiwen1,LAN Dan1,CHEN Rongbin1
(1.Clinical Medicine of Grade 2016,2.Department of Biochemistry and Molecular Cell Biology,Youjiang Medical University for Nationalities,Baise 533000,Guangxi,China)
【Abstract】 Objective To investigate the possible molecular mechanism of mitochondrion-derived exosomal exosome genes(DEMEs) involved in the pathological process of hepatocellular carcinoma(HCC).
Methods The DEMEs in HCC and their biological functions were analyzed by RNA-seq and bioinformatics methods.
Results 93 DEMEs were identified in HCC,among which 74 were down-regulated and 19 were upregulated.The down-regulated DEMEs were functionally enriched to 4 biological processes(BPs),4 cellular components (CCs),2 molecular functions (MFs),1 signal pathway (KG) and 4 UP-Seq features (USs).They involved in redox and lipid metabolism and majority of DEMEs had mitochondrial transport peptide-encoding sequences.The up-regulated DEMEs,in addition to the enrichment of 1 CC,i.e.mitochondrial component,were also found to be involved in the transmembrane transport,the reaction to hydrogen peroxide and mechanical stimulation,some of them also had transferase activity and the ATP binding ability,and involved in the occurrence and metastasis of cancer and other pathological processes.
Conclusion Mitochondrion-derived exosomal genes are differentially expressed in HCC tumor and non-tumor tissues.Bioinformatics analysis shows that the DEMEs are involved many biological processes,suggesting that they may affect the development of HCC in various ways.
【Key words】 HCC;exosomes;mitochondria;differentially expressed genes
肝细胞癌(hepatocellular carcinoma,HCC)是全世界高发的癌症之一。据报道,2018年全球HCC新发病例约84.2万人,死亡病例78.2万人[1]。外泌体是细胞分泌的小囊泡,在人体生理病理过程中发挥着重要作用,广泛参与细胞间通讯、血管再生、细胞迁移、免疫应答及肿瘤的发生发展[2~5]。来自肿瘤细胞的外泌体能将来源于母体肿瘤细胞的信息传递给正常细胞或恶性细胞[6]。线粒体是细胞能量代谢的中心,线粒体功能障碍与肿瘤的发生发展密切相关[7~9]。但线粒体源外泌体基因通过何种机制参与HCC的发展这一问题还有待进一步研究。本文旨在通过分析HCC肿瘤组织和非肿瘤组织中差异表达的线粒体源外泌体基因(differentially expressed mitochondrion-derived exosomal genes,DEMEs),探讨其参与HCC发展的可能分子机制,为临床治疗提供一定的理论基础。
1 材料与方法
1.1 实验材料和方法
肝癌肿瘤组织取自本实验室构建的肝癌模型小鼠(n=40)。肝癌模型小鼠构建方法如下:选取40只鼠龄7周左右、体重25 g左右的健康昆明小鼠于双前肢腋下一次性注射H22肝癌细胞株(浓度=10 5个细胞/mL),每只注射0.2 mL,正常饲养1个月后,成瘤小鼠即为肝癌模型小鼠,取其肿瘤组织为肿瘤样本组织。同法,取另40只健康小鼠无菌生理盐水注射(0.2 mL/只)作为对照组,取健康肝组织对照。取同组内样本组织等量混合约50 g,提取总RNA(Eastep Super总RNA提取试剂盒,中国上海),送公司进行测序分析。RNA-seq质量检测及clean reads筛选按常规程序完成[10]。
1.2 DEMEs的筛选
分析RNA-seq数据,筛选HCC肿瘤组织和非肿瘤肝组织之间的差异表达基因,差异表达基因筛选以RPKM(Reads Per Kilo bases per Million reads,每百万测序碱基中每千个转录子测序碱基中所包含的测序片断数)比值≥2或≤0.5为有统计学意义。而后以“癌症(cancer or carcinoma)、外泌体(exosome or exosomal)及线粒体(mitochondria or mitochondrial)”为关键词,在NCBI中的Nucleotide數据库(https://david.ncifcrf.gov/home.jsp)进行检索,获得癌症线粒体源外泌体基因作为背景基因。将背景基因与RNA-seq数据中的差异表达基因进行比对,获得DEMEs。
1.3 DEMEs的功能分析
利用DAVID 6.8在线软件(https://david.ncifcrf.gov/)对DEMEs进行功能富集分析,并对富集到的生物学程序(biological process,BP)、细胞组分(cellular component,CC)、分子活性(molecular function,MF)、信号通路(KEGG pathway,KG)、蛋白位点序列特征(UP_SEQ_FEATURE,US)和功能部位(Interpro)等进行功能注释聚类,以FDR值(false discovery rate,错误发现率)≤0.05为有统计学意义。
1.4 DEMEs编码蛋白的互作分析
通过STRING11.0版本软件(https://string-db.org/)在线对DEMEs编码蛋白进行互作分析,以评价其在分布和功能上的相关性。
2 结 果
2.1 测序数据
肝癌肿瘤组织和非肿瘤肝组织样本通过RNA-seq分别获得了5.86 G base(39.99 M clean reads)和6.35 G base (43.33 M clean reads)的测序数据。二者的Q30分别为93.62%和93.62%,表明碱基测序错误率小于0.1%,测序数据质量好,测序的覆盖度和深度较高,可用于后续分析使用。经过分析,在两样本之间共发现4483个差异表达基因。
2.2 DEMEs筛选
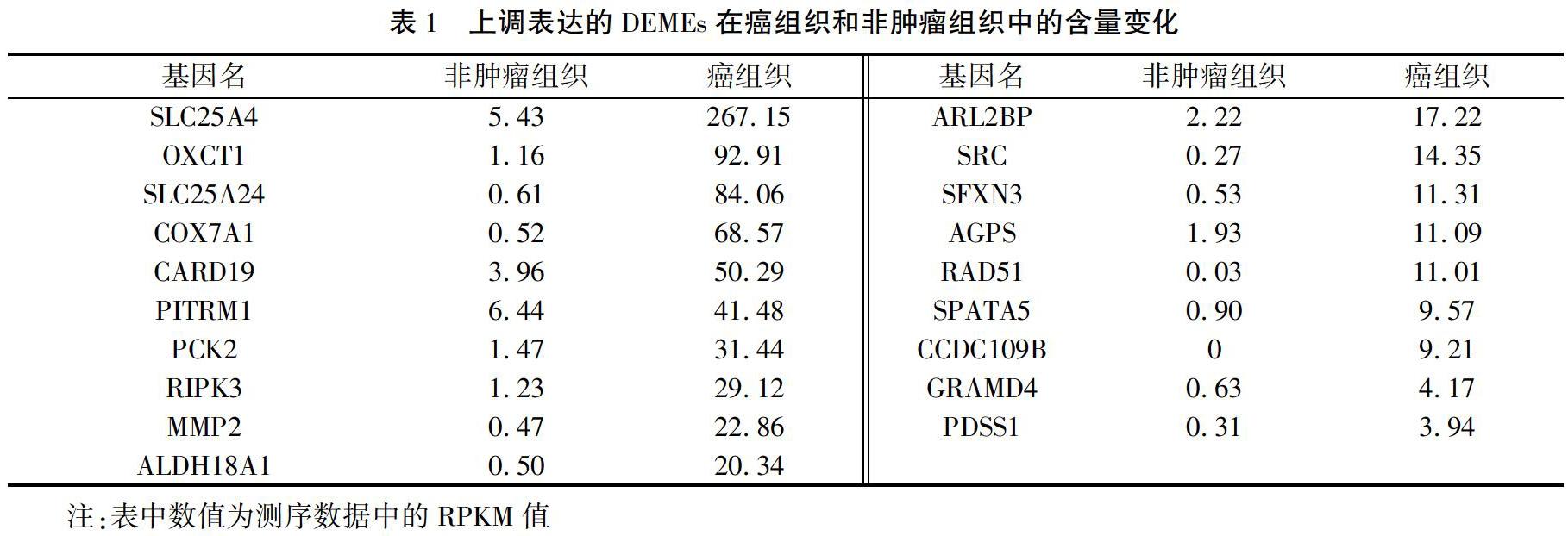
在NCBI数据库中共获得了5435个癌症相关线粒体源外泌体基因。与测序数据中的4483个差异表达基因比对,共筛选出93个DEMEs,其中表达上调的19个(见表1),表达下调的74个(见表2)。
2.3 DEMEs的生物学功能
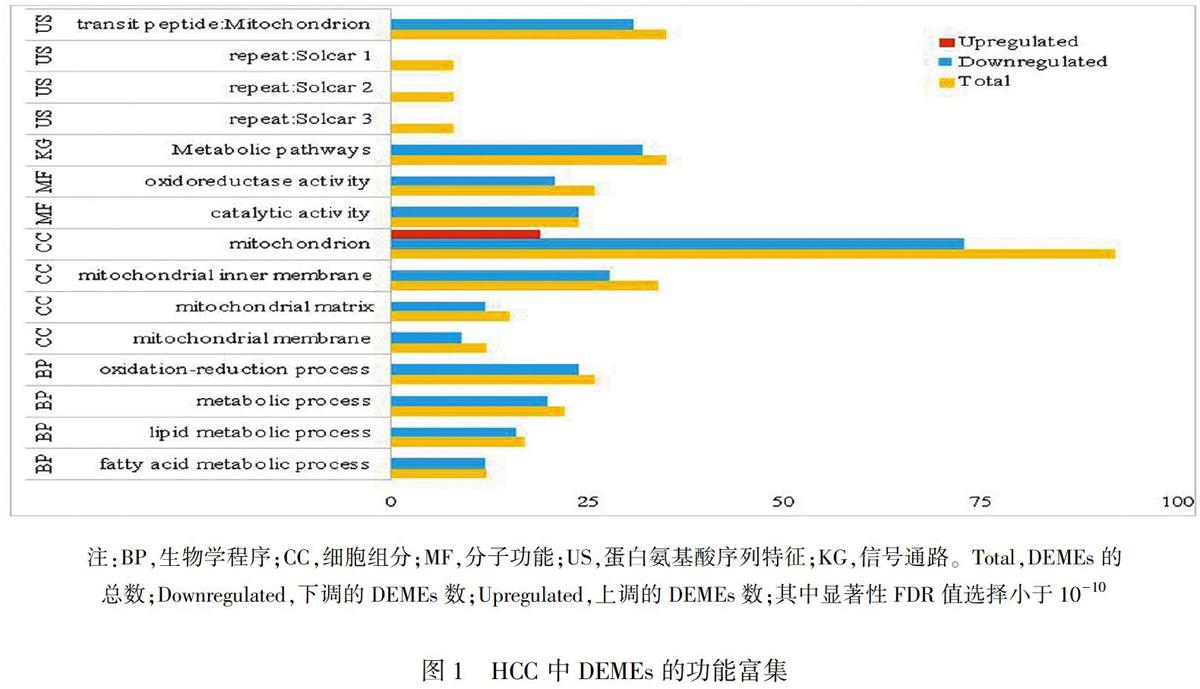
对筛选出的DEMEs通过DAVID 6.8软件进行了功能富集。其中,在HCC中下调表达的74个DEMEs共富集到4个BP、4个CC、2个MF、1个KG和4个US(图1)。从BP可以看出,24个基因参与了氧化还原过程,16个基因参与了脂类代谢过程等。从MF可以看出,这些分子具有氧化还原酶活性和催化活性等。且表达下调的这74个DEMEs中,73个属于线粒体组分,且其中31个具有线粒体转运肽功能。而表达上调的DEMEs,仅富集到了1个CC,即线粒体组分(见图1)。另外,上调表达的DEMEs中,SFXN3、SLC25A24和SLC25A4 三个基因参与了跨膜转运;SRC和MMP2两个基因参与了对过氧化氢及对机械刺激的反应;RIPK3、ALDH18A1、OXCT1、PDSS1、AGPS和SRC等6个基因还具有转移酶活性;RIPK3、SPATA5、ALDH18A1、RAD51、SRC等5个基因具有ATP结合能力。DEMEs编码蛋白的互作关系见图2。
3 讨 论
外泌体是包涵蛋白质、RNA和miRNA等多种物质的胞外膜囊细胞器。外泌体内容物并不是由细胞随机装配而分泌到细胞外环境中,而是受到细胞的精细调节,其内容物反映了来源细胞的功能,并参与细胞间的各种信息传递及物质交换[11]。线粒体是细胞能量代谢的中心,与肿瘤的发生、生长、侵袭和转移密切相关[7]。而外泌体携带的线粒体相关基因则可能会影响靶标组织细胞的能量代谢。
本研究通过RNA-seq和生物信息学手段及数据库检索,在HCC组织中共鉴定出93个DEMEs,其中74个基因表达下调,19个基因表达上调。这些DEMEs的功能也主要富集于下调表达基因中。这一结果也得到了这些基因编码蛋白互作关系的验证。这些功能包括氧化还原过程、脂质代谢过程、氧化还原酶活性、催化活性等。尤其值得一提的是,在下调表达的DEMEs中,有31个基因具有线粒体转运肽功能。这些结果表明,HCC组织中外泌体携带的线粒体相关基因有显著减少的趋势,且这些减少的基因参与了重要的能量代谢过程。也就是说,线粒体源外泌体基因在正常组织中可能通过外泌体的运输,以转运肽介导的方式定位于新靶标细胞的线粒体膜上,从而参与有氧呼吸过程的能量代谢。由于癌细胞的能量代谢主要是通过无氧呼吸提供的[12],因此DEMEs在HCC中的减少可能有利于癌组织的无氧呼吸,从而有利于癌细胞的生存。但是,HCC中DEMEs的减少是癌变的结果,还是癌变的原因,这还有待进一步研究。无论是癌变的结果还是原因,都为我们提示了一条抑制癌细胞增殖的可能新途径,即通过外泌体途径增加癌组织中的DEMEs,从而促进HCC组织中的有氧呼吸,来抑制HCC细胞的增殖。
而上调表达的DEMEs除了富集到1个CC即线粒体组分外,没有富集到其他功能,表明上调表达的DEMEs对HCC的能量代谢影响较小。但是,上调表达的基因还参与跨膜转运、对过氧化氢和对机械刺激的反应,有些还具有转移酶活性和ATP结合能力。其中,ALDH5A1不仅与非小细胞肺癌的发生、转移和预后相关[13],还与卵巢癌细胞的增殖、迁移、转移相关[14]。还有MMP2是Ⅳ型胶原酶,参与血管系统重塑、血管生成、组织修复、肿瘤浸润、炎症及动脉粥样硬化斑块破裂等多种功能,除降解细胞外基质蛋白外,还可以作用于多种非基质蛋白,例如大内皮1和促进血管收缩的Β型CGRP。此外,有报道称MMP2还能通过调节GSK3β的活性促进心肌氧化应激,参与心肌细胞死亡途径。这些结果表明,上调表达的DEMEs在HCC中可能具有利用ATP参与跨膜转运及参与对过氧化氢和对机械刺激反应的生理功能,进而影响癌症的发生、发展和迁移。该现象也为我们提示了另一条抑制癌细胞增殖的可能新途径,即通过抑制利用ATP参与跨膜转运、参与对过氧化氢和对机械刺激反应相关的DEMEs,来抑制HCC细胞的活性。
综上所述,我们的结果显示线粒体源外泌体基因在HCC肿瘤组织与非肿瘤组织存在差异性表达,生物信息学分析显示这种差异性表达的基因涉及多个生物学过程,提示它们可能通过多种方式影响HCC的发生。在HCC中,差异表达的线粒体源外泌体基因可能主要是通过减弱HCC组织中的有氧呼吸和增强利用ATP参与跨膜转运、对过氧化氢和对机械刺激反应,来影响癌症的病理过程。研究结果为我们提示了2条可能抑制癌细胞增殖的新途径,即通过外泌体途径增加癌组织中有氧呼吸相关的DEMEs,或抑制利用ATP参与跨膜转运、参与对过氧化氢和对机械刺激反应相关的DEMEs,来促进HCC组织中的有氧呼吸和抑制HCC细胞的活性。今后,我们将持续探讨这2条抑制癌细胞增殖的可能新途径,以期对其作用机制有更深入的了解,为临床肝癌的治疗和预防提供更可靠的理论依据。另外对于本实验获得的差异性表达基因没有提供qPCR验证分析,可能是本研究的一个缺陷,由于我们此次实验的实验样本与本实验室前期的一项研究[10]所用样本为同一批次样本,测序数据相同,前期的实验已经对测序数据进行了qPCR验证,验证了测序结果与qPCR结果是一致的。故此次实验未对差异表达基因进行验证分析。
参 考 文 献
[1] 向阳林,冯智浩,龚建平.外泌体在肝癌发生发展中的研究新进展[J].检验医学与临床,2019,16(17):2575-2578.
[2] ZHAO L W,GU C Y,GAN Y,et al.Exosome-mediated siRNA delivery to suppress postoperative breast cancer metastasis[J].J Control Release,2020,318:1-15.
[3] LU Y,DUAN Y,XU Q,et al.Circulating exosome-derived bona fide long non-coding RNAs predicting the occurrence and metastasis of hepatocellular carcinoma[J].J Cell Mol Med,2020,24(2):1311-1318.
[4] AN T X,QIN S H,XU Y,et al.Exosomes serve as tumour markers for personalized diagnostics owing to their important role in cancer metastasis[J].J Extracell Vesicles,2015,4:27522.
[5] WHITESIDE T L.Exosomes and tumor-mediated immune suppression[J].J Clin Invest,2016,126(4):1216-1223.
[6] BOYIADZIS M,WHITESIDE T L.Information transfer by exosomes:a new frontier in hematologic malignancies[J].Blood Rev,2015,29(5):281-290.
[7] 莊昊.GLDC调控cofilin泛素化影响肝细胞癌转移及预后[D].天津:天津医科大学,2018.
[8] 孙瑞,胡元昭,商容磊,等.线粒体脱氧鸟苷激酶在肺癌肿瘤发生中的作用及机制研究[J].中国科学(生命科学),2019,49(7):893-901.
[9] 张利桃,杨利军,杨涛.线粒体核糖体蛋白质与人类恶性肿瘤[J].中国生物化學与分子生物学报,2019,35(6):620-624.
[10] LI G L,NI A N,YU M Y.Pretumor microenvironment of hepatocellular carcinoma: Cancerization or anticancerization? [J].Gene,2019,701:46-54.
[11] 宋蕙晨,李伟利,褚丹萍,等.肝癌细胞外泌体蛋白组成分析[J].生命科学仪器,2017,15(1):26-31.
[12] WARBURG O.ber den heutigen Stand des Carcinomproblems[J].Naturwissenschaften,1927,15(1):1-4.
[13] 高菲,周斌,徐俊驰,等.LGR5和ALDH1A1在非小细胞肺癌进展和预后中的作用[J].中华核医学与分子影像杂志,2018,38(5):325-330.
[14] 田训.ALDH5A1对卵巢癌细胞的生物学影响及与卵巢浆液性乳头状腺癌预后关系的研究[D].武汉:华中科技大学,2017.
(收稿日期:2019-12-02 修回日期:2020-02-14)
(编辑:潘明志)
基金项目:广西大学生创新创业训练计划项目(201810599096);2020年广西学位与研究生教育改革课题(JGY2020164);广西自然科学基金(2016GXNSFAA380177,2015GXNSFAA139219)
作者简介:龙晓芳,女,在读本科生。E-mail:437443986@qq.com
通信作者:李根亮。E-mail:ligenliang@163.com
[本文引用格式]龙晓芳,李根亮,唐玉莲,等.肝癌模型小鼠中线粒体源外泌体基因的差异性表达分析[J].右江医学,2020,48(4):246-251.
