白背叶总黄酮对HSC-T6细胞增殖作用及胶原蛋白和细胞因子的影响
2020-05-18谢稳严建业
谢稳 严建业
【摘要】 目的 观察白背叶总黄酮体外对肝星状细胞(HSC-T6)增殖的抑制作用和相关胶原蛋白、细胞因子的影响。
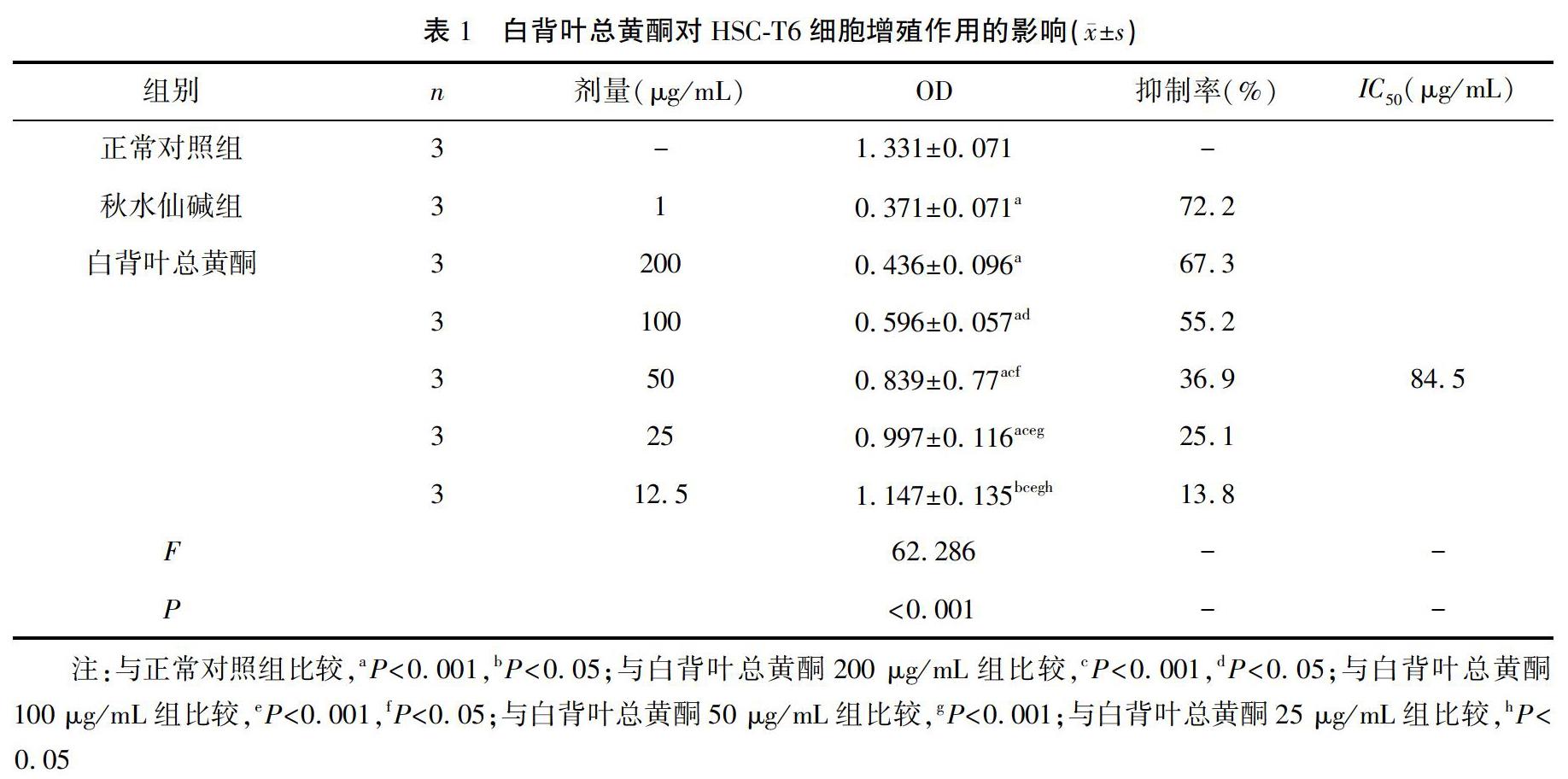
方法 体外培养HSC-T6细胞,将白背叶总黄酮(终浓度为200、100、50、25、12.5 μg/mL)作用于细胞48 h后,以MTT法检测细胞存活率,计算IC50;利用流式细胞仪检测细胞凋亡情况;收集细胞上清液,用ELISA法分别检测胶原蛋白COL-Ⅰ、COL-Ⅲ的表达水平和细胞因子TGF-β1、PDGF-BB的含量。
结果 白背叶总黄酮能通过诱导HSC-T6凋亡而抑制HSC-T6细胞的增殖,其抑制作用与药物终浓度呈量效关系;并显著降低HSC-T6 细胞生成的胶原蛋白COL-Ⅰ、COL-Ⅲ和细胞因子TGF-β1、PDGF-BB含量,与空白对照组比较差异有统計学意义(P<0.05或0.01)。
结论 白背叶总黄酮体外对HSC-T6细胞增殖有显著抑制作用,可治疗肝纤维化。
【关键词】 白背叶总黄酮;HSC-T6;胶原蛋白;细胞因子
中图分类号:R285.5 文献标志码:A DOI:10.3969/j.issn.1003-1383.2020.04.003
Effects of total flavonoids from Mallotus Apelta on proliferation of HSC-T6 cells and on collagen and cytokines
XIE Wen YAN Jianye
(1.School of Pharmacy,Hunan University of Chinese Medicine,Changsha 410208,Hunan,China;2.Science and
Technology Innovation Center,Hunan University of Chinese Medicine,Changsha 410208,Hunan,China;
3.Department of Pharmacy,Yongzhou Hospital of Traditional Chinese Medicine,Yongzhou 425000,Hunan,China)
【Abstract】 Objective To observe the inhibitory effect of total flavonoids from Mallotus Apelta on the proliferation of hepatic stellate cells (HSC-T6) and the effects of related collagen and cytokines.
Methods HSC-T6 cells were cultured in vitro,and after the total flavonoids(final concentrations were 200,100,50,25,12.5 μg/mL) were applied to the cells for 48 h,MTT assay was used to detect the cell survival rate and calculate IC50.Flow cytometry was used to detect apoptosis.In addition,cell supernatants were collected and the expression levels of collagen COL-Ⅰ and COL-Ⅲ and the contents of cytokines TGF-β1 and PDGF-BB were detected by ELISA.
Results Total flavonoids of Mallotus Apelta can inhibit the proliferation of HSC-T6 cells by inducing apoptosis of HSC-T6 cells,and the inhibitory effect was in a dose-effect relationship with the final drug concentration.The contents of collagen COL-Ⅰ,COL-Ⅲ and cytokines TGF-β1,PDGF-BB produced by HSC-T6 cells were significantly reduced,which was statistically significant compared with the blank control group(P<0.05 or 0.01).
Conclusion Total flavonoids of Mallotus Apelta has significant inhibitory effect on proliferation of HSC-T6 cells in vitro and can be used to treat liver fibrosis.
【Key words】 total flavonoids of Mallotus Apelta;HSC-T6;collagen;cytokines
白背叶又名白鹤叶、白面戟、白面风、白桃叶、白膜树,为大戟科野桐属植物白背叶[Mallotusapelta(Lour.)Muell.-Arg]的干燥叶,广泛分布于广西、广东、湖南、海南、浙江等地。有柔肝活血、健脾化湿、收敛固脱、消炎止血等功效,常用于治疗各种慢性肝炎、肝脾肿大、子宫脱垂脱肛、妊娠水肿、耳炎、疖肿、跌打损伤、外伤出血症[1]。药理学研究发现,白背叶具有抗肿瘤[2]、抗肝纤维化[3~4]、抗菌抗乙肝病毒[5~6]、抗炎[7]等作用。白背叶的根或叶在治疗肝纤维化方面已有相关研究,但白背叶黄酮类成分的抗肝纤维化作用鲜见报道,故本研究以白背叶总黄酮为研究对象,从细胞水平观察其对肝星状细胞(HSC-T6)增殖的作用,探讨白背叶治疗肝纤维作用的研究机制。
1 材料与方法
1.1 药物
白背叶总黄酮,白背叶采自广西南宁老虎岭,将500 g叶干燥剪碎,加入10倍量纯水,加热提取2 h,趁热过滤收集滤液。滤渣以相同方法继续提取2 h,最后合并滤液,将滤液过大孔吸附树脂柱,以水洗脱,再用乙醇洗脱,收集与盐酸-镁粉溶液产生阳性反应的洗脱液,收集的洗脱液通过减压干燥,重结晶即得到总黄酮。
1.2 试剂
DMEM培养基(HyClone,批号:ABA212570),胎牛血清(杭州四季青,批号:18090505),胰蛋白酶(Solarbio,批号:801S042),秋水仙碱(Sigma,批号:201708),Annexin V-FITC/PI双染细胞凋亡检测试剂盒(凯基生物,批号:20190821),COL-Ⅰ、COL-Ⅲ、TGF-β、PDGF-BB ELISA试剂盒(Bio-Swamp公司,批号:201705)。
1.3 仪器
流式细胞检测仪器(美国ThermoFisher,型号:Altune Nxt);倒置显微镜(LEICA DMIRB);二氧化碳培养箱(ThermoFisher);超净工作台(荷兰ClearAir公司);低速离心机(德国Biofuge Stoctos 公司);连续波长酶标仪(瑞士TECAN,型号:infinite M200pro)
1.4 MTT法检测HSC-T6的增殖
对数生长期HSC-T6细胞消化离心后,用10%血清的DMEM培养基调成浓度0.5×105 cell/mL混悬液接种于96孔板,每孔100 μL,使细胞数为5000个/孔,将细胞分为正常对照组、阳性对照组(秋水仙碱)、白背叶总黄酮(5个浓度梯度),每组3个复孔,置于37℃,5%CO2培养箱培养24 h。待细胞贴壁后,正常对照组加100 μL培养基,其余各组加相应的药物100 μL,使秋水仙碱终浓度为1 μg/mL,白背叶总黄酮终浓度分别为200、100、50、25、12.5 μg/mL,继续培养48 h后,每孔加入10 μL MTT溶液(5 mg/mL),4 h后弃上清,加入150 μL DMSO,振荡10 min,以酶标仪在490 nm处测各孔吸光度值(OD),计算抑制率,再根据抑制率求出半数抑制浓度(IC50),抑制率计算公式:肿瘤细胞生长抑制率(%)=(1-实验组平均OD值/对照组平均OD值)×100%。
1.5 流式细胞术检测HSC-T6细胞的凋亡
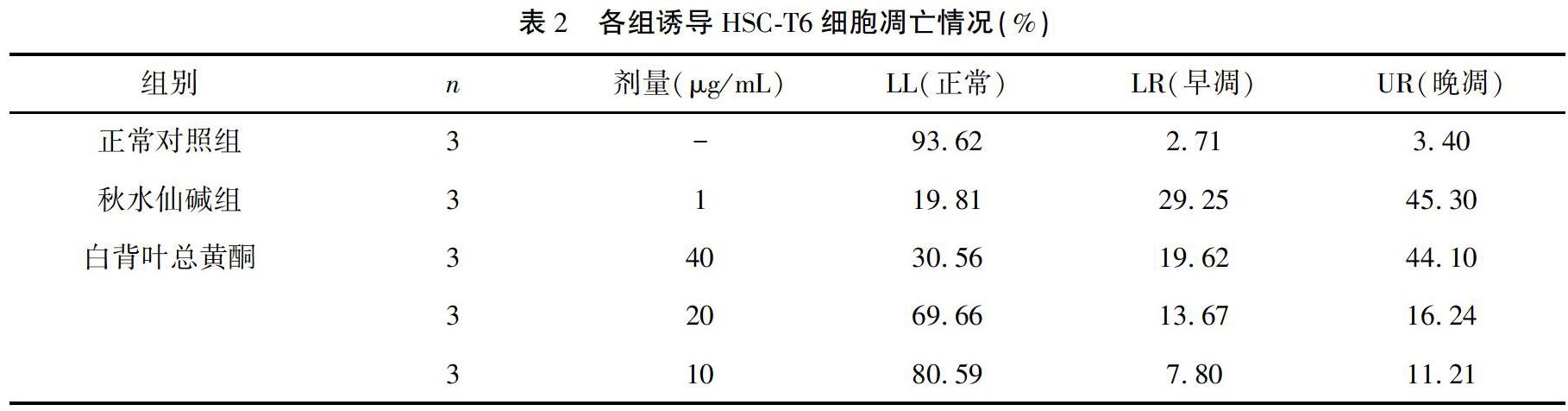
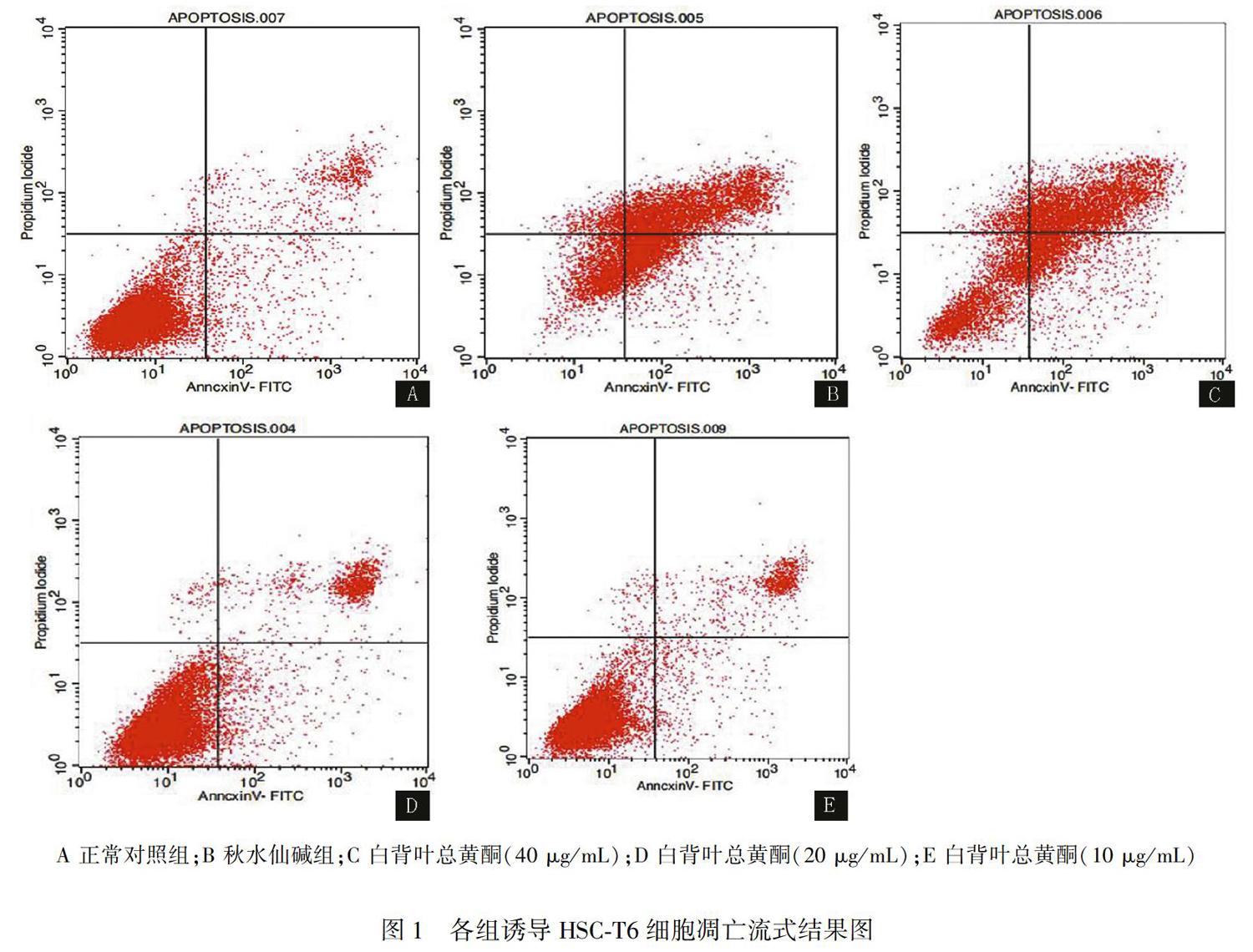
按上述方法消化离心细胞后,将细胞浓度调成1×105 个/mL,接种于6孔板中,每孔1 mL。设正常对照组、阳性对照组(秋水仙碱,终浓度为1 μg/mL)及白背叶总黄酮高、中、低浓度组(终浓度为40、20、10 μg/mL),每组3个复孔,继续于培养箱培养24 h,将上清液去掉后,正常对照组加DMEM 完全培养液,药物组加入对应的药物,均为1 mL,继续培养48 h。各组细胞用不含EDTA胰酶消化离心后,按试剂盒方法及要求进行染色,用流式细胞检测仪检测细胞凋亡情况。
1.6 ELISA法检测HSC-T6细胞COL-Ⅰ、COL-Ⅲ、TGF-β1、PDGF-BB的含量
按上述方法消化离心细胞后,将细胞调成0.5×105 cell/mL混悬液接种于96孔板,每孔100 μL,使孔内细胞数为5000个。将细胞分为正常对照组、阳性对照组(秋水仙碱 1 μg/mL)、白背叶总黄酮高、中、低浓度组(终浓度为40、20、10 μg/mL),每组3个复孔,置于37℃,5%浓度CO2培养箱培养24 h。待细胞贴壁后,除正常对照组加培养基,其余各组加相应的药物,均为100 μL,继续培养48 h后取细胞上清,按ELISA试剂盒方法测定COL-Ⅰ、COL-Ⅲ、TGF-β1、PDGF-BB浓度。
1.7 统计学方法
采用SPSS 16.0统计软件进行数据处理,计量资料符合正态分布,以均数±标准差(±s)表示,若方差齐性,多组间比较采用单因素方差分析,两组间均数比较用LSD-t检验,检验水准:α=0.05,双侧检验。
2 结 果
2.1 对HSC-T6细胞增殖作用的影响
与正常对照组比较,秋水仙碱阳性药OD值明显降低(抑制率明显升高),两组比较差异有统计学意义(P<0.001),提示本次实验研究是成功的;而白背叶总黄酮剂量组的OD 值也明显降低,呈一定程度的量效关系,各个剂量组与正常对照组比较,差异均有统计学意义(P<0.05或0.001)。根据各组抑制率求出IC50为84.5 μg/mL,根据IC50结果定出40、20、10 μg/mL 3个浓度进行下一步实验。见表1。
2.2 对HSC-T6细胞凋亡的影响
白背叶总黄酮40、20、10 μg/mL三个浓度下细胞早期凋亡率分别为19.62%、13.67%、7.80%,晚期凋亡率分别为44.10%、16.24%、11.21%,说明白背叶总黄酮对HSC-T6细胞增殖的抑制主要是通过诱导细胞凋亡,且均以晚期凋亡为主,细胞凋亡率与药物浓度呈正相关。见表2、图1。
2.3 对HSC-T6细胞COL-Ⅰ、COL-Ⅲ、TGF-β1、PDGF-BB分泌的影响
与正常对照组比较,阳性药秋水仙碱组的COL-Ⅰ、COL-Ⅲ、TGF-β1、PDGF-BB数值明显下降,除COL-Ⅰ数值外,COL-Ⅲ、TGF-β1、PDGF-BB数值与正常对照组比较差异均有统计学意义(P<0.001)。白背叶总黄酮40 μg/mL浓度作用下,能显著减少胶原COL-Ⅲ、TGF-β1、PDGF-BB的含量,与正常对照组比较差异有统计学意义(P<0.05);白背叶总黄酮20 μg/mL浓度作用下,对TGF-β1有显著抑制作用,与正常对照组比较差异有统计学意义(P<0.05);白背叶总黄酮10 μg/mL濃度作用下,对COL-Ⅰ、COL-Ⅲ、TGF-β1、PDGF-BB生成均无显著抑制作用,与正常对照组比较差异无统计学意义(P>0.05)。见表3。
3 讨 论
肝纤维化是多种肝脏疾病共有的病理生理过程。当肝脏受到损伤时,可导致肝纤维化细胞(HSC)由静息状态转为活化并增殖,继而导致肝组织细胞外基质(ECM)过度产生和沉积。随着肝脏纤维化程度加重,会由肝纤维化不可逆演变成肝硬化、肝癌。因此,在抗肝纤维化药物研究过程中,抑制HSC细胞的活化与增生已成为重要环节。
ECM 的主要成分以胶原蛋白为主,同时还有非胶原糖蛋白、蛋白多糖及弹性蛋白等。而胶原蛋白以Ⅰ、Ⅲ、Ⅳ型胶原为主,其中Ⅰ型胶原占胶原总量的60%~70%,Ⅲ型占20%~30%,因此Ⅰ、Ⅲ型胶原蛋白的表达水平可作为判断ECM的重要指标[8];血小板转化因子(PDGF)是由A、B两条多肽链组成的二聚体结构,存在AA、BB和AB 3种形式。其中PDGF-BB在促进HSC活化增殖作用最强[9]。当肝细胞受到损伤时,肝细胞释放过量PDGF,其会通过与HSC膜上特异性受体相结合,相应的信号因子被激活参与免疫应答,HSC发生有丝分裂,最终使ECM发生过度沉积,而致纤维化的发生;转化生长因子β1(TGF-β1)是目前公认最重要的致肝纤维化细胞因子[10],肝脏在正常情况下TGF-β1的表达极少,而肝损伤时其表达显著增加,进而使介导细胞增殖或细胞外基质生成的信号通路如Smads和p38/MAPK等通路打乱,促使HSC细胞大量增殖产生促纤维化作用,是肝纤维化形成的关键因子[11]。
本研究主要以大鼠肝星状细胞即HSC-T6细胞为模型,观察白背叶总黄酮抑制肝纤维细胞增殖的作用。结果提示,白背葉总黄酮通过诱导HSC-T6细胞凋亡而抑制其增殖,同时显著降低胶原蛋白COL-Ⅲ的表达水平及细胞因子TGF-β1、PDGF-BB的含量。
参 考 文 献
[1] 国家中医药管理局《中华本草》编委会.中华本草-5[M].上海:上海科学技术出版社,1999:827.
[2] 郑作文,伦玉宁,赵丽丽.白背叶提取物芹菜素对裸鼠人胃癌细胞移植瘤生长及凋亡的影响[J].中国实验方剂学杂志,2012,18(13):214-216.
[3] 章波,檀燕君,黄秋洁,等.白背叶根水提物对大鼠肝星状细胞活化及细胞外基质分泌的影响[J].中华中医药杂志,2019,34(9):4287-4290.
[4] 章波,檀燕君,邹洋,等.白背叶根水提物对四氯化碳诱导肝纤维化大鼠的保护作用研究[J].中药材,2018,41(7):1722-1726.
[5] 王志萍,冯桥,沈树虎,等.白背叶根提取物的体外抑菌试验[J].广西中医药,2012,35(3):55-56.
[6] 夏星,郑作文,谭为.白背叶提取物WF对2215细胞分泌HBsAg和HBeAg的影响[J].时珍国医国药,2010,21(3):631-632.
[7] 黄卓坚,王志萍,夏星,等.白背叶根提取物的抗炎机制初探[J].广西中医药大学学报,2014,17(1):81-83.
[8] 王乾宇,王文佳,奚锦,等.杜仲多糖对肝纤维化模型大鼠Ⅰ,Ⅲ型胶原蛋白,MMP-1,TIMP-1及TGF-β1 mRNA表达的影响[J].中国实验方剂学杂志,2018,24(23):153-158.
[9] 白鹃,丁辉,施京红,等.肝纤维化细胞因子参与机制及中药治疗研究进展[J].辽宁中医药大学学报,2020,22(1):158-162.
[10] SEKI E,SCHWABE R F.Hepatic inflammation and fibrosis:functional links and key pathways[J].Hepatology,2015,61(3):1066-1079.
[11] 张文涛,吴先昊,梁冰洁,等.藤茶总黄酮调控TGF-β1/Smad信号通路抗肝纤维化机制的研究[J].重庆医学,2019,48(9):1493-1499.
(收稿日期:2020-03-06 修回日期:2020-04-03)
(编辑:梁明佩)
基金项目:长沙市科技计划项目(kq1701070)
作者简介:谢稳,男,主管药师,医学学士,研究方向:中药制剂及质量控制。E-mail:414903961@qq.com
通信作者:严建业。E-mail:yanjianye201@126.com
[本文引用格式]谢稳,严建业.白背叶总黄酮对HSC-T6细胞增殖作用及胶原蛋白和细胞因子的影响[J].右江医学,2020,48(4):252-256.
