低剂量坎地沙坦对小鼠脑梗死使用重组组织型纤溶酶原激活剂溶栓的出血并发症的影响及机制
2020-05-18冯晓燕李蓉马涛
冯晓燕,李蓉,马涛
急性脑梗死具有较高的致残率和致死率。重组组织型纤溶酶原激活剂(rt-PA)静脉溶栓目前被循证医学认为是血管再通的首选方法(Ⅰ级推荐,A级证据)[1],符合静脉溶栓和取栓指征的患者应先接受rt-PA静脉溶栓治疗(Ⅰ级推荐,A级证据)[2]。然而rt-PA可致严重并发症——出血转化,大大限制了其临床应用。近年研究发现,坎地沙坦(Cand)是AT1受体阻滞剂,对脑缺血具有保护作用[3]。但Cand对急性脑梗死溶栓出血并发症的保护作用及机制仍有待进一步研究。
血浆激肽释放酶(PKal)是激肽释放酶-激肽系统的主要限速酶,与肾素-血管紧张素-醛固酮系统相互拮抗,可扩张小动脉、增加血管通透性,使血管舒张[4-5]。PKal已被证实是急性脑梗死rt-PA溶栓后出血并发症的关键病理分子之一[5]。RAS的主要效应蛋白是血管紧张素Ⅱ(AngⅡ),Cand作为血管紧张素1型受体(AT1R)阻滞剂,可阻断AngⅡ与AT1R结合。AngⅡ可以加重脑血管渗漏[6]。Phipps等[7]发现,玻璃体液中AngⅡ-AT1R/PKal的上调可以通过AngⅡ-AT1R激活PKal途径加重SD大鼠的糖尿病视网膜病变,破坏血-视网膜屏障的完整性,增加血管壁的通透性,导致血-眼屏障渗透性增加;AT1R受体阻滞剂Cand可以通过抑制PKal上调保持血管壁的完整性,减少血-视网膜屏障的破坏。因此,本研究小组推测Cand可能可以通过减少AngⅡ-AT1R/PKal表达缓解rt-PA的溶栓出血并发症。本研究建立小鼠大脑中动脉栓塞(MCAO)缺血再灌注模型,探讨低剂量Cand对小鼠缺血再灌注后使用rt-PA出血并发症的影响及其作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组 选取相同遗传背景的健康成年WT雄性C57BL/6J小鼠160只,质量为23~26 g,由南通大学动物实验中心提供。按照随机数字表法分为对照组(56只)、rt-PA组(52只)、rt-PA+Cand组(52只)。
1.1.2 常用实验试剂及仪器 DAPI(美国Sigma公司);Pierce BCA Protein Assay Kit、免疫印迹化学发光试剂ECL(美国Thermo公司);Rabbit anti-AT1R antibody(中国Protein Tech公司);Mouse anti-beta actin antibody、Rabbit anti-B2R antibody(美国Abcam公司);Rabbit anti-PKal antibody(中国GeneTex公司);AffiniPure Donkey anti-Rabbit IgG(H+L)、AffiniPure Donkey anti-Mouse IgG(H+L)(美国JacksonImmuno公司);倒置生物显微镜(CKX31,日本Olympus公司);SDS-PAGE电泳及全湿转膜系统(美国Bio-Rad Laboratories公司);核酸蛋白定量检测仪(德国Eppendorf公司)。
1.2 方法
1.2.1 模型的制备 对照组取56只小鼠,rt-PA组和rt-PA+Cand组各取52只小鼠,采用线栓法制作MCAO模型[8],栓塞45 min后取出栓线。rt-PA组及rt-PA+Cand组小鼠MCAO术开始后2 h通过股静脉注射rt-PA(10 mg/kg),浓度为0.5 mg/ml,首次静脉团注10% rt-PA,剩下的90%以3 μl/min速度微量泵入,术后小鼠单独放回笼子饲养;rt-PA+Cand组术前予Cand 0.5 mg/(kg·d)口服2周。术后24 h采用Clark评分对小鼠进行行为学评分,分为一般功能损伤评分(0~28分)和局灶功能损伤评分(0~28分),评分内容包括外观、体位、自发活动、癫痫行为、身体对称性、攀爬、转圈行为、步态等。
1.2.2 出血转化评分 根据肉眼所见脑切片出血转化程度将小鼠分为:(1)0分:未见出血转化;(2)1分:出血性梗死1(HI-1),瘀斑沿梗死的边缘分散;(3)2分:出血性梗死2(HI-2),瘀斑更汇合,但分散的瘀斑仍然存在的梗死灶内;(4)3分:脑实质内血肿1(PH-1),血肿均匀覆盖,体积<梗死区的30%和轻度占位效应;(5)4分:脑实质内血肿2(PH-2),多个密集血肿病灶,体积>30%梗死区和显著占位效应。
1.2.3 脑组织血红蛋白浓度的检测 各组取5只小鼠,操作步骤参考血红蛋白测定试剂盒。各组小鼠取稀释应用液5 ml加入蛋白10 μl,回洗3次,混匀后静置5 min,双蒸水或稀释应用液调零,540 nm处测定各管吸光度值(A值)。血红蛋白(g/L)=吸光度×367.7。
1.2.4 伊文思蓝渗出浓度的检测 各组取6只小鼠,于处死前30 min股静脉注射2%伊文思蓝。30 min后给予10%水合氯醛腹腔注射,4 ℃ PBS灌注取脑后,将脑组织放入小鼠脑槽内包埋,冰冻切片观察伊文思蓝浸出情况。将脑组织置于二甲基甲酰胺60 ℃孵育24 h,1 000 r/min离心5 min,用分光光度计检测波长为620 nm的吸光度。
1.2.5 基质金属蛋白酶-9(MMP-9)及Claudin-5 mRNA的检测 各组取10只小鼠,收集脑组织0.1 g,加入液氮研磨充分后加入1 ml TRizol试剂,充分混匀静置。加入氯仿200 μl,室温静置5 min,12 000 r/min 4 ℃离心15 min。吸取无色上清液转移至另一新的离心管中,向上清中加入等体积的异丙醇,75%乙醇清洗,加入适量DEPC水溶解沉淀30 min左右,测RNA浓度。总RNA反转录:总RNA 1 μg,OligodT 2 μl,dNTP 2 μl加入无RNA酶的PCR管中,70 ℃反应5 min,冰上冷却2 min。再次加入5×buffer 4 μl,RNAsin 0.5 μl,M-MLV 1 μl,42 ℃反应50 min,95 ℃反应5 min,加入30 μl DEPC水,取2 μl做为模板。Real-time PCR采用三步法,以β-actin为内参。采用相对定量进行统计学分析,计算相对表达量(RQ=2-△△CT)。EXCLE软件分析数据,用Graphpad prism 6软件作图。
1.2.6 MMP-9及Claudin-5阳性细胞率的检测 各组取6只小鼠。小鼠术后24 h经左心室灌注后快速断头取脑,置于40 g/L多聚甲醛中固定10 min,石蜡包埋后连续冠状切片,片厚5 μm,表于载玻片,行免疫荧光。切片脱蜡水化后,0.2%~0.5% Triton in PBS,避光15 min破膜。滴加PBS稀释的牛血清封闭液,室温封闭1 h。滴加一抗孵育(0.3% Triton PBS稀释),4 ℃过夜,PBS洗片4次,分别为10 min、15 min、20 min、30 min。滴加二抗孵育(0.3% Triton PBS稀释),室温避光孵育2 h,PBS洗片4次,分别为10 min、15 min、20 min、30 min。细胞核由DAPI染色,Prolong封片,4 ℃或-20 ℃保存备用,于荧光显微镜下观察结果并采集图像,采用Imag J软件测定阳性细胞率。
1.2.7 血浆激肽释放酶(Pkal)、AngⅡ受体(AT1R)及缓激肽受体(B2R)表达的检测 各组取15只小鼠,采用Western-blotting法检测Pkal、AT1R、B2R表达。小鼠术后24 h经左心室灌注后快速断头取脑,RIPA裂解液提取组织蛋白。以BSA为标准,用BCA法进行蛋白定量。取30 μg蛋白样品,SDS-PAGE电泳,半干法转移至PVDF膜,将膜放入5%脱脂奶粉中室温封闭1~2 h,一抗4 ℃孵育过夜。TBST缓冲液洗膜后,将膜与驴抗鼠IgG稀释比为1∶6 000,驴抗兔IgG抗体稀释比为1∶5 000室温反应2 h。洗膜后用ECL化学发光法显影,凝胶成像系统拍照后采用Imag J软件测定条带吸光度作定量分析。
2 结 果
2.1 rt-PA组、rt-PA+Cand组及对照组小鼠神经行为学评分的比较 见表1。神经行为学评分结果显示,与rt-PA组比较,对照组及rt-PA+Cand组一般功能损伤评分和局灶功能损伤评分均显著降低(均P<0.01)。
2.2 rt-PA组、rt-PA+Cand组及对照组小鼠脑出血转化评分及血红蛋白浓度的比较 见表1、图1。与rt-PA组比较,对照组及rt-PA+Cand组出血转化评分和血红蛋白水平均显著降低(均P<0.01)。

表1 rt-PA组、rt-PA+Cand组及对照组小鼠神经行为学评分、出血转化评分、血红蛋白水平及伊文思蓝渗出浓度的比较(x±s)组别例数一般功能损伤评分(分)局灶功能损伤评分(分)出血转化评分(分)血红蛋白(g/L)伊文思蓝渗出浓度(μg/g)-rt-PA组2114.60±0.5515.60±3.852.60±0.5523.83±4.1215.77±1.52t-PA+Cand组219.20±1.48*9.60±1.14*1.40±0.55*18.46±0.66*11.79±1.92*对照组257.71±0.49*7.00±1.15*0.80±0.45*17.06±1.74*11.63±1.26* 注:与rt-PA组比较*P<0.01
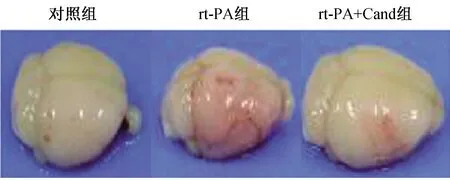
图1 rt-PA组、rt-PA+Cand组及对照组小鼠脑组织出血转化大体外观图 rt-PA组出血转化最明显
2.3 rt-PA组、rt-PA+Cand组及对照组小鼠伊文思蓝渗出浓度的比较 见表1、图2。伊文思蓝染色结果显示,与rt-PA组比较,对照组及rt-PA+Cand组渗出浓度显著降低(均P<0.01)。
2.4 rt-PA组、rt-PA+Cand组及对照组小鼠脑组织MMP-9及Claudin-5表达的比较 见图3、表2。与rt-PA组比较,对照组及rt-PA+Cand组MMP-9 mRNA相对表达量及阳性细胞率显著降低,Claudin-5 mRNA相对表达量及阳性细胞率显著升高(P<0.05~0.01)。
2.5 rt-PA组、rt-PA+Cand组及对照组小鼠脑组织Pkal、AT1R、B2R表达的比较 见表3、图4。 与rt-PA组比较,对照组及rt-PA+Cand组Pkal、AT1R、B2R表达显著降低(P<0.05~0.01)。
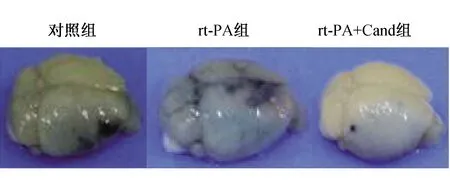
图2 rt-PA组、rt-PA+Cand组及对照组小鼠脑组织伊文思蓝渗出情况脑组织大体外观图 rt-PA组渗出最明显

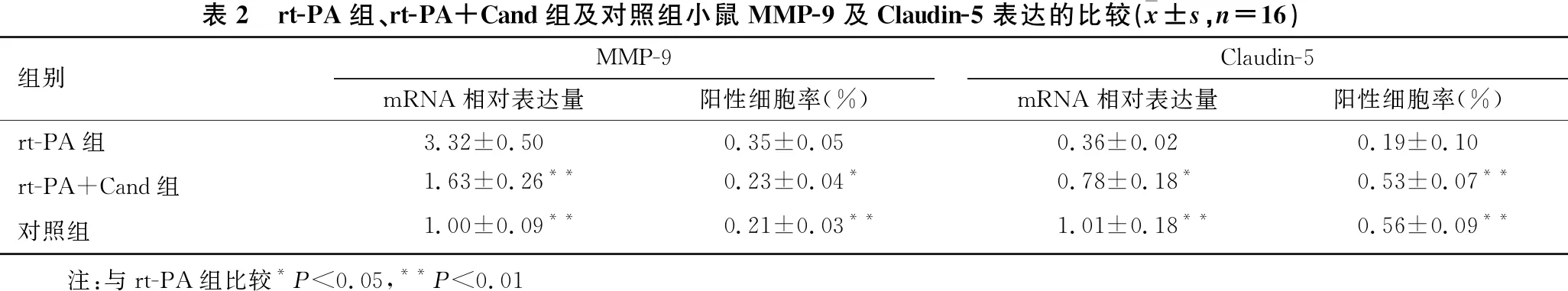
图3 rt-PA组、rt-PA+Cand组及对照组小鼠MMP-9和Claudin-5免疫荧光图 MMP-9为绿色荧光,DAPI为蓝色荧光
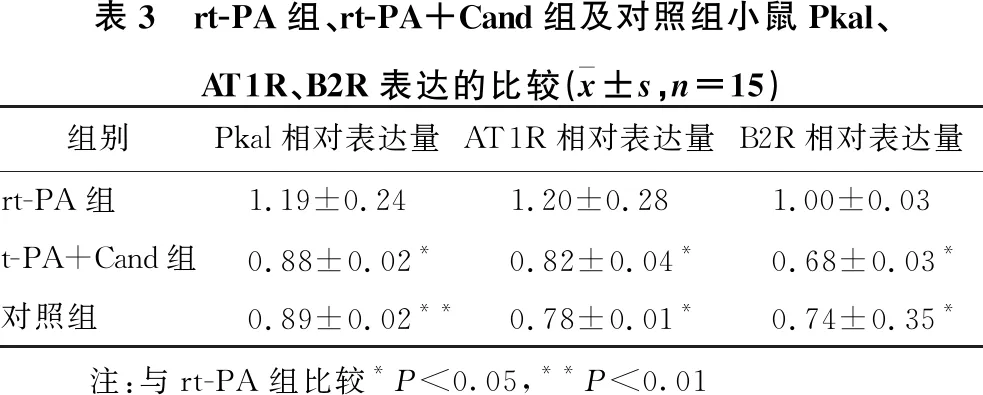
表3 rt-PA组、rt-PA+Cand组及对照组小鼠Pkal、AT1R、B2R表达的比较(x±s,n=15)组别Pkal相对表达量AT1R相对表达量B2R相对表达量rt-PA组1.19±0.241.20±0.281.00±0.03t-PA+Cand组0.88±0.02*0.82±0.04*0.68±0.03*对照组0.89±0.02**0.78±0.01*0.74±0.35* 注:与rt-PA组比较*P<0.05,**P<0.01
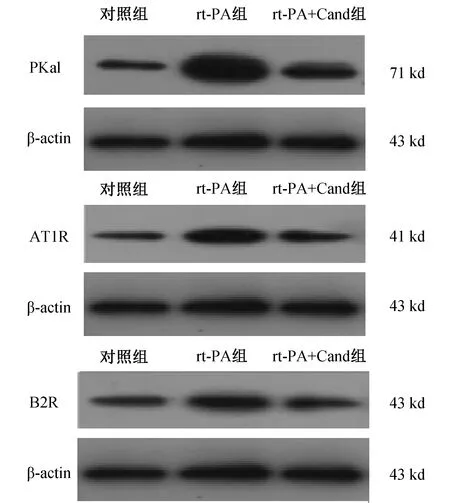
图4 rt-PA组、rt-PA+Cand组及对照组小鼠Pkal、AT1R、B2R电泳图
3 讨 论
本研究通过给小鼠预防性口服低剂量Cand(0.5 mg/kg)2周,发现联合口服低剂量Cand治疗能缓解缺血再灌注后使用rt-PA的脑出血并发症,减少缺血再灌注后使用rt-PA导致的脑组织内PKal的产生。
Cand是AT1受体阻滞剂,具有较强的脂溶性,易透过血-脑屏障,广泛用于脑缺血保护的相关研究。既往多项研究表明,Cand剂量在0.1~1 mg/kg时对血压影响小[9-10],因此本研究选择0.5 mg/kg的非降压剂量来进行实验。低剂量Cand治疗对血压影响较少,并可减轻大鼠脑缺血损伤,帮助远期神经功能恢复。一项随访12个月的临床研究发现,平时口服Cand治疗的急性脑卒中患者发生脑血管和心血管事件几率降低,这种获益是独立于血压存在的[11]。既往大部分研究是脑缺血再灌注后即时给予Cand治疗,预防性给药的研究罕见报道。因此,为了更好的模拟临床,本研究采用预防性口服Cand 2周。
rt-PA是目前治疗急性脑梗死最有效的办法。指南推荐在发生急性脑梗死4.5 h内使用rt-PA,尤其在3 h内获益较好,并发症较少;如果超过rt-PA的缺血再灌注时间窗,出血并发症和神经毒性显著增加。而在小鼠MCAO模型中,超过1 h的时间窗内静脉使用rt-PA,其出血转化及神经毒性明显增加,随着时间窗的延长,小鼠死亡率也显著上升[12-13]。因此,参考既往文献[12],本研究选择在MCAO开始后2 h使用rt-PA治疗,发现小鼠的神经功能缺失、脑出血转化体积较对照组明显增加。预防性口服低剂量Cand 2周后,其神经功能缺失、脑出血转化体积明显减少,提示预防性口服低剂量Cand可以一定程度上减轻rt-PA的神经毒性及出血并发症。
MMP-9被认为与缺血再灌注后使用rt-PA的出血转化和血-脑屏障破坏相关[14]。本研究发现,小鼠急性脑梗死缺血再灌注后使用rt-PA,脑组织MMP-9水平显著升高,出血转化体积明显增高。细胞紧密连接蛋白Claudin-5是脑血管内皮细胞最重要的调节因子之一,对血-脑屏障通透性可能起着至关重要的调节作用。本研究结果显示,rt-PA组脑组织Claudin-5表达减少,经过伊文思蓝染色的脑组织渗透增加。MMP-9、Claudin-5的变化表明rt-PA溶栓治疗导致血-脑屏障破坏明显增加。而经过预防性口服低剂量Cand治疗后,脑组织内MMP-9水平明显下调,Claudin-5表达显著上调,说明预防性使用低剂量Cand可以一定程度上减轻rt-PA对血-脑屏障的破坏。
PKal是选择性切割人激肽原的某些精氨酸和赖氨酸羧基一侧肽链生成缓激肽的酶。缓激肽与B2受体结合,与肾素-血管紧张素系统作用相拮抗[15],从而发挥广泛的生物学效应,增加血管通透性及神经源性水肿。最新研究表明,PKal增加可导致缺血再灌注后使用rt-PA的血-脑屏障破坏,增加rt-PA后出血转化[5],这与本研究结果一致。本研究结果显示,联合口服低剂量Cand后,脑组织Pkal表达明显下调,PKal产物缓激肽的受体B2R也明显下调,表明Cand可以调节缺血再灌注后使用rt-PA急性脑梗死脑组织PKal的表达,通过减少PKal生成保护血-脑屏障,进而减少出血转化的发生。AngⅡ也被广泛证实参与脑缺血,其可以加重脑血管渗漏[6]。本研究结果显示,缺血再灌注后使用rt-PA的AT1R表达明显上调,表明rt-PA可激活AT1R的表达。而Cand联合治疗小鼠血-脑屏障破坏减少,表明其可能通过阻断AT1R,减少AngⅡ与AT1R的结合来实现保护血-脑屏障,进而减少脑血管渗漏。
综上所述,口服低剂量Cand可通过减少PKal和AT1R的表达来保护血-脑屏障。Phipps等[7]发现,玻璃体液中AngⅡ/PKal的上调可以通过PKal途径介导AngⅡ-AT1R的激活加重SD大鼠的糖尿病视网膜病变,破坏血-视网膜屏障的完整性,增加血管壁的通透性,导致血-眼屏障渗透性增加,而AT1R受体阻滞剂Cand可以通过抑制PKal上调保持血管壁的完整性,减少血-视网膜屏障的破坏。血-视网膜屏障与血-脑屏障无论结构还是功能都有高度的相似性。因此,本研究小组推测Cand可能是通过调节PKal/AngⅡ-AT1R途径来减少脑缺血再灌注后使用rt-PA的出血并发症,这为防治脑梗死溶栓后的出血并发症提供了可能的新途径,但这仍需要进一步实验证实。
