不同浓度的糖对原代心肌细胞存活率的影响
2020-05-18杨晓敏
白 雪,杨晓敏
1.内蒙古科技大学包头医学院研究生院,内蒙古 包头 014040;2.包头医学院第二附属医院,内蒙古 包头 014030
原代心肌细胞的培养目前已成为心血管疾病基础研究的必要条件之一,根据研究目的在体外模拟疾病状态下心脏所处的环境,可建立各种心肌细胞的病理模型,以便更好地从细胞和分子水平等研究心血管疾病的发病机制。早在 1960 年,科学家 Harary 和 Farley[1]培养出了 Wister乳鼠心肌细胞,并提出了乳鼠原代心肌细胞的培养方法,然而这一传统方法所分离的心肌细胞存活率以及纯度低、细胞活性比较差等原因,不能满足基础实验研究的需求。1976年,科学家提出了成熟心室肌的培养方法,并在1977年由Jacobson成功培养出了心室肌细胞。到目前为止,原代心肌细胞的体外培养技术日渐成熟,所用的心肌细胞培养大多是在传统方法基础上进行改良,分别为单一酶消化法[2-3]和胶原酶与胰酶联合使用消化法[4-6]两种。但两种方法各有不足之处,为了培养出纯度高、存活率强能够满足实验需求的心肌细胞,结合本实验室的条件以及环境在传统的方法上进行了改进,现报告如下。
1 材料与方法
1.1 实验动物
取新生1~3 d的wistar大鼠,清洁级,雌雄不限,由北京华阜康生物科技股份有限公司提供,许可证号scxk(京)2014-0004。
1.2 实验试剂及主要仪器
Ⅱ型胶原酶(Gibco,1797342),低糖型DMEM(Gibco),胎牛血清(Fetal Bovine Serum,FBS,四季青),青链霉素双抗(HyClone),D-(+)-Glucose(Sigma),磷酸盐缓冲液(PBS),5-溴脱氧尿嘧啶核苷(5-Brdu,Sigma),4%多聚甲醛(博士德生物),α-actin 抗体兔来源(博士德生物),二氨基联苯胺(3,3'-diaminobenzidine,DAB)显色试剂盒,SABC(链霉亲和素-生物素-过氧化物酶复合物法)免疫组化试剂盒,二甲苯,TritonX-100(生工生物工程有限公司),37℃恒温水浴锅,磁力搅拌器,酶标仪(BIO-RAD),CO2培养箱(Thremo),医用超净工作台,荧光倒置显微镜(OLYMPUS-IX71),多功能台式高速离心机(Eppendorf,5804R0)等。
1.3 原代心肌细胞的培养
(1)准备3 个直径为60 mm 的培养皿加入10 ml 含双抗无血清的 DMEM 挤血用。(2) 取出生 1~3 d 的 wistar 乳鼠6只,颈部脱臼处死后,用75%酒精消毒两次,左手捏住颈部皮肤,右手持眼科剪沿胸骨中线剪开,左手轻轻挤压,右手持眼科镊轻轻将心脏取出即刻放入培养皿中,依次在第一、第二个培养基中轻轻挤压心脏排出积血,之后钝性分离心室心尖部位置,剪去心蒂部1/3~1/2,暂存于第三个平皿中。(3)将所有的心脏放入高压灭菌后的小烧杯中,加入1 ml 胶原酶。用眼科剪将所有心脏剪成0.5~1 mm3的大小的小块,再次加入2 ml 的胶原酶消化液,轻轻晃动小烧杯5~8次后弃去消化液。(4)再次加入3 ml胶原酶消化液,并用玻璃弯头吸管将心脏组织与消化液一同准入100 ml 的血清培养瓶中,放置于37℃恒温水浴锅中,消化8~10 min,期间轻轻晃动血清瓶,随后弃去消化液。(5)在培养瓶中再次加入3 ml 胶原酶消化液,继续消化10 min,期间每隔2 min轻轻晃动培养瓶60 s,将消化好的液体吸出加入事先准备好的两只50 ml 离心管中,离心管中提前加入18 ml 已温育好的含10%FBS 的低糖DMEM,均匀终止消化,重复以上步骤10次,直至组织被消化为白色絮状物为止。(6)收集10 次消化好的细胞800 r/min 离心5 min,弃掉上清后,每支离心管加入温育好的10%FBS的DMEM 6ml,重悬细胞混匀后经300 目滤网过滤,滤液加入到一次性培养瓶中,放于37℃培养箱中差速贴壁90 min。(7)取出培养瓶,轻轻晃动,用弯头吸管轻轻吸取上层悬液于15 ml离心管中混匀后,铺于带有爬片的24孔板中,每孔1 ml细胞液并加入终浓度为0.1 mmol/L的Brdu溶液10 ul,抑制成纤维细胞生长。24 h 后换10%FBS 的DMEM液体。
1.4 原代心肌细胞免疫组化鉴定
免疫组化采用横纹肌肌动蛋白(α-actin),兔来源抗体。细胞培养48 h后,将爬片取出,1×PBS洗去残留的血清及培养基。用预冷的4%多聚甲醛固定20 min。1×PBS漂洗,0.1%的Triton x-100 通透15 min,后经内源性过氧化物酶灭活,5%BSA液封闭,一抗以1∶100孵育,湿盒4℃过夜后加羊来源的二抗孵育,最后DAB 显色,苏木素复染,封片后显微镜拍照。
1.5 实验分组
正常细胞在含 10%FBS 的 DMEM 中培养 48~72 h 后,细胞换液为含1%FBS 的DMEM 饥饿24 h,然后设置不同糖浓度组,实验分为6组,分别为对照组基础培养基(含糖5.5 mmol/L),高糖组20 mmol/L,33 mmol/L,40 mmol/L,50 mmol/L,60 mmol/L。
1.6 倒置显微镜观察心肌细胞搏动频率与节律
记录高糖作用20 h、48 h、72 h后的心肌细胞在1 min内的搏动次数,同一糖浓度的不同视野中选取5个细胞计数搏动频率。
1.7 MTT检测不同组的细胞存活率
将消化好的原代心肌细胞进行计数,计数范围在105~106,细胞稀释后每孔加200 ul,最终保证每孔的有效细胞数为102~104之间。空白调零孔只加不含细胞的基础培养基。实验分组处理后(每组设置三个复孔),每个孔中加入5 g/L的MTT溶液20 ul,继续培养4 h后,小心吸去孔中所有液体,吸干净后,加入150 ulDMSO,室温摇床摇10 min,使结晶充分溶解,酶标仪测490 nm 处吸光度(OD)值。计算细胞存活率,细胞存活率=(实验组OD值-空白组OD值/对照组OD值-空白组OD值)×100%。
1.8 统计学方法
采用SPSS 19.0 软件进行统计分析。计量资料以均数±标准差()表示,组间比较采用单因素方差One way-ANOVA分析,以P<0.05为差异有统计学意义。
2 结果
2.1 显微镜下细胞形态
消化好的心肌细胞镜下为亮圆形;培养12 h后开始贴壁,部分细胞伸出伪足,形态以圆形和三角形多见;18 h小时后开始出现搏动,24 h后已基本贴壁;培养48 h后细胞搏动明显,平均搏动(85±7)次/min,呈典型的梭型状,也有细胞呈团簇状生长,立体感十分明显,收缩强劲有力,成纤维细胞无立体感。培养5 d 后,细胞成团状搏动频率一致,见图1。
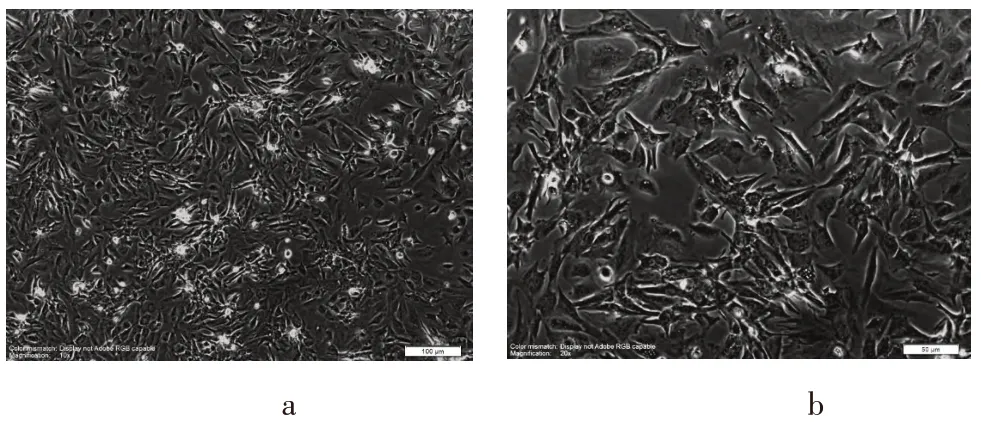
图1 原代心肌细胞培养48 h后形态图
2.2 心肌细胞免疫组化鉴定
免疫组化鉴定心肌细胞a-actin 表达阳性细胞呈现棕色,如图2a,图2b 阳性率在95%以上,而成纤维细胞则不表达,如图2c中箭头所指,见图2。
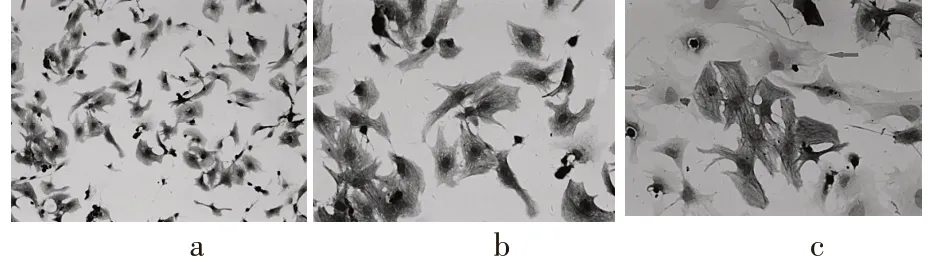
图2 心肌细胞与成纤维细胞免疫组化鉴定
2.3 糖对心肌细胞搏动次数的影响
高糖作用20 h 时,糖浓度为40 mmol/L、50 mmol/L、60 mmol/L 的心肌每分钟搏动次数明显加快,为(153±7)次/min,(138 ± 7)次/min,(113 ± 5)次/min 与 对 照 组5.5 mmol/L(36±5)次/min 的糖浓度相比差异有统计学意义(P<0.05);高糖作用48 h 时,糖浓度为40 mmol/L、50 mmol/L、60 mmol/L 组心肌搏动次数显著下降,分别为(40±4)次/min,(50±3)次/min,(40±4)次/min与对照组(109±3)次/min 相比差异有统计学意义(P<0.01),高糖作用48 h糖浓度为20 mmol/L和33 mmol/L两组、40 mmol/L 和60 mmol/L 两组之间细胞搏动次数差异无统计学意义(P>0.05);高糖作用72 h 后,与对照组5.5 mmol/L 糖浓度相比,实验组心肌搏动次数明显低于对照组(P<0.05),且搏动频率不一致、不规律,表现为异常自律性,见图3。
2.4 各组细胞MTT结果
分组后培养48 h,与对照组相比,高糖组20 mmol/L、33 mmol/L、40 mmol/L、50 mmol/L、60 mmol/LOD 值逐渐下降(P<0.01),细胞存活率明显降低(P<0.05),以50 mmol/L和60 mmol/L下降最明显,分别为(50.5%±4.7)和(48.7%±9.8),见图4。
3 讨论

图3 不同浓度糖作用20 h、48 h、72 h后心肌细胞每分钟搏动次数
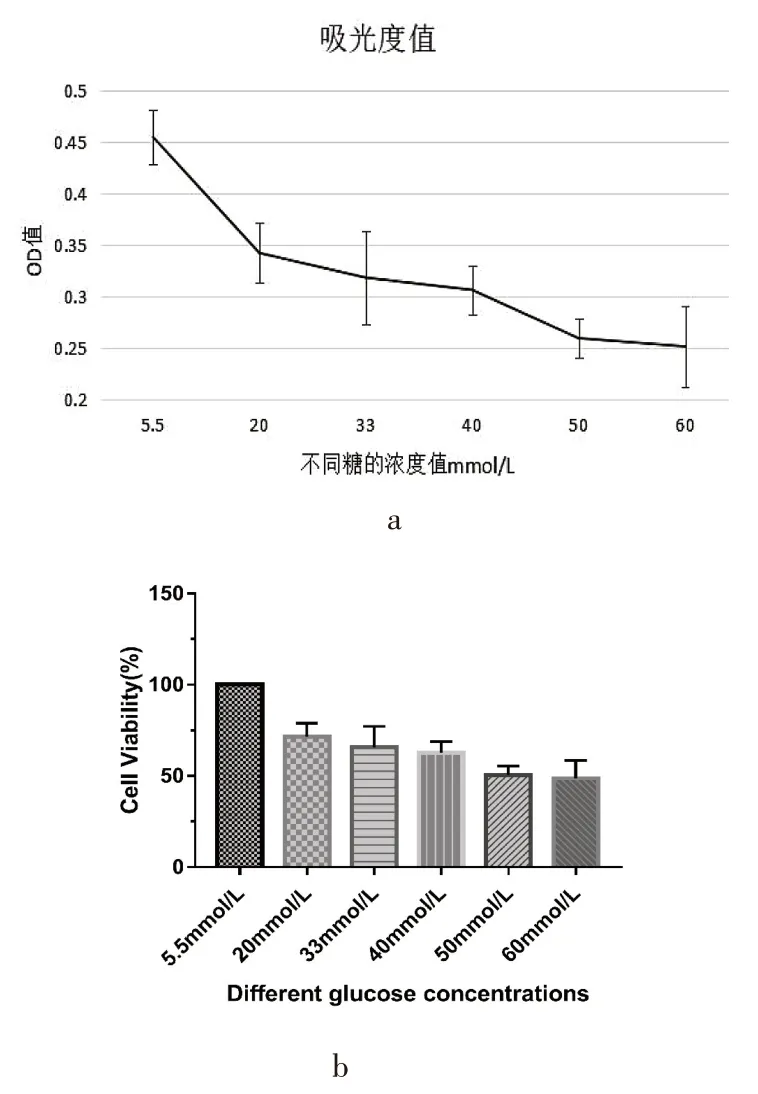
图4 高糖作用48 h后心肌细胞存活率
原代心肌细胞培养作为心血管疾病发生的分子机制研究发挥着不可替代的作用,在排除神经、体液等因素的影响,保持完整的心肌的结构与功能观察药物或者毒物对心肌的作用影响等,是一项重要的体外基础试验。高效率的培养方法是实验开展的基础条件。对于乳鼠的选择,我们认为成年的大鼠心脏不具备分裂增殖能力,属于终末分化细胞[7],大鼠出生年龄越短其心肌细胞分离后的存活能力越强,越容易贴壁生长,因此选择大鼠新生1~2 d 的乳鼠分离心脏培养心肌细胞。同时要选择具有正常生育周期、哺乳周期的大鼠,这样才可以繁殖出状态最好的乳鼠。对于实验胶原酶的选择,我们选用Ⅱ型胶原酶,配制成0.06%的浓度消化,其作用温和短时多次消化可以消化完全,增加细胞产量,同时做到对细胞最小的损伤。实验成功的关键点之一即做到无菌操作,所有用到的器械、培养瓶、烧杯都要经过高压灭菌,紫外照射除菌。
本实验探讨了不同糖浓度的培养基对原代心肌细胞增殖的影响,在基础培养基培养48~72 h 之后,细胞跳动次数达80次/min,换成低营养的培养基饥饿培养24 h后,分为不同糖浓度组,继续培养的20 h、48 h、72 h后,细胞的跳动具有明显差异,尤以40 mmol/L、50 mmol/L、60 mmol/L表现最明显,这三组在分组后的20 h之内搏动频率快速增加,到20 h达到峰值,之后一直到72 h搏动频率快速下降,且在48 h之后心肌搏动不规律,表现为异常的自律性。而对照组即用基础培养基培养的细胞随着时间延长,搏动次数逐渐增加最后趋于稳定,心肌搏动频率一致,活力较高糖组好。MTT 检测细胞存活率,高糖作用48 h 后,设对照组细胞存活率为100%,高糖组心肌细胞存活率与对照组相比明显下降,表明高糖抑制细胞的增殖。高糖环境对细胞的损伤是多方面的,但其具体的机制目前尚不清楚[8],可能的原因有高糖的糖毒性增加了心肌细胞的氧化应激、细胞的凋亡等[9-11],有研究显示[12],高糖条件下,c-Src/PI3K/ERK通路表达失调是高糖对细胞造成损伤的一个原因。高糖导致的内质网应激、晚期糖基化终末产物增加都会导致心肌细胞的损伤,高糖抑制细胞的增殖导致心肌细胞搏动节律性改变的具体分子机制,有待课题组进一步探讨探究。
