铝酸钠溶液净化除锂及其反应机理研究
2020-05-18唐文奇彭志宏刘桂华周秋生齐天贵李小斌
唐文奇,彭志宏,刘桂华,周秋生,齐天贵,李小斌
(中南大学冶金与环境学院,难冶有色金属资源高效利用国家工程实验室,湖南长沙,410083)
我国铝土矿资源中,大多数铝土矿中锂含量较高(Li2O 质量分数为0.016%~0.030%)。在拜耳法溶出过程中,铝土矿中的锂约有80%会进入铝酸钠溶液中[1-3]。进入铝酸钠溶液中的锂在晶种分解时会析出进入氢氧化铝中,这将导致焙烧后的氧化铝产品中锂含量过高。在后续铝电解过程中,锂会在电解槽中积累[4],造成电解质中锂含量升高,大部分生产企业电解质中氟化锂质量分数超过3%,最高达8%~10%[5-7]。电解质体系中的锂含量过高会导致电解槽温度与电解质的熔点下降,氧化铝的溶解度降低,并且会使电解槽炉底沉淀增多,导致电解工艺操作难度增大,铝电解槽稳定性变差,技术条件难以保持,对生产稳定和节能降耗十分不利[8-11],部分电解铝企业甚至被迫弃用高锂含量氧化铝原料[12],所以,研究铝酸钠溶液净化除锂具有重要意义。相关学者研究了锂在铝酸钠溶液中的存在形式及其变化规律,如:VAN STRATEN 等[13]发现锂在铝酸钠溶液中以锂离子形式存在,并易与Al(OH)4-反应生成LiA12(OH)7∙2H2O沉淀;PRESTIDGE等[14]发现在极稀的铝酸钠溶液中,锂离子能促进拜尔石的析出和长大,并部分与拜尔石一起析出;HUANG等[15]发现升高温度、增大苛性碱质量浓度或减小氧化铝质量浓度都有助于提高铝酸钠溶液中锂离子的质量浓度;在晶种分解9 h后,铝酸钠溶液中锂离子质量浓度仅为35 mg/L,且随着铝酸钠溶液中锂离子质量浓度增加,溶液的晶种分解率和氢氧化铝中锂含量均增大[16]。而对于铝酸钠溶液中除锂的研究,宁夏[17]在铝酸钠溶液中添加FeSO4∙7H2O 和Na3PO4∙12H2O 与Li+共沉淀,控制Li+,Fe2+和PO43-物质的量比为1׃4׃4、温度为70 ℃、反应时间为2 h,沉锂率可达90%,但该法同时会给铝酸钠溶液中带入杂质离子;采用高比表面γ-Al2O3吸附铝酸钠溶液中的锂,并将溶液温度控制在80 ℃左右,锂吸附率可达71.14%。而在盐湖卤水提锂过程中,可在卤水中加入无定型氢氧化铝对锂进行高效吸附,获得LiCl∙2Al(OH)3⋅nH2O沉淀,之后再进行铝锂分离,从而达到提取锂的目的[18-20]。本文作者采用高活性氢氧化铝对铝酸钠溶液中的锂进行净化沉淀,考察温度、时间、添加量、苛性比对沉锂效果的影响,确定较适宜的沉锂参数条件,并对沉锂过程的动力学进行分析,探讨净化沉锂的机理,为下一步实现铝酸钠溶液中锂的资源化综合利用提供理论和技术支撑。
1 实验
1.1 实验原料和设备
实验原料为:Al(OH)3和NaOH,均为工业级(中国铝业中州分公司生产);NaHCO3和Li2SO4∙H2O,均为分析纯(国药集团化学试剂有限公司生产)。设备为DY-8 低压反应群釜(中南大学机械厂制造)。
1.2 含锂铝酸钠溶液的配制
根据溶液中所需苛性比αk(即溶液中Na2Ok与Al2O3物质的量比),将工业级氢氧化铝、工业级氢氧化钠和水按照一定比例加至不锈钢桶内,加热煮沸至溶液清亮,得到浓铝酸钠溶液。使用时,将溶液稀释至苛性碱质量浓度为150~160 g/L,并趁热加入一定量的Li2SO4∙H2O,搅拌溶解,得到后续实验所需的含锂铝酸钠溶液,锂的质量分数为50×10-6。
1.3 高活性氢氧化铝的制备
将一定质量浓度的NaHCO3溶液加入已配置好的纯铝酸钠溶液中(NaHCO3溶液与铝酸钠溶液体积比为1:2),在室温下搅拌10 min可获得高活性氢氧化铝。经检测,获得的高活性氢氧化铝的平均粒度d(0.5)=3.55 μm,比表面积为42.074 m2/g,其SEM图如图1 所示。从图1 可见:颗粒呈不规则形状,表面存在缺陷,具有较多活性点。通过调控不同质量浓度的NaHCO3溶液可合成不同量的高活性氢氧化铝浆液,一般来说,加入的NaHCO3质量浓度越高,获得的Al(OH)3量也越多。将由不同NaHCO3质量浓度制得的Al(OH)3浆液过滤,烘干,称质量,结果如表1所示。
1.4 实验方法
实验在低压反应群釜内进行。先在低压弹内加入100 mL 已配好的含锂铝酸钠溶液,再往溶液中加入10 mL高活性氢氧化铝浆液。随后,将低压弹放至低压反应群釜,并控制相应的温度以及转动速率。反应一段时间后把低压弹取出,将反应后的溶液进行抽滤。滤液定容稀释后,进行分析检测。抽滤获得的渣烘干后,进行形貌和物相分析。

图1 高活性氢氧化铝的SEM图Fig.1 SEM image of high activity aluminum hydroxide
根据反应前后溶液中锂的质量浓度来计算沉锂率ηLi,按下式计算:

式中:ρ1和ρ2分别为反应前、后溶液中锂质量浓度,mg/L;V1和V2分别为反应前、后溶液稀释体积,L。
沉锂过程中铝酸钠溶液的水解率可利用反应前后溶液苛性比αk计算,用ηAl2O3表示,

式中:αka和αkm分别为反应前、后铝酸钠溶液的苛性比。
1.5 检测方法
利用滴定法测量溶液中的Na2Ok和Al2O3质量浓度,并计算相应的αk。通过使用电感耦合等离子体发射光谱仪(ICAP7400,美国Radial-赛默飞世尔科技公司)检测稀释滤液中锂的质量浓度。通过使用Rigaku-TTRⅢ型X线衍射仪(XRD,日本株式会社,铜靶)分析物相成分。通过使用JSM-6360LV型高低真空扫描电子显微镜(日本电子公司)观察沉锂渣形貌和分布情况。
2 结果和讨论
2.1 温度和时间对沉锂的影响
首先研究温度对沉锂反应的影响,控制溶液初始αk为1.45,高活性氢氧化铝添加量为1.3 g/L,结果见图2。由图2 可知:沉锂率均随着反应时间延长而增大;温度越高,沉锂率反而越低;当温度为348 K 时对应沉锂率最高,在反应180 min 后达到87.17%,而在363 K 时沉锂率最低;反应180 min后,沉锂率只有74.17%。

图2 温度对沉锂率ηLi的影响Fig.2 Effect of temperature on lithium deposition rate
但低αk溶液不稳定,在温度较低时易产生水解。沉锂过程中水解率变化见图3。由图3 可知:温度越低,时间越长,水解程度越大;当温度为348 K 时,反应180 min 后溶液中水解率ηAl2O3达14.7%。这是因为当温度较低并且随着时间的延长,铝酸钠溶液的不稳定性导致溶液中铝酸根离子水解生成Al(OH)3,并且Al(OH)3的产生也有助于沉锂反应的进行。
在除锂的过程中,若铝酸根离子产生过多水解会造成铝酸钠溶液中铝的损失加大,且不利于后续铝锂分离。而在反应时间120 min 内,353,358 和363 K 这3 种温度所对应的ηAl2O3较接近,且均小于5%,说明在这个范围内铝酸根离子水解较少。因此,结合反应中的沉锂率和水解率,经综合权衡,当可控制温度为353 K 以及反应时间为120 min 时,可获得较高沉锂率,同时,能使溶液中铝酸根离子产生较少的水解。

图3 沉锂过程中水解率ηAl2O3变化Fig.3 Change of hydrolysis rate during lithium deposition
2.2 高活性氢氧化铝添加量对沉锂的影响
当温度为353 K时,在αk为1.45的铝酸钠溶液中,高活性氢氧化铝添加量(即加入的高活性氢氧化铝浆液中对应的干基质量与含锂铝酸钠溶液体积的比值)与时间对沉锂率的影响如图4 所示。从图4可见:随着添加量加大,反应时间延长,沉锂率均随之增大。需要指出的是,在反应120 min后,所有不同添加量所对应的沉锂率均变化缓慢,随后保持稳定,其中,当添加量为1.3,1.9 和2.7 g/L 时,沉锂率较接近。这是因为添加量较高时,溶液中高活性氢氧化铝较多,在短时间内结晶成核速率快,从而使得沉锂率高。而理论上只需1.1 g/L 高活性氢氧化铝即可与质量分数为50×10-6锂离子反应完全,因此,随着时间延长,过量的高活性氢氧化铝对成核将无显著效果。经综合考虑,可选取高活性氢氧化铝添加量为1.3 g/L 来沉淀溶液中的锂。
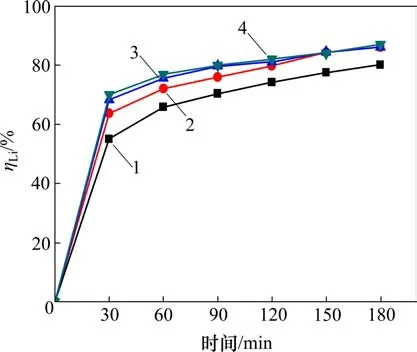
图4 高活性氢氧化铝添加量对沉锂率ηLi的影响Fig.4 Effect of addition of high active aluminium hydroxide on lithium deposition rate
2.3 溶液αk对沉锂率的影响
配置不同苛性比αk的含锂铝酸钠溶液,在温度为353 K,高活性氢氧化铝添加量为1.3 g/L 时,考察溶液中苛性比αk对沉锂率的影响,如图5 所示。从图5 可见:溶液中αk越大,沉锂率也越大。这表明溶液中游离碱含量升高,有利于沉锂反应的进行。但结合氧化铝生产实践[21],大部分铝土矿溶出后的铝酸钠溶液αk较低,通常在1.45左右。

图5 溶液αk对沉锂率的影响Fig.5 Effect of caustic ratio on lithium deposition rate
3 沉锂反应机理
3.1 沉锂产物表征
在较适宜沉锂条件(即溶液初始αk为1.45,温度为353 K,高活性氢氧化铝添加量为1.3 g/L,反应时间为120 min)下,将获得的沉锂渣干燥后进行XRD分析,结果如图6所示。从图6可见:沉锂产物的主要物相成分为Li2Al4(CO3)(OH)12∙3H2O,且具有较好的结晶形态。沉锂渣的SEM 图如图7 所示。从图7可观察到沉锂渣主要以片状交叉或片状重叠形式富聚在一起。经检测,沉锂渣平均粒度d(0.5)为28.36 μm,比表面积为3.91 m2/g。因此,结合图1、图6 和图7,可判定沉锂反应主要是由高活性氢氧化铝浆液中的Al(OH)3以及CO32-与含锂铝酸钠溶液中的Li+以非均相成核方式结晶长大,最终形成化合物沉淀。含锂铝酸钠溶液在加入高活性氢氧化铝后的化学反应式可表示为

图6 沉锂渣XRD图Fig.6 XRD pattern of lithium slag

图7 沉锂渣的SEM图Fig.7 SEM image of lithium slag

3.2 动力学模型的选择
氢氧化铝沉锂过程的等温结晶动力学可用Avrami 动力学模型描述:

式中:k为结晶速率常数,min-n;t为反应时间,min;ηLi为沉锂率;n为Avrami 指数,与成核机理和生长方式有关。对式(4)两边取对数,可得

将lg[-ln(1-ηLi)]对lgt作图,根据所得直线的斜率和截距可确定Avrami 指数n和动力学速率常数k。利用不同条件下的沉锂率与时间关系,可构建相关沉锂过程动力学模型[22-23]。
3.3 动力学模型的验证
将不同温度、高活性氢氧化铝添加量、溶液的苛性比条件下的沉锂率分别与反应时间采用Avrami 动力学方程进行拟合,其拟合曲线分别如图8、图9和图10所示,根据各曲线的斜率和截距可计算出各动力学参数,其结果及拟合程度分别如表2~4所示。从图8~10可看出:在实验时间内,沉锂反应均符合Avrami 方程,能很好地对结晶成核过程进行描述。Avrami 指数n理论上为整数1,2,3等,通常n=1为棒状和柱状晶粒,n=2为盘状晶粒,n=3为球状晶粒。但许多实验表明,实际结晶过程较复杂,成核不可能完全按一种方式进行。因此,在一般情况下,Avrami 指数不为整数,通常为小数。

图8 不同反应温度下lg[-ln(1-ηLi)]与lgt的关系Fig.8 Relationship between lg[-ln(1-ηLi)]and lgt at different temperatures
从表2~4可看出:随着反应温度、高活性氢氧化铝添加量、溶液苛性比增大,结晶速率常数k不断增大;而Avrami指数n最高为0.41,小于1,可以说明反应中的晶体为一维生长[24],并且反应温度与表观速率常数的关系通常可用Arrhenius 经验式[25]表示:

图9 不同高活性氢氧化铝质量浓度下lg[-ln(1-ηLi)]与lgt的关系Fig.9 Relationship between lg[-ln(1-ηLi)]and lgt with different mass concentration of high active aluminium hydroxid

图10 不同溶液苛性比下lg[-ln(1-ηLi)]与lgt的关系Fig.10 Relationship between lg[-ln(1-ηLi)]and lgt corresponding to different caustic ratios

表2 不同温度下的动力学参数Table 2 Kinetic parameters at different temperatures

表3 不同添加量下的动力学参数Table 3 Kinetic parameters at different additions

表4 不同苛性比αk下的动力学参数Table 4 Kinetic parameters at different caustic ratios

式中:k为温度为T时反应的表观速率常数,min-1;R为摩尔气体常数,J/(mol∙K);T为反应温度,K;A为指前因子,min-1;Ea为表观活化能,J/mol。
对式(6)两边取对数,可得

根据表2 数据,将lnk与T-1作图,如图11 所示。由图11 中拟合直线的斜率和截距可计算得出反应表观活化能Ea=16.474 kJ/mol,指前因子A=160.355 min-1,反应表观速率常数可表示为k=

图11 反应表观速率常数与温度的关系Fig.11 Relationship between apparent rate constant and temperature
4 结论
1)在苛性比为1.45 的铝酸钠溶液中,控制温度为353 K,高活性氢氧化铝添加量为1.3 g/L,反应时间为120 min,除锂率能达80.04%,且溶液中铝酸根离子的水解率仅为4.9%。
2)高活性氢氧化铝能与铝酸钠溶液中的锂离子反应形成Li2Al4(CO3)(OH)12∙3H2O 沉淀,且主要以片状交叉或片状重叠形式聚集。
3)随着温度升高和溶液中αk增大以及高活性氢氧化铝添加量增加,反应速率常数也随之增大。在温度为348~363 K 时,反应表观活化能Ea=16.474 kJ/mol,指前因子A=160.355 min-1,Avrami指数最高可达0.41,速率常数可用方程k=160.355×表示。
