核酸杂交介导的荧光信号放大方法在生物检测中的应用研究进展
2020-05-18许恒毅朱新根张晶晶
许恒毅, 余 双, 李 晖, 朱新根, 张晶晶
(食品科学与技术国家重点实验室,南昌大学,江西 南昌330047)
随着纳米技术、核酸自组装技术和生物传感器技术等研究的不断深入,发展基于其的新分析方法和技术,实现对目标物更快速,更灵敏和更准确的检测已成为科研工作者面临的新挑战[1]。基于荧光信号的检测方法因具有灵敏度高,特异性强及定量精准等优点,受到生物,化工,医药等领域研究者的广泛关注[2]。由于常规基于荧光的检测手段中,信号分子与被检物一般以1∶1的比例结合,无法实现对痕量目标物的检测,因此其检测灵敏度受到一定的限制。为了进一步提高检测灵敏度,研究者们构建了一系列核酸杂交介导的荧光信号放大检测平台,广泛应用于检测核酸、蛋白质、微生物等。作者对核酸杂交介导的荧光信号放大方法在生物样品检测中应用的情况进行了综述,旨在为该方法在实际检测中的应用研究提供参考。
1 核酸杂交介导的荧光信号放大方法的分类
核酸杂交介导的荧光信号放大方法是指通过目标物触发或阻断核酸杂交反应,引起核酸杂交产物上标记的荧光信号分子数目发生变化,实现对目标物定量检测的方法。其主要特点是:反应过程中单个目标物的存在即可引起多个信号分子的荧光值发生变化,从而实现荧光信号放大。根据荧光信号分子与核酸结合方式的不同,该方法可分为嵌入型和修饰型两类。为方便读者理解,图1以杂交链式反应(Hybridization chain reaction,HCR)介导的几种荧光信号放大方法为例进行说明。

图1 几种HCR介导的荧光信号放大方法Fig.1 HCR-mediated fluorescence signal amplification methods
1.1 嵌入型
嵌入型荧光信号放大方法是指基于荧光信号分子嵌入核酸引起体系荧光信号发生变化的信号放大方法,其原理是:当目标物存在时,引发或阻断核酸分子杂交,使核酸分子中荧光信号分子的嵌入量改变,从而引起荧光信号发生变化。该类方法常用到的荧光信号分子包括核酸荧光嵌入型染料和金属纳米团簇两种。核酸荧光嵌入型染料是指能通过与碱基或磷酸骨架结合嵌入DNA或RNA分子中的荧光染料,其中常用的核酸荧光嵌入型染料有7类,分别为:菲锭类荧光染料,双苯并咪唑及与其搭配使用的荧光染料,4,6-二氨基-2-苯基吲哚,色霉素A3和光神霉素,哌洛宁,海藻类蛋白和菁染料[3]。金属纳米团簇是由几个到几十个金属原子构成的相对稳定纳米聚集体,粒径一般小于2 nm,因制备过程简便,荧光产率高,已被广泛应用于生物、化工等研究领域。
1.2 修饰型
随着生物体基因库的完善,人工设计及合成工艺的提高,荧光探针设计与合成技术得到了飞速发展。由于核酸杂交的可设计性和高特异性,核酸荧光探针技术已广泛应用于生物样品的检测。荧光探针法检测原理一般分为两种:(1)直接检测,通过将荧光基团直接标记于核酸探针末端或中端,当目标物存在时,引发或阻断核酸杂交反应,从而引起荧光信号发生变化;(2)基于荧光共振能量转移(Fluorescence resonance energy transfer,FRET), 通过将荧光基团标记于核酸分子一端形成荧光核酸探针,目标物引发或阻断核酸杂交反应,荧光基团与荧光淬灭分子的距离发生变化,引发或阻断FRET,从而引起荧光信号发生变化[4]。该类方法中,常见的荧光探针一般通过修饰荧光染料制备,但常见的荧光染料存在光稳定性差的缺陷,因此开发光稳定性好的荧光材料用于合成荧光核酸探针具有重大意义。量子点(Quantum dot,QD)作为一种新型的纳米材料,具有颜色丰富,稳定性好,荧光强度高和生物相容性好等优点,且有研究表明QD可稳定标记在肽链或脱氧核糖核苷酸长链上[5-6],因此有望替代传统荧光染料,用于合成核酸荧光探针,克服传统荧光染料易光漂白的缺陷。
2 核酸杂交介导的荧光信号放大方法的应用
核酸杂交介导的荧光信号放大方法已成为生物样品检测的热门方法,由于该方法具有设计灵活,特异性好和灵敏度高等优点,已成功应用于多种目标物的检测,如细菌,核酸,蛋白质,生物小分子和无机金属离子等。表1详细总结了核酸杂交介导的荧光信号放大方法在不同目标物检测中的应用。
2.1 细菌全菌检测
细菌检测在食品,医药和环境安全等领域意义重大,传统微生物检测方法耗时长,工作量大,难以适应快速检测的需求[22],核酸杂交介导的荧光信号放大方法作为一种快速灵敏的检测手段能有效实现细菌检测。根据识别机制的不同,基于核酸杂交的荧光信号放大方法在细菌全菌检测中的应用主要分为抗原抗体识别型和核酸适配体识别型两类:(1)抗原抗体识别型,该类方法通过特异性抗体识别细菌,从而触发或阻断核酸杂交反应,引起体系荧光信号值变化,从而实现对细菌的定量检测。Wen等[23]建立了一种基于催化发夹型DNA自组装反应(Catalyzed hairpin assembly,CHA) 的双抗夹心免疫法用于检测河水中的希瓦氏菌,在此研究中,巧妙设计3个末端修饰有脱硫生物素的发夹探针,经过CHA反应,形成大量量子点的聚合物,从而实现荧光信号放大的目的,该方法对目标菌的最低检测限为1.37 CFU/mL,且具有较好的重现性(原理图见图2(a))。 (2)核酸适配体识别型,该类方法通过特异性核酸适配体识别细菌,触发或阻断核酸杂交反应,引起荧光信号值变化,从而实现对细菌的定量检测。Zhang等[24]构建了一种基于触发序列诱导的链置换扩增技术 (Trigger sequence-induced strand displacement amplification,T-SDA)和银纳米簇的方法用于检测鼠伤寒沙门氏菌,该研究首先合成一段与目标物的适配体部分互补配对的DNA序列,当目标菌存在时,适配体与目标菌特异性结合,游离的互补链触发链置换扩增反应,形成一条较长的双链 DNA (Double-stranded DNA,dsDNA),Ag+在NaBH4的作用下以dsDNA为模板还原为银纳米簇,通过记录银纳米簇的荧光信号实现对活的鼠伤寒沙门氏菌的定量检测,其最低检测限为50 CFU/mL,且该方法能有效区分活死菌,达到只检测活菌的目的。Leng等[25]构建了一种基于核酸适配体和靶向触发的酶修复扩增反应(Target-triggered enzymatic repairing amplification,ERA)的荧光信号放大方法成功用于检测鼠伤寒沙门氏菌。该研究通过靶标与适配体特异性结合反应,将包埋于dsDNA中的ERA引发链暴露出来,在聚合酶和两种DNA修复酶的协助下,引发ERA循环反应,实现荧光信号放大的目的。该方法在10~5×106CFU/mL目标菌浓度下具有较好的线性范围,最低检测限为9.86 CFU/mL,且对人工污染的牛奶样本检测发现该方法具有较高的回收率,原理见图 2(b)[23,25]。
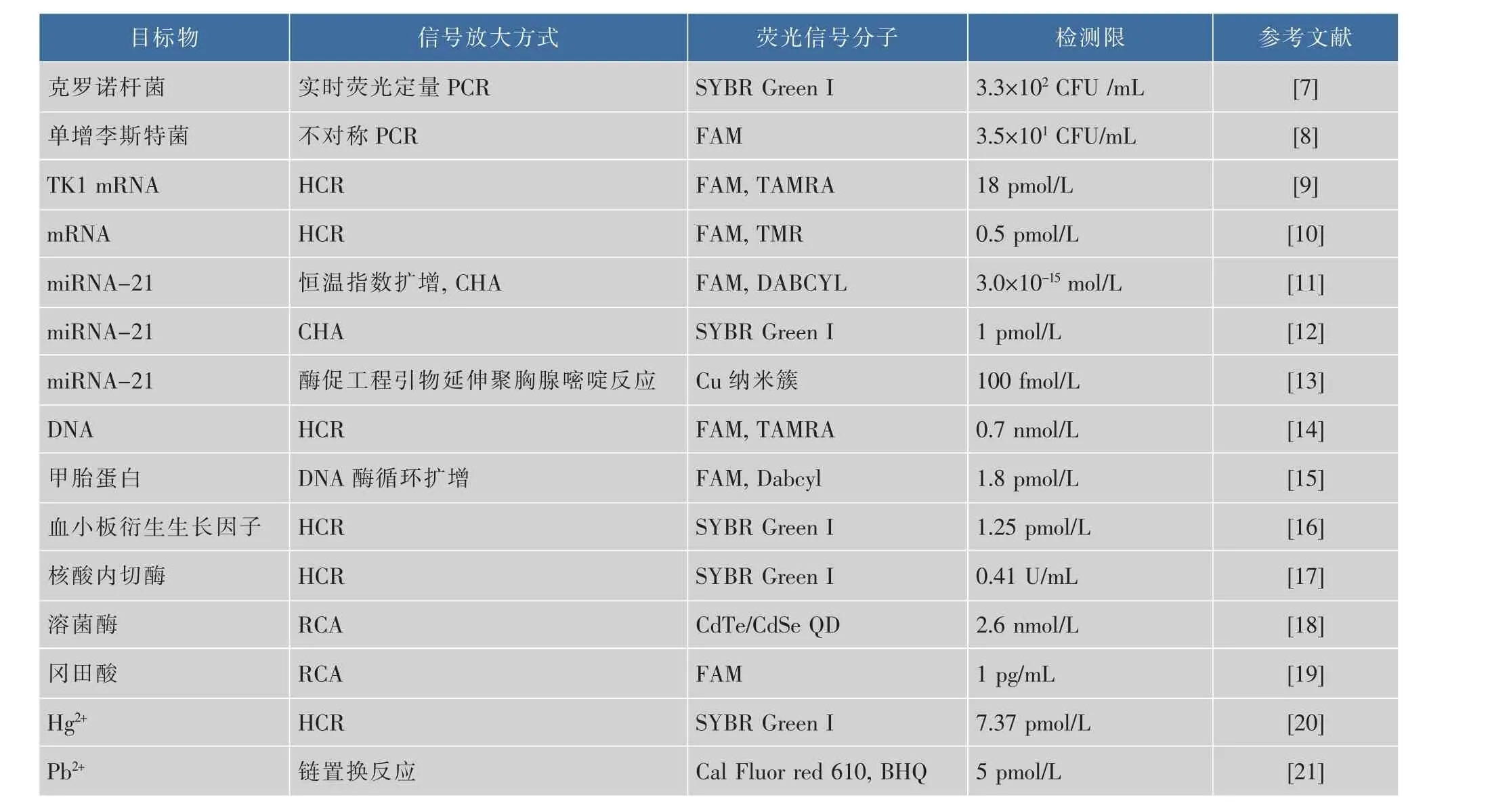
表1 核酸杂交介导的荧光信号放大方法在不同样本检测中的应用Table 1 The application of nucleic acid hybridization mediated fluorescence signal amplification methods for the detection of different samples
2.2 核酸检测
核酸检测在医疗诊断、法医分析、基因表达和药物发现等科学领域至关重要。然而,一般情况下,特定序列(基因)的核酸通常是微量存在的,常规检测方法无法实现对目标序列进行痕量检测。因此,作为一种高效,超灵敏的检测手段,基于核酸杂交的荧光信号放大方法被广泛应用于微小核糖核酸(miRNAs)和DNA等的检测。miRNAs是长约22 nt的非编码单链RNA分子,通过与信使RNA(mRNA)结合阻断基因表达,其异常表达与一些癌症的发生密切相关[26-28],因此建立灵敏,特异的检测平台实现对miRNAs的监测具有重要意义。Yuan等[29]合成了一种核酸功能化量子点探针,通过目标miRNA在量子点表面引发CHA反应形成G-四联体,结合氯化血红素(hemin)形成稳定的G-四联体/血红素酶,最终在hemin和G-四联体/血红素酶的共同作用下淬灭量子点荧光,实现对靶miRNA的检测,最低检测限达到37 fmol/L(原理图见图3(a))。Hong等[30]建立了一种基于滚环扩增的荧光信号放大方法用于灵敏检测miRNA-21。该方法通过目标miRNA-21诱导CHA反应形成不同比例的单链DNA(Single-stranded DNA,ssDNA),dsDNA 荧光探针,并巧妙地利用氧化石墨烯对ssDNA和dsDNA亲和力差异及荧光淬灭特性,通过测定体系荧光信号实现对miRNA-21的检测,最低检测限为0.4pmol/L[29,32]。

图2 抗原抗体识别型核酸信号放大方法检测细菌原理图,适配子识别型核酸信号放大方法检测细菌原理图Fig 2 Illustrationofnucleicacidsignalamplificationmethodsbasedonantigen-antibody(a)andaptamer(b)recognitionsforthe detectionofbacteria
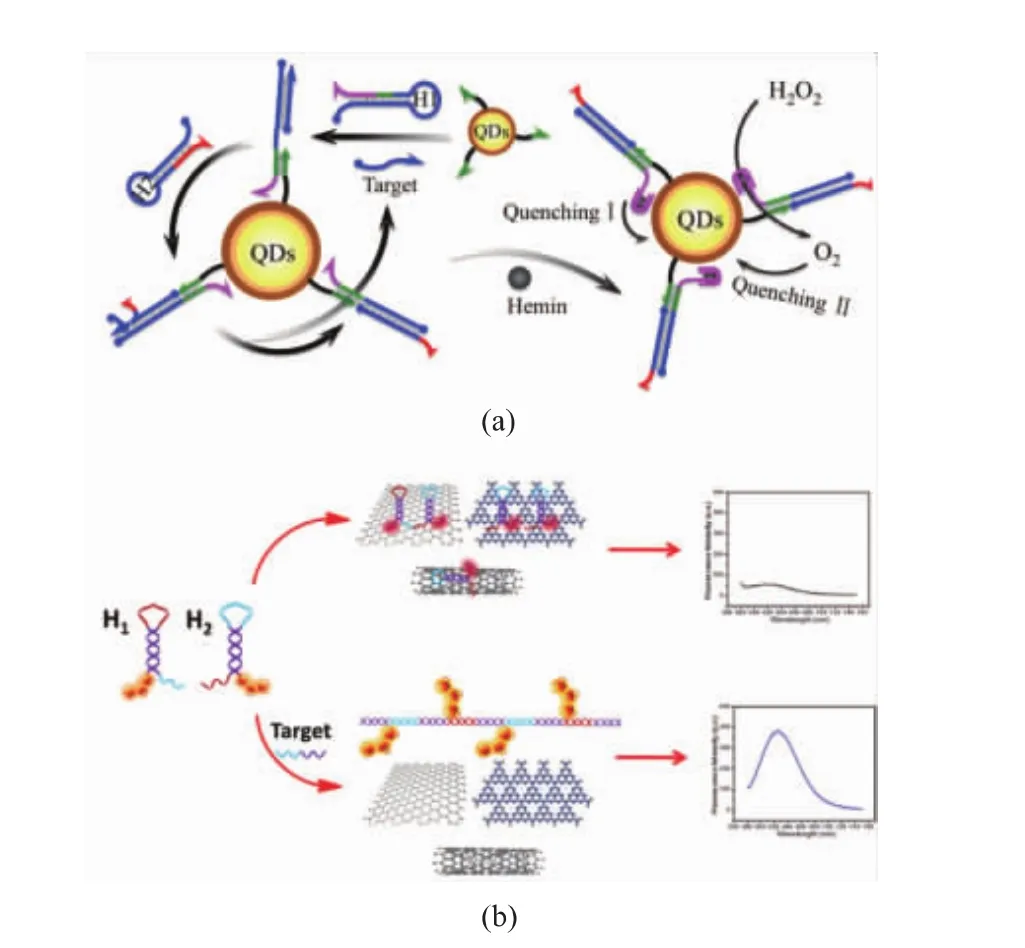
图3 核酸杂交信号放大方法在核酸检测中应用原理图Fig.3 Illustrationofapplicationofnucleicacidhybridization signal amplification method in nucleic acid detection
DNA是一类带有遗传信息的生物大分子,由于DNA分子碱基互补配对的特性,基于DNA构建的检测方法均具有灵敏度高,特异性好等优点,已经广泛应用于疾病诊断,微生物检测和基因分析等领域。Yu等[31]通过不对称聚合酶链式反应(Polymerase chain reaction,PCR)和HCR双重荧光信号放大机制,联合流式细胞术用于超灵敏检测蜡样芽孢杆菌,结果显示,该方法在纯培养液和牛奶中蜡样芽孢杆菌的最低检测限分别为7.6 CFU/mL和9.2×102CFU/mL,与其余非目的菌未见交叉反应,表现出优良的特异性。相比传统未经信号放大的荧光检测方法,灵敏度显著提高。Zhang等[32]建立了一种基于氧化石墨烯结合HCR反应的荧光信号放大方法用于检测HIV-DNA。该方法利用HIV-DNA引发HCR反应,并以发夹探针末端C序列上的银纳米簇为荧光信号输出分子,利用GO与ssDNA和dsDNA亲和力差异及荧光淬灭特性,实现定量检测HIV-DNA的目的,该方法在HIV-DNA浓度为10 nmol/L到100 nmol/L时具有良好的线性关系,对HIVDNA的最低检测限为1.18 nmol/L,且能有效地识别单碱基突变(原理图见图3(b))。
2.3 蛋白质检测
蛋白质是生物体内重要的物质基础,参与生参与生物体大部分生命活动,作为生命体的重要调控物质,其含量变化对生物体健康具有重要影响,建立灵敏的蛋白质检测方法具有重要意义。基于核酸杂交的荧光信号放大方法因操作简单,灵敏度高,广泛应用于蛋白质检测。根据目标蛋白质与核酸分子的结合方式的不同,该方法可分为3类:(1)利用特异性抗体(原理见图 4(a)),Xu 等[33]采用双抗夹心免疫法结合HCR反应用于检测甲胎蛋白(Alpha fetal protein,AFP),该研究利用碳量子点作为荧光信号输出分子,当有AFP存在时,抗体与之特异性结合引发HCR反应,最后通过检测HCR产物上荧光信号实现对目标物的检测。该方法对AFP的最低检测限为94.3 fg/mL,其灵敏度显著高于传统免疫学方法,且具有较好的特异性。(2)利用特异性核酸适配体(原理见图 4(b)),Li等[34]利用 HCR 反应与金纳米粒子建立了一种灵敏检测前梯度蛋白2同系物(Anterior gradient homolog 2,AGR2)的方法。此研究中,AGR2的适配体触发两个末端修饰FAM的DNA发夹探针发生HCR反应,当AGR2存在时,AGR2与其适配体特异性结合,HCR反应被阻断,剩余的发夹探针吸附于纳米金表面,发夹探针末端的荧光被淬灭。结果发现,该方法具有较好的特异性,线性范围为5.0 pmol/L到1.0 nmol/L,对AGR2的检测灵敏度可达到2.65 pmol/L。(3)利用蛋白质的功能性质(原理见图 4(c)),Jiang 等[35]建立了一种基于DNA酶和HCR反应的方法检测DNA腺嘌呤甲基转移酶 (DNA adenine methyltransferase,Dam MTase)。该研究中,HCR反应的引发链被包埋于一个含有DNA甲基化酶作用位点的发夹探针中,在Dam MTase的作用下,引发链游离出来,触发HCR反应,形成大量能特异性切断两端分别标记有荧光基团和淬灭基团的荧光探针的DNA酶,从而改变荧光基团与淬灭基团之间的距离,阻断FRET效应,使荧光信号值发生变化。该方法对Dam MTase的最低检测限为7.23×10-4U/mL,且对浓度为1.0×10-3~100 U/mL的Dam MTase具有良好的线性,相比其他信号放大方法,该方法具有更宽的线性范围。
2.4 生物小分子检测
核酸杂交介导的荧光信号放大方法主要通过结合核酸适配体技术实现对生物小分子的检测。Wang等[36]利用HCR反应合成DNA树突状聚合物,大量荧光苝探针在DNA诱导下聚集引起荧光淬灭,并将赭曲霉毒素A(Ochratoxin A,OTA)特异性核酸适配体将该聚合物固定于磁珠表面,当OTA存在时,由于核酸适配体和OTA之间的强亲和力,复合物从磁性纳米粒子中释放出来,在乙醇的作用下,PAPDI单体解聚并产生强烈的荧光,该方法检测灵敏度为0.1 pmol/L,且具有良好的特异性和回收率。Feng等[37]建立了一种基于核酸适配体和HCR技术的荧光信号放大方法用于检测腺苷,该研究将腺苷核酸适配体分为两部分,当腺苷存在时,暴露的引发链触发HCR反应,形成dsDNA,荧光染料SYBR Green I插入dsDNA,产生荧光信号。该方法在腺苷浓度为 1.0×10-6~1.2×10-4mol/L 具有较好的线性关系,其检测灵敏度为2.0×10-7mol/L。Taghdisi等[38]利用链霉素适配体和Exonuclease III建立了一种荧光信号放大方法用于检测链霉素。该方法通过链霉素与链霉素适配体发生亲和反应,产生不同浓度的ssDNA和dsDNA,并巧妙地利用Exonuclease III特异性水解dsDNA,通过SYBR Gold染料插入ssDNA,引起体系荧光值发生变化,从而实现对链霉素的定量检测,该方法对缓冲液,血液和牛奶中链霉素的最低检测限分别为 54.5、71.0、76.1 nmol/L,具有广阔的实际应用前景。
2.5 无机金属离子检测
重金属离子广泛存在于空气,土壤和水等基质中,难以被生物降解,通过食物链的生物放大作用能在人体中富集,并与人体内蛋白发生相互作用,使蛋白质功能受损,造成人体慢性中毒,因此,实现对其的实时监控具有重要意义[39]。目前,常规仪器分析法检测虽然灵敏度高,但需要借助大型仪器,成本高且无法满足实时检测的需要。而基于核酸杂交的荧光信号放大方法不仅能实现对其精确定量,而且可实现现场监测,因而得到了多数研究者的青睐。Lv等[40]构建了一种基于HCR的荧光信号放大方法用于Hg2+的检测,当Hg2+存在时,由于T-Hg2+-T配对作用,引发两个末端修饰FAM的发夹探针发生HCR反应,实现荧光信号放大,该方法对Hg2+的检测灵敏度可达0.36 nmol/L,且具有良好的特异性(原理见图5)。Huang等[41]联合氧化石墨烯和HCR反应构建了一种荧光信号放大方法用于检测Hg2+,该方法对Hg2+的最低检测限为0.3 nmol/L,且对其它二价金属离子表现出高选择性。Chen等[42]利用Cu2+依赖性DNA酶和FRET效应设计了一个荧光传感器检测Cu2+。该方法对Cu2+的最低检测限为0.5 nmol/L,线性范围为1~100 nmol/L,且具有较好的特异性。
图4 抗原抗体识别型核酸信号放大方法检测蛋白质原理图,适配子识别型核酸信号放大方法检测蛋白质原理图,蛋白质功能性质介导的核酸信号放大方法检测蛋白质原理图Fig.4 Illustration of nucleic acid signal amplification methods based on antigen-antibody(a)and aptamer(b)recognitions and the function of protein(c)for the detection of protein

图5 核酸杂交信号放大方法在Hg2+检测中应用原理图Fig.5 Illustration of application of nucleic acid hybridization signalamplification method in Hg2+detection
3 展望
核酸杂交技术的荧光信号放大方法在实际应用中仍存在以下问题:(1)实际检测样本中基质复杂,对检测结果干扰严重;(2)核酸杂交效率不高影响检测灵敏度;(3)荧光信号稳定性弱,易光漂白。鉴于上述问题,一方面,未来的研究方向可集中于对样品前处理技术进行改进,同时开发能准确评估核酸探针反应效率的核酸设计软件,系统分析体系中各实验参数的影响,进而提高反应效率和抗干扰能力。另一方面,开发新型荧光信号分子或结合其他核酸杂交技术用于构建荧光信号放大方法,进一步提高检测灵敏度,实现更有效地监测生物样本中目标物含量的目的。随着核酸杂交技术和纳米技术的不断发展,基于核酸杂交的荧光信号放大方法在生物检测领域必将拥有广阔的应用前景。
