抑菌和烹饪处理对南美白对虾主要过敏原原肌球蛋白免疫活性的影响
2020-05-18王梦梦王学丽李娅茹蓝蔚青
王梦梦 , 王学丽 , 李娅茹 , 蓝蔚青 , 丁 婕 , 卢 瑛 *
(1.上海海洋大学 食品学院,上海 201306;2.上海水产品加工及贮藏工程技术研究中心,上海 201306;3.农业部水产品贮藏保鲜质量安全风险评估实验室,上海201306)
南美白对虾富含蛋白质、矿物质以及维生素A,还包括二十碳五烯酸 (EPA)和二十二碳六烯酸(DHA)等不饱和脂肪酸,能为人体提供优质蛋白质[1,2]。随着消费量的逐年增加,引起的安全问题也引起人们的注意。虾蟹等甲壳类水产品会对特定人体引起过敏反应,被联合国粮农组织和世界卫生组织定义为8类食物过敏原之一[3]。近年来,已研究证明的甲壳类过敏原有原肌球蛋白(Tropomyosin,TM)、精氨酸激酶 (Arginine Kinase,AK)、肌球蛋白轻链(Myosin Light Chain, MLC)、 肌钙结合蛋白(Sarcoplasmic Calcium Binding Protein, SCP)等[5]。 其中,原肌球蛋白为主要过敏原,占虾总蛋白质质量分数6%,相对分子质量在 3.4×104~3.6×104,具有热稳定性,主要引起IgE型过敏反应[6]。据统计,在亚洲儿童食物过敏患者中,甲壳类过敏率占39%,成人甲壳类过敏占33.8%[4]。
研究发现,虾类过敏原的主要消减方法包括物理法和生物化学法,物理法有加热、超高压、辐照、微波、超声等[9-11],生物化学法有酶解[12]和美拉德反应[13]。其中,高压和辐照具有抑菌、杀菌作用,常用于水产品的保鲜处理过程。壳聚糖和茶多酚是两种常用的生物保鲜剂,具有抑菌和抗菌作用,能够起到良好的抑菌保鲜作用[14-15]。酸性电解水具有较好的抑菌、杀菌保鲜作用,是一种新型的保鲜技术,常被用于水产品的保鲜研究中[16-17]。水煮和清蒸是我国家庭常用的水产品烹饪方法,研究发现热处理能够降低虾中的可溶性蛋白含量[18]。
为了调查虾类主要过敏原原肌球蛋白在抑菌保鲜和烹饪处理过程中的含量和活性变化状况,作者选取壳聚糖和茶多酚两种具有抑菌作用的生物保鲜剂处理富集的TM,同时用酸性电解水以及酸性电解水结合水煮、清蒸烹饪方式分别处理南美白对虾,以探究不同抑菌和烹饪处理方法对原肌球蛋白免疫活性的影响,为今后虾类主要过敏原的风险溯源提供基础数据。
1 材料与方法
1.1 材料与试剂
鲜活南美白对虾购于当地菜市场,-40℃保存备用;PVDF 膜(0.45 μm):美国 Millipore公司产品;R-250考马斯亮蓝染色液、2×上样缓冲液(Loading Buffer)、HRP-羊抗鼠 IgG:生工(上海)股份有限公司产品;一抗5G5E:作者所在实验室自制;非预染Marker和预染Marker:美国Thermo公司产品;DAB显色液(D0426-50SET):美国Sigma公司产品;脱脂奶粉:美国BD公司产品;Tris-MOPS-SDS电泳缓冲液、12%预制胶:美国GenScript公司产品。
1.2 仪器与设备
JY-ZY3半干式转移电泳槽:深化生物技术有限公司产品;Bio-Rad小垂直板电泳槽:美国Bio-Rad公司产品;FW~200型强酸性电解水制备仪:日本AMANO公司产品;eppendorf 5417R高速冷冻离心机:德国Eppendorf公司产品;Sartorius PB-10 pH计:德国Sartorius公司产品。
1.3 实验方法
1.3.1 抑菌保鲜处理 原肌球蛋白(Tropomyosin,TM)的提取富集方法根据Lasekan等[18]法略有改动。将南美白对虾去头剥壳去虾线,搅碎后用丙酮溶液(4℃预冷)去油脂,过夜风干成为丙酮粉。将丙酮粉和摩尔浓度0.5 mmol/L DTT的PBST缓冲液按照质量体积比1 g∶5 mL匀浆,4℃过夜抽提。抽提液11 000 r/min 20 min离心后取上清液,进行硫酸铵沉淀,将沉淀用PBS溶解煮沸10 min,离心取上清。将上清液透析并冻干,置于-80℃备用。
将富集TM溶液分别与不同质量分数的壳聚糖溶液(分别为1%、1.5%、2%、2.5%、3%)和茶多酚溶液(分别为 0.1%、0.2%、0.6%、0.8%、1.0%)混合,使TM最终质量浓度为400 μg/mL,室温反应5min后的溶液作为样品。以质量浓度400 μg/mL的富集TM样品作为对照。
1.3.2 酸性电解水抑菌及其结合烹饪处理 酸性电解水(acidic electrolyzed water,AEW):配制质量分数为0.15%的氯化钠溶液,并倒入电解水制备仪中电解水15 min,收集酸性电解水,避光存放,测得pH为2.30±0.02。现制现用。
单独酸性电解水处理:将南美白对虾虾仁在酸性电解水中浸泡5、10、15 min,将虾仁和摩尔浓度为0.5 mmol/L DTT的PBST缓冲液按照质量体积比1 g∶5 mL进行抽提,将抽提液煮沸10 min后冰浴20 min,最后11 000 r/min 20 min离心取上清液即为待测样品溶液。
单独水煮、清蒸处理:将南美白对虾虾仁水煮或清蒸,并在5、10、15 min时取样,样品TM粗提取方法同上。
酸性电解水结合水煮处理:将酸性电解水浸泡15 min的南美白对虾虾仁继续水煮处理,并在5、10、15 min时取样,样品TM粗提取方法同上。
酸性电解水结合清蒸处理:将酸性电解水浸泡15 min的南美白对虾虾仁继续清蒸处理,并在5、10、15 min时取样,样品TM粗提取方法同上。
1.3.3 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE) 十二烷基硫酸钠-聚丙烯酰胺凝胶电 泳 (sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)根据 Laemmli等人的方法[19]进行。电泳预制胶质量浓度为12 g/dL,样品上样量8 μL。将不同待测样品溶液与2×上样缓冲液混合并煮沸后的溶液即为电泳样品。设置电源电压进行跑胶,待电泳结束后取出预制胶进行考马斯亮蓝染色液染色,然后脱色液脱色至蛋白质条带清晰。
1.3.4 蛋白质免疫印迹(Western-blotting) 免疫印迹法(Western-blotting)根据 Song等人的方法[7]进行。转移胶根据SDS-PAGE法制得,并将非预染Marker改为预染Marker。设置半干式转膜仪电流180 mA运行20 min,将预制胶上的蛋白转移至PVDF膜。用质量分数为5%的脱脂奶粉封闭1 h,然后用PBST洗涤膜3次,每次5 min。PVDF膜用TM 的特异性单抗(McAb)5G5E(质量浓度为 1 μg/mL)孵育 1 h,洗涤。然后用 HRP-羊抗小鼠 IgG(1∶2 500)溶液孵育1 h,洗液洗涤。加入DAB工作液,显色5 min,用去离子水洗去残留显色液并风干。
1.3.5 竞争性酶联免疫法(ELISA) 竞争性酶联免疫法(enzyme-linked immunosorbent assay,ELISA)根据Kamath等人[20]方法略有改动。富集TM用摩尔浓度50 mmol/L碳酸盐缓冲液(pH=9.6)稀释至质量浓度为4 μg/mL,4℃过夜包被,PBST溶液洗涤。然后用质量分数5%的脱脂奶粉37℃封闭2 h,洗涤。每孔加入特异性单抗5G5E(与不同处理虾仁样品的TM粗提液混合反应后的特异性单抗),在37℃孵育2 h,洗涤。加入HRP-羊抗小鼠IgG(用抗体稀释液稀释2 500倍)37℃孵育2 h,洗涤。然后加入OPD底物显色液室温反应20 min,最后加入摩尔浓度为2mol/L硫酸终止反应,并立即用酶标仪测定490 nm处波长的吸光度值(OD值)。以摩尔浓度50 mmol/L的碳酸盐溶液作为阴性对照,以抗体稀释液稀释的特异性抗体5G5E作为阳性对照,每个样品做4个平行。样品中TM的抑制率按照下述公式计算:
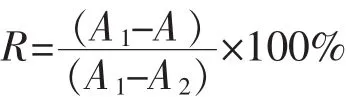
式中:R为样品中TM的抑制率,(%);A为样品在490 nm处的吸光度值;A1为阳性对照样品在490 nm处的吸光度值;A2为阴性对照样品在490 nm处的吸光度值。
2 结果与分析
2.1抑菌处理对TM免疫活性的影响
SDS-PAGE能够从电泳条带中反映不同处理样品蛋白质相对分子质量和浓度的变化。蛋白免疫印迹和竞争ELISA通过抗原抗体的特异性反应,能过评价过敏原免疫活性的变化,作者所采用单克隆抗体5G5E对甲壳类主要过敏原TM有特异性反应[21]。壳聚糖或者茶多酚溶液单独与富集TM(400 μg/mL)混合反应后样品的SDS-PAGE和Western-blotting结果如图1所示,竞争ELISA结果如图2所示。
由图1可见,电泳结果显示在3.5×104附近的条带很粗,表明样品中此相对分子质量的蛋白质有较高的含量。 Western-blotting结果(图 1(b))显示3.5×104附近的条带与5G5E抗体有显著的特异性反应,表明这个条带是南美白对虾的主要过敏原TM蛋白质。此外,与TM对照(样品0)样品相比,经不同浓度壳聚糖溶液(样品1~5)和茶多酚溶液(样品6~10)处理TM样品的条带粗细没有变化,表明壳聚糖和茶多酚保鲜处理对富集TM的含量没有影响。

图1 抑菌处理的SDS-PAGE和Western-blotting结果Fig.1 SDS-PAG E and Western-blotting resultsof bacteriostasis treatments
由图2可知,不同壳聚糖和茶多酚溶液抑菌处理TM样品的抑制率均大于80%,其中茶多酚处理的富集TM样品抑制率在83.10%~88.01%,壳聚糖处理的富集TM样品抑制率在90.77%~95.77%,与对照相比抑制率无明显变化(P>0.05),说明不同浓度的壳聚糖和茶多酚溶液处理对纯化南美白对虾TM的免疫活性没有影响。孙亚天等人[22]在大豆分离蛋白溶液中加入壳聚糖反应,结果发现大豆分离蛋白的分子结构未发生改变,而且酪氨酸和色氨酸残基周围的微环境没有明显改变。

图2 抑菌处理的竞争ELISA结果Fig.2 Competition ELISA results for bacteriostasis treatments
2.2 酸性电解水结合烹饪处理对TM免疫活性的影响
酸性电解水结合水煮和清蒸烹饪处理的南美白对虾虾仁样品的SDS-PAGE和Western-blotting结果分别如图3和图4所示,竞争ELISA结果如图5所示。

图3 酸性电解水结合水煮处理虾仁样品的SDS-PAGE和Western-blotting结果Fig.3 SDS-PAGE and Western-blotting of shrimp samples withAEWcombiningwithboilingprocess
由图3(a)可知,以南美白对虾虾仁为对照(样品0),酸性电解水浸泡不同时间的虾仁(样品1~3)TM条带(3.5×104)粗细没有变化;酸性电解水结合水煮(样品 4~6)和单独的水煮(样品 7~9)处理的TM 条带(3.5×104)也没有显著变化,但是在 18.4×104~25×104区域内,靠近2.5×104的条带明显减弱,而靠近18.4×104的条带明显增强,表明虾仁经水煮加工后,大的蛋白质分子被分解产生小分子蛋白质。电解水结合水煮加工处理的免疫印迹结果 (图3(b))显示,与虾仁对照(样品0)相比,酸性电解水处理虾仁(样品1~3)的条带没有明显变化,电解水结合水煮处理(样品 4~6)及单独的水煮处理(样品 6~9)虾样的 TM 条带有明显减弱, 在 1.84×104~2.50×104范围内的两个条带与TM特异性抗体不发生反应,表明水煮热加工处理和电解水结合水煮处理能够破坏TM的结构从而影响TM与特异性抗体的结合能力,而单独酸性电解水处理样品的TM的特异性反应条带没有变化。
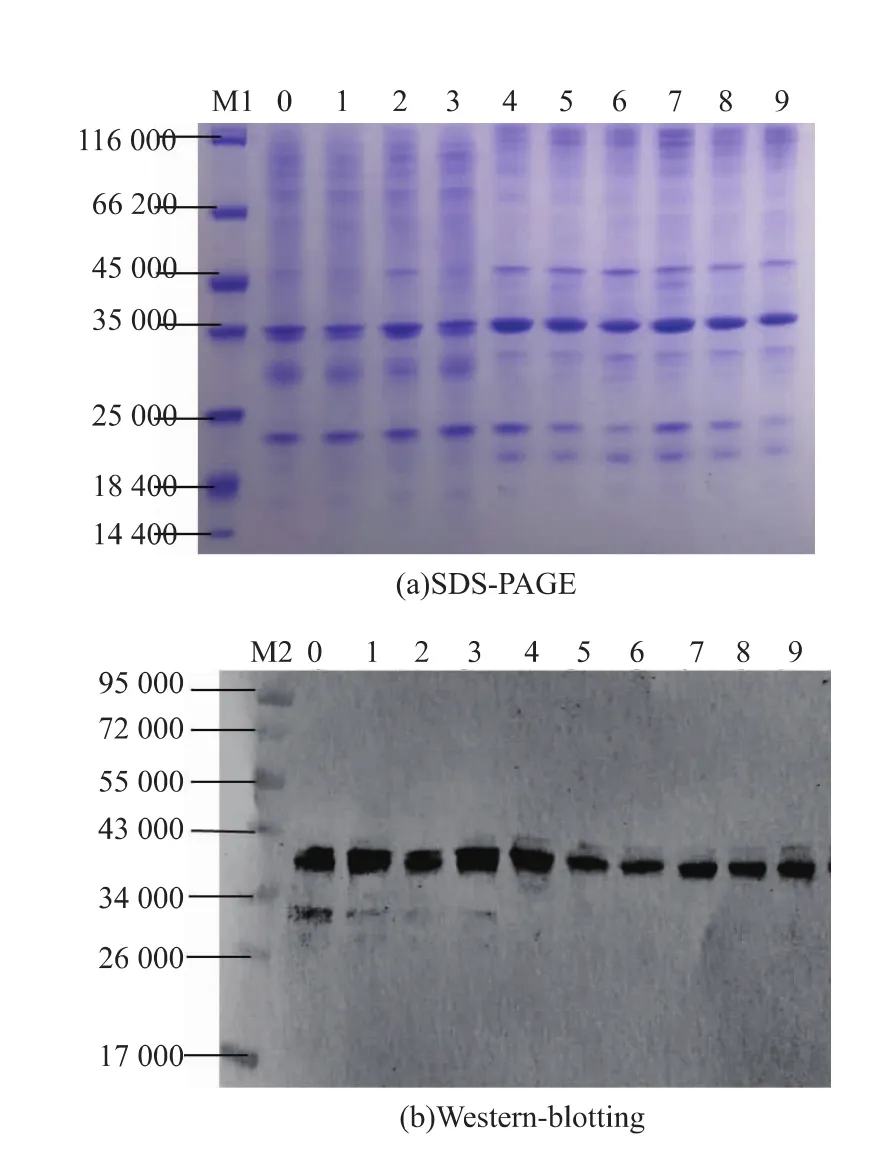
图4 酸性电解水结合清蒸处理虾仁样品的SDS-PAGE和Western-blotting图Fig.4 SDS-PAGE and Western-blotting of shrimp samples with AEW combining with steaming process
由图4(a)可知,单独酸性电解水处理样品(样品 1~3)的 TM 条带(3.5×104)没有变化,而经过单独清蒸(样品7~9)以及酸性电解水结合水煮样品(样品4~6)的小分子条带变粗,在4.5×104处出现新的大分子条带;免疫印迹结果与酸性电解水结合水煮样品结果相似。表明单独酸性电解水处理对虾仁中蛋白质组成没有影响,而经过清蒸以及电解水结合清蒸虾仁中小分子蛋白质浓度增加,同时出现少量大分子蛋白质。Liu[23]等人探究了水煮热处理对虾中TM的影响,研究发现水煮样品中TM有相对较低的IgE结合能力和稳定性,同时SDS-PAGE结果显示样品中大分子蛋白质含量增加。酸性电解水处理对南美白对虾的蛋白质组成和TM含量没有影响,而水煮及清蒸热加工处理能够破坏TM结构改变构象,从而降低TM的含量,改变与特异性抗体的结合能力。
酸性电解水结合水煮或清蒸热加工处理的南美白对虾虾仁样品的竞争ELISA结果如图5所示,抑制率与样品中TM的免疫活性呈正相关。与虾仁对照组相比,不同酸性电解水处理及结合水煮清蒸热加工样品的免疫活性出现下降的现象 (P<0.05)。单独酸性电解水处理10 min样品的免疫活性下降14.1%,水煮及电解水结合水煮分别处理10 min的样品TM免疫活性分别下降12.7%和12.9%,清蒸及电解水结合清蒸均处理15 min虾仁的TM免疫活性降低更明显,分别降低18.4%和15.7%。与单独酸性电解水处理样品相比,电解水结合清蒸热加工样品的免疫活性降低更为明显,分别降低14.1%和18.4%,表明保鲜结合清蒸热加工处理对TM的构象、空间结构和表位影响更加明显。Marmon和Sun等人研究发现酸碱处理能够改变鱼虾中氨基酸组成[24-25],蔺海鑫[26]用不同pH的酸性溶液处理从菲律宾蛤仔中富集纯化的原肌球蛋白溶液,研究发现在酸性条件下原肌球蛋白的结构趋于松散,且表面疏水性明显下降,而表面疏水性是由氨基酸在空间中分布造成的,与蛋白质的空间构象密切相关[11]。
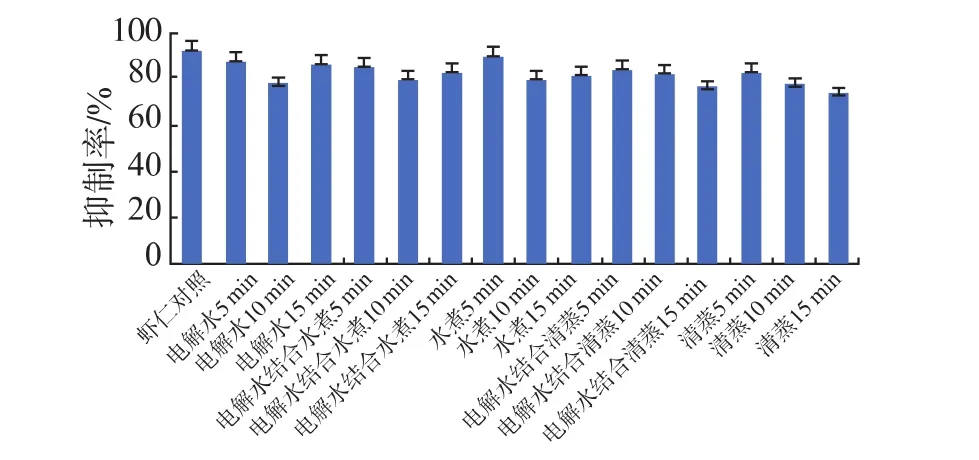
图5 酸性电解水结合热加工样品的竞争ELISA结果Fig.5 Competitive ELISA results of samples with AEW combining with thermal process
对比电解水结合不同加工处理的免疫印迹和竞争性ELISA结果,发现虾仁经酸性电解水处理后,不同处理时间的过敏原TM和特异性单抗的反应基本没有变化,但是竞争性ELISA结果显示,虾仁经酸性电解水处理5、10、15 min后,TM的免疫活性分别下降了4.8%、14.1%和6.2%,表明不同时间的酸性电解水处理对TM的免疫活性产生不同的影响。竞争性ELISA针对的是完整的蛋白质分子,故此它检测到的是过敏原的构象表位;而蛋白免疫印迹针对的是三维结构破坏后的变性蛋白质,故此检测到抗原的线性表位,而且某些携带抗原表位的小分子蛋白在转膜过程中会丢失[11,27], 从而导致Western-blotting和竞争ELISA结果出现不一致的现象,具体原因有待进一步验证。
3 结语
作者通过对比研究壳聚糖、茶多酚以及酸性电解水抑菌处理对南美白对虾主要过敏原TM的影响,发现酸性电解水抑菌处理能够使TM免疫活性降低14.1%。同时发现酸性电解水结合清蒸处理可较弱的增强TM结构破坏,免疫活性降低15.7%。
