桑葚花色苷提取条件的响应面法优化
2020-05-18高林森柴岳平温吉更李亚丽郭烨
高林森,柴岳平,温吉更,李亚丽,郭烨
(1.河北省农林科学院农业信息与经济研究所,河北 石家庄 050051;2.河北省农林科学院,河北 石家庄 050031)
桑葚果是桑属植物中的一种成熟果实,营养丰富,口感较好,其果肉化学成分复杂,药理作用十分广泛[1]。桑葚不仅含有钙、锌、铁、锰等矿物质元素,还含有胡萝卜素等黄酮类物质以及芦丁等药理成分,是国家卫生部列出的保健农产品之一[2~5]。当今,桑葚果汁享有“二十一世纪的最佳健康食品”之美誉。
桑葚果花色苷对人体具有多种保健功能。桑葚富含多酚类物质,其中主要为花色苷类化合物,以桑椹红作为着色剂已经列入我国国家标准食品添加剂使用卫生标准(GB 2760—2004),有着巨大的加工潜力[6]。早在1972 年,日本学者报道了桑葚果中的花色苷含有矢车菊-3-葡萄糖苷、牵牛花-3-芸香糖苷和天竺葵-3-葡萄糖苷3 种成分[7]。2004 年Liu 等[8]等通过高效液相色谱法,从桑葚果中分离出4 种花色苷成分。
桑葚具备药理活性的缘由是其含有某些生物活性物质[9]。研究表明,成熟的桑葚果实含有丰富的花色苷物质,膳食花色苷具有抗氧化[10,11]、抗肿瘤[12~14]、抗炎症[15]、抗动脉粥样硬化[16]等优良且广泛的生物学效应,尤其是抗肿瘤活性具有天然、低毒、高效等优点[17,18]。
将成熟桑葚洗涤、打碎、冷冻干燥,得到桑葚干粉。将桑葚干粉在酸化乙醇中浸泡提取,离心,真空抽滤,滤液旋蒸除去乙醇,石油醚萃取取除去脂类,最后真空抽滤,得到桑葚花色苷粗提物水溶液,待测。并对提取过程中的重要参数进行了优化。确定了最佳提取条件,并对不同地区生长的桑葚花色苷含量进行了差异性分析,旨为桑葚花色苷的进一步开发利用提供科研依据。
1 材料与方法
1.1 试验材料
桑葚样品采自邢台市、衡水市和沧州市,品种主要有无核大十、黑珍珠、红果2 号、白玉王、黑珍珠、桂花蜜、红果2 号、白葚子、台湾长桑。
试剂有醋酸钠(纯度98%,山东西亚化学工业有限公司)、氯化钾(分析纯,天津市红岩化学试剂厂)、60~80 ℃石油醚(山东西亚化学工业有限公司)、盐酸(分析纯,天津市永大化学试剂有限公司) 和乙醇(分析纯,天津市永大化学试剂有限公司)。
所用仪器或设备有冷冻干燥箱、超声波清洗器、-80 ℃冰箱等(表1)。

表1 试验仪器或设备的型号及其生产厂商Table 1 Test instruments and equipments and their manufacturers
1.2 试验方法
1.2.1 桑葚花色苷的提取 将桑葚清洗干净,晾干后打浆,冷冻干燥至桑葚干粉,贮存于-80 ℃低温冰箱中,备用。称取桑葚干粉0.500 0 g 于试管中,加酸化乙醇溶液(85%乙醇与1.5 mol/L HCl 按照体积比85∶15 配制而成) 20 mL 溶解,60 ℃浸泡提取90 min,将提取液以4 000 r/min 转速离心5 min,取上清液;取沉淀重复上述操作,合并2 次提取液。真空抽滤2次得到的上清液,将滤液旋蒸除去乙醇,利用石油醚萃取除去脂类[19],最后真空抽滤,得到桑葚花色苷粗提物水溶液,待测。
1.2.2 花色苷总含量的测定 采用pH 值示差法[20]测定提取物水溶液中的花色苷总含量。将待测提取液定容到10 mL,吸取样品2 mL 置于2 只试管中,一支试管中加入1 mL pH 值1.0 的缓冲液(0.2 mol/L 氯化钾溶液与0.2 mol/L 盐酸溶液按体积比25∶67 配制而成),另一支加入pH 值4.5 的缓冲液(0.2 mol/L 醋酸钠溶液用0.2 mol/L 盐酸调节pH 值至4.5),得到待测液。以蒸馏水作为空白对照,利用紫外分光光度计,分别在波长520 nm 和700 nm 处测定2 种待测液的吸光值(A)。根据公式,计算桑葚的花色苷总含量:
桑葚花色苷总含量(mg/g)=(A/εL)×MW×DF×V/M
A=(A510nm,pH值1.0-A700nm,pH值1.0)-(A510nm,pH值4.5-A700nm,pH值4.5)
式中,A 为吸光值,ε 为消光系数26 900;L 为光程(1.0 cm);MW 为矢车菊花素-3-葡萄糖苷的分子量(449.38);DF 为稀释因子;V 为待测样品提取液的体积(mL);M 为样品质量(g)。
1.2.3 单因素试验对适宜提取条件的筛选 本试验考察的提取条件因素有酸化乙醇中的乙醇浓度、乙醇与HCl 的体积比(V乙醇:VHCl)、提取时间、提取次数和提取温度5 个。将其中的4 个因素固定,变化某个因素的水平,根据花色苷提取量确定单因素的适宜水平。
1.2.3.1 提取次数对提取液中花色苷含量的影响。在溶剂中乙醇浓度85%、V乙醇∶VHCl=90∶10、提取温度60 ℃、提取时间90 min 条件下,分别提取1、2 和3 次。
1.2.3.2 提取温度对提取液中花色苷含量的影响。在溶剂中乙醇浓度85%、V乙醇∶VHCl=90∶10、提取时间90 min 条件下,提取温度分别设定为50、60、70、80和90 ℃,提取1 次。
1.2.3.3 提取时间对提取液中花色苷含量的影响。在溶剂中乙醇浓度85%、V乙醇∶VHCl=90 ∶10、提取温度60 ℃条件下,提取时间分别设定为72、80、88、96、104 和112 min,提取1 次。
1.2.3.4 乙醇浓度对提取液中花色苷含量的影响。提取溶剂中的乙醇浓度分别设定为72%、80%、88%、96%和100%,在V乙醇∶VHCl=90 ∶10、提取温度60 ℃、提取时间90 min 条件下提取1 次。
1.2.3.5 V乙醇∶VHCl对提取液中花色苷含量的影响。在溶剂中乙醇浓度85%、提取温度60 ℃、提取时间90 min条件下,V乙醇∶VHCl分别设定为75∶25、80 ∶20、85∶15、90 ∶10、95∶5,提取1 次。
1.2.4 响应面试验对提取条件的优化 根据单因素试验结果选取合适的3 个因素,利用Design Expert 8.0 软件采取Box-Behnken 试验设计,通过三因素三水平的响应面分析法对花色苷提取条件进行优化。
2 结果与分析
2.1 花色苷提取工艺的单因素试验结果
2.1.1 提取次数的选择 随着提取次数的增加,花色苷提取量呈逐渐增加趋势,其中提取3 次处理的花色苷提取量分别较提取2 次、提取1 次处理提高了7.89%和13.10%,提取2 次处理的花色苷含量较提取1 次处理仅提高了4.83%,增幅均较小(图1)。从经济和环保角度考虑,确定适宜的提取次数为1 次。
2.1.2 提取温度的选择 随着提取温度的升高,花色苷提取量呈先增加后降低的趋势变化,其中提取温度为60 ℃时指标值最大,为1.85 mg/L(图2)。提取温度为50 ℃时花色苷提取量最低,温度升高后花色苷提取量迅速增加,与升温后花色苷扩散到提取溶剂中的速度加快有关;温度达到一定程度后继续升高时提取量逐渐下降,与温度过高造成花色苷降解[21]有关。因此,确定适宜的提取温度为60 ℃。
2.1.3 提取时间的选择 随着提取时间的延长,花色苷提取量呈先增加后降低的趋势变化,其中提取时间为90 min 时指标值最大,为1.87 mg/L(图3)。因此,确定适宜的提取时间为90 min。
2.1.4 乙醇浓度的选择 随着乙醇浓度的增大,花色苷提取量呈先增加后降低的趋势变化,其中乙醇浓度为80%时指标值最大,为1.92 mg/L(图4)。乙醇浓度较低时,溶液体系极性较差,影响花色苷的溶出,造成花色苷提取量低;乙醇浓度增大后有利于花色苷的溶出,花色苷提取量逐渐提高;但是乙醇浓度过大时桑葚粉中的其他杂质也会溶出,影响花色苷含量的测定,导致花色苷提取量有所下降[22]。因此,确定适宜的乙醇浓度为80%。
2.1.5 V乙醇:VHCl的选择 随着V乙醇∶VHCl的增大,花色苷提取量呈先增加后降低的趋势变化,其中V乙醇∶VHCl为85∶15 时指标值最大,为1.97 mg/L(图5)。因此,确定适宜的V乙醇∶VHCl为85∶15。
2.2 花色苷提取工艺的响应面法优化结果
根据单因素试验结果,V乙醇∶VHCl、提取温度、乙醇浓度对花色苷提取量影响较大,因此选择这3 个因素进行响应面试验设计(表2)。

表2 响应面分析的因素及其水平编码Table 2 Factors and their level codes by response surface analysis
2.2.1 响应面法试验设计与结果 利用Design Expert 8.0 软件对不同因素与水平组合的试验结果(表3) 进行分析,得到花色苷含量(Y)对自变量A(V乙醇:VHCl)、B(提取温度) 和C(乙醇浓度) 的回归方程:
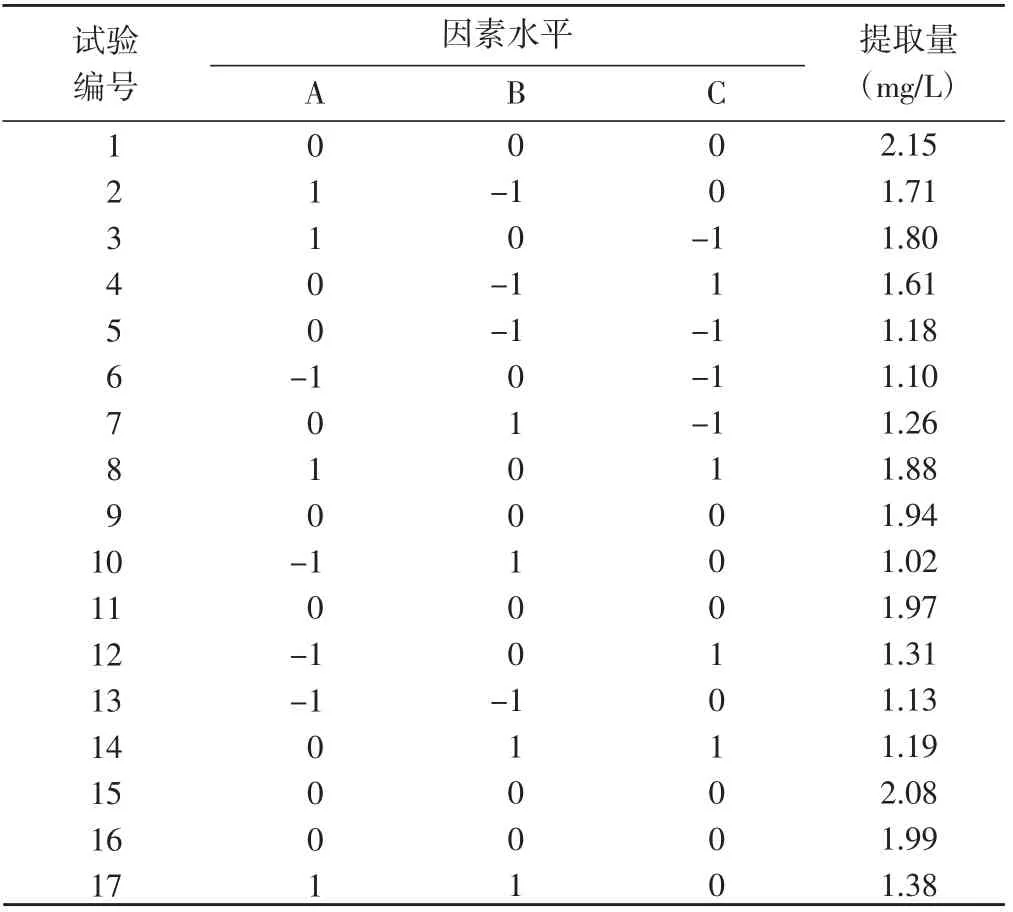
表3 Box-Behnken 试验设计及其结果Table 3 Box-Behnken test design and results
Y=2.03+0.28A-0.097B+0.081C-0.056AB-0.032AC-0.12BC-0.25A2-0.46B2-0.25C2
2.2.2 方差分析 对得出的回归方程进行方差分析,模型P<0.01,相关性达到了极显著水平(表4),说明选用的二次多项模型具有高度的显著性。失拟项P(0.591 7) >0.01,相关性不显著;模型的决定系数R2=0.980 1,说明提取率的实测值与预测值之间具有很好的拟合度。因此,该模型拟合效果较好,可以用此模型来分析和预测桑葚花色苷的提取工艺。
各因素对花色提取量的影响顺序为A(V乙醇:VHCl)>B(提取温度) >C(乙醇浓度),其中V乙醇:VHCl对花色提取量的影响达到了极显著水平(P<0.01),提取温度和乙醇浓度对花色苷提取量的影响达到了显著水平(P<0.05)。
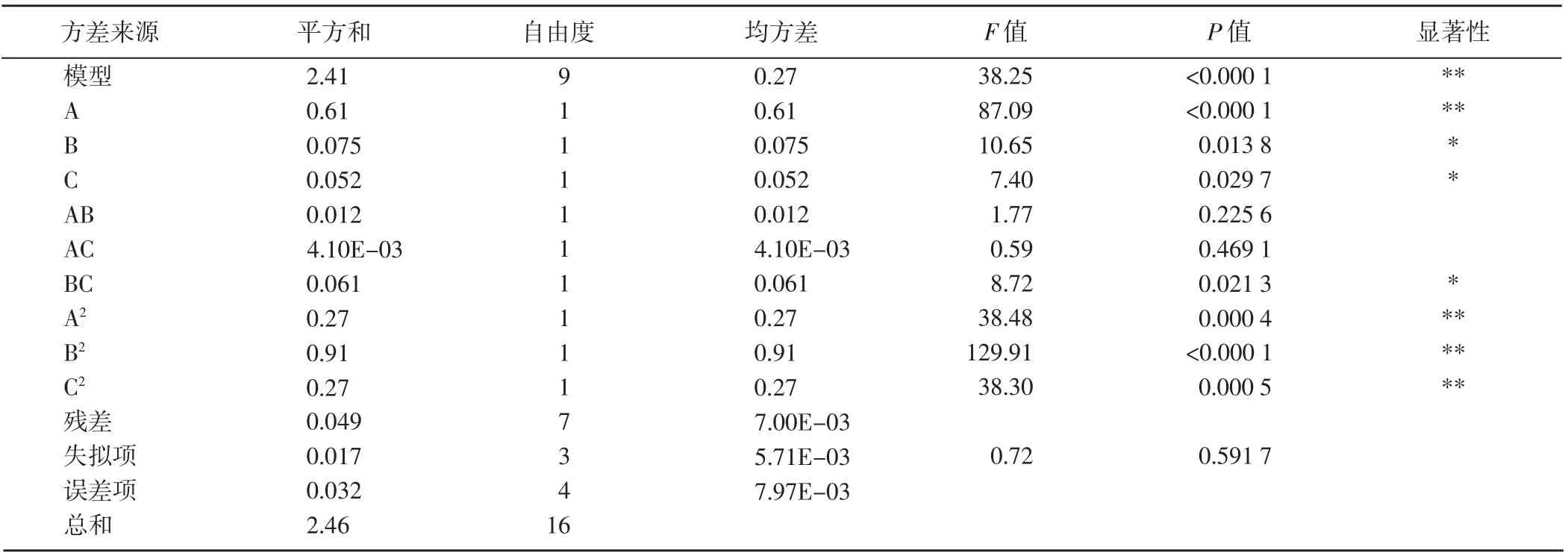
表4 回归方程的方差分析Table 4 Variance analysis of regression equation
2.2.3 各因素之间的交互作用 提取温度、V乙醇:VHCl、乙醇浓度交互作用对响应值的影响可以从响应图面直观反映出来[21]。提取温度与乙醇浓度的交互作用达到了显著水平(图6~8)。
2.2.4 回归模型的验证 通过该回归方程,求得优化后的最佳工艺参数为乙醇与HCl 体积比87.77 ∶12.23、提取温度58.41 ℃、乙醇浓度85.815%。该条件下,花色苷的提取量为2.13 mg/g。
考虑到实际操作的简便性,将优化后的工艺条件修正为乙醇与HCl 体积比90 ∶10、提取温度60 ℃、乙醇浓度85%,并在此条件下进行了验证试验。结果显示,该条件下花色苷的提取含量为2.22 mg/g,与理论预测值(2.13 mg/L) 的相对误差小于2%。因此,应用响应面分析方法优化得到的工艺参数结果可靠。
2.3 不同种植条件桑葚花色苷含量的比较
将多产地不同品种的桑葚冻干后,利用上述所得的最优试验条件进行花色苷提取。10 个参试桑葚品种的花色苷含量为1.035~1.973 mg/L,不同品种之间差异较大,其中产自衡水地区的黑珍珠花色苷含量最高(表5)。检测结果为河北省桑葚产品研发以及花色苷的进一步利用提供了理论依据。
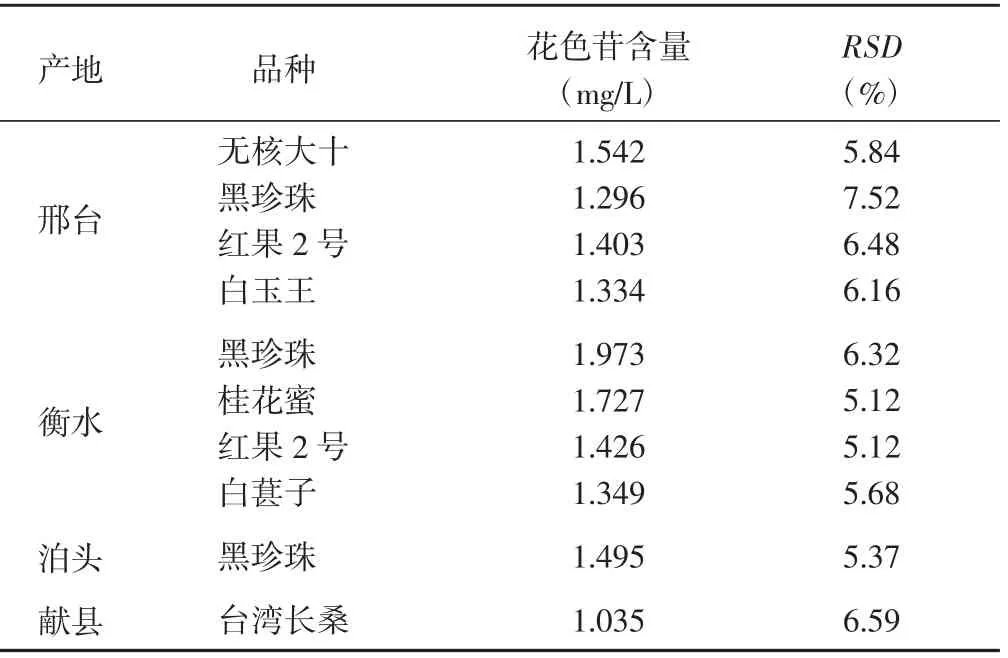
表5 桑葚中的花色苷含量(n=5,春季)Table 5 Anthocyanin content in mulberry (n=5,spring)
3 结论与讨论
单因素试验结果表明,提取液中酸化乙醇浓度、乙醇与HCl 体积比、提取温度、提取时间和提取次数均对桑葚花色苷提取率有影响。响应面回归分析结果表明,提取过程中提取温度与乙醇浓度的交互作用对花色苷提取率的影响最为显著。采用响应面法建立花色苷提取率的二次多项拟合方程,由模型优化花色苷的提取条件为:提取液酸化乙醇中乙醇浓度85%,乙醇与HCl 体积比90 ∶10,提取温度60 ℃,提取时间90 min,提取1 次。在此条件下,桑葚果花色苷提取量可达2.22 mg/L。对不同地区生长的桑葚花色苷含量进行了差异性分析,发现不同品种的花色苷含量差异较大,这为桑葚产品研发以及花色苷的进一步利用提供了理论依据。
桑葚保健功能已经引起了人们的兴趣,花色苷的功能显著,桑葚为花色苷的重要来源之一,对高收率桑葚花色苷的提取工艺进行研究并提供指导,对桑葚花色苷类产品的分析及功能性食品和药品的研发奠定了试验基础。
