黄连解毒汤调控NLRP3炎症小体改善动脉粥样硬化的机制研究①
2020-05-13许丽婷于红红喻旭梅徐彬人田维毅
许丽婷 于红红 许 滔 喻旭梅 徐彬人 田维毅 俞 琦
(贵州中医药大学,贵阳 550025)
心血管疾病是全球范围内造成死亡的主要原因之一,截至2018年我国患心血管疾病人数高达2.9亿[1]。动脉粥样硬化(atherosclerosis,AS)是心血管疾病的常见病理过程,能够导致血管狭窄性堵塞[2]。炎症在AS发病过程中起重要作用,NLRP3炎症小体是AS过程中的主要炎症因子,能够活化Caspase-1,使pro-IL-1β和pro-IL-18切割成成熟的IL-1β和IL-18,并引发一系列的炎症反应。因此干预NLRP3炎症小体可以影响AS的病理过程[3]。黄连解毒汤出自中医古籍《外台秘要》,是经典的清泄三焦之火的中药方剂。研究表明黄连解毒汤具有抗炎和降脂的药理作用,同时能调控AS中的脂质和炎症因子,达到抑制AS的治疗作用[4-6]。本研究采用载脂蛋白E基因敲除(ApoE-/-)小鼠建立AS模型[7],探讨黄连解毒汤调控NLRP3炎症小体对AS病变过程中炎症因子的影响及其作用机制。
1 材料与方法
1.1材料 SPF级ApoE-/-小鼠购自北京维通利华实验动物技术有限公司,许可证号为:SCXK(京)2016-0006,体重18~22 g。黄连解毒汤由黄连、黄芩、黄柏和栀子组成,为中药饮片,购自同济堂贵阳分店,经贵州中医药大学生药教研室鉴定为正品。三酰甘油(triglyceride,TG)测定试剂盒、总胆固醇(total cholesterol,TC)测定试剂盒、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)测定试剂盒、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)测定试剂盒购自南京建成生物工程研究所;TNF-α、IL-18和IL-1β ELISA试剂盒购自武汉伊莱瑞特生物科技股份有限公司;苏木素染液、伊红染液购自武汉赛维尔生物科技有限公司;油红O染色试剂盒购自上海索莱宝生物科技有限公司;RNA提取试剂盒购自美国Omega公司;反转录试剂盒、荧光定量PCR试剂盒购自日本TaKaRa公司;实时定量PCR仪、凝胶成像仪购自美国Bio-Rad公司;全波长酶标仪、核酸蛋白分析仪、台式高速冷冻离心机购自美国Thermo Scientific公司 ;DYCP-31DN型电泳仪购自北京六一仪器厂;vx-55高压灭菌锅购自德国 Systec公司;XSZ-HS3显微镜购自重庆光学仪器厂;sw-C7-2H洁净工作台购自上海博讯实业有限公司医疗设备厂。
1.2方法
1.2.1小鼠AS模型制备 适应性喂养1周后开始造模。ApoE-/-小鼠30只,给予含脂肪21%、胆固醇0.15%的“西方类型膳食”照射灭菌高脂饲料;6只ApoE-/-小鼠给予照射灭菌的普通饲料。分别喂养12周。
1.2.2动物分组及药物处理 普通饲料喂养的小鼠为空白组(control group),将AS模型小鼠随机分成模型组(model group)、阳性组(positive group)、黄连解毒汤大剂量组(HJD-H group)、黄连解毒汤中剂量组(HJD-M group)、黄连解毒汤小剂量组(HJD-L group),每组6只,造模12周后灌胃给药6周,每天1次。空白组和模型组给予等体积生理盐水灌胃。
1.2.3各组小鼠体重计量 用电子秤称量小鼠体重,监测小鼠在AS病变过程中的体重变化情况。
1.2.4小鼠主动脉HE染色 给药结束后,取一部分小鼠主动脉组织于液氮速冻30 min后保存于-80℃,一部分主动脉用4%的多聚甲醛中固定。将主动脉铺平后进行石蜡包埋,置于二甲苯中固定20 min。依次将切片放入二甲苯Ⅰ20 min,二甲苯Ⅱ20 min,无水乙醇Ⅰ10 min,无水乙醇Ⅱ10 min,95%酒精5 min,90%酒精5 min,80%酒精5 min,70%酒精5 min,蒸馏水洗脱蜡。脱蜡至水后,加入苏木素染液5 min,1%的盐酸酒精分化,0.6%氨水返蓝,流水冲洗,加入伊红染液2 min。脱水后用中性树胶封片,在光学显微镜下观察病理变化并拍照记录。
1.2.5油红O染色 主动脉窦横切面:将主动脉窦部进行横切制作成冷冻切片,用4%多聚甲醛固定后加入油红工作液,用75%酒精分化后进行细胞核苏木素复染,用甘油封片。主动脉大体油红:取新鲜主动脉组织于固定液中固定24 h,用解剖剪沿血管壁小心地将血管纵向剖开,将剖开的血管浸入油红染液中,37℃染色60 min后取出,用75%乙醇分化至管腔内脂肪斑块呈橘红色或鲜红色,将染好的大体组织固定好进行拍照,用Image J软件分析斑块面积。
1.2.6免疫组化染色 依次将石蜡切片放入二甲苯Ⅰ15 min,二甲苯Ⅱ15 min,二甲苯Ⅲ15 min,无水乙醇Ⅰ5 min,无水乙醇Ⅱ5 min,85%酒精5 min,75%酒精5 min,蒸馏水洗脱蜡。将组织切片置于柠檬酸(pH6.0)抗原修复液中进行抗原修复。用3%双氧水溶液阻断内源性过氧化物酶后进行血清封闭。加一抗4℃孵育过夜,加二抗室温孵育50 min。DAB显色后加入苏木素进行细胞核复染。最后脱水封片,用显微镜观察分析并记录实验结果。
1.2.7ELISA法检测血清中TNF-α、IL-18和IL-1β含量 血清中的TNF-α、IL-18和IL-1β含量采用ELISA进行检测,具体操作参考试剂盒说明书。
1.2.8血脂检测 采用GPO-PAP酶法检测TC和TG含量,按试剂盒说明书操作,用酶标仪检测510 nm 波长OD值并计算出血清TC和TG的含量。采用直接法检测HDL-C和LDL-C,按试剂盒说明书操作,酶标仪检测546 nm波长OD值并计算出血清HDL-C和LDL-C的含量。
1.2.9RT-qPCR检测主动脉组织中IL-1β、Caspa-se-1、NLRP3和TNF-α mRNA的表达 按OMEGA试剂盒说明书提取小鼠主动脉中的RNA,得到纯度较高完整性较好的总RNA。按照逆转录试剂盒说明书,以RNA为模板进行反转录,得到cDNA。加入表1中引物,用荧光扩增试剂盒进行扩增。扩增程序:95℃预变性30 s,95℃变性5 s,60℃退火30 s,40个循环。以GAPDH 为内参基因,采用2-ΔΔCt方法计算mRNA的相对表达量。

2 结果
2.1黄连解毒汤灌胃后小鼠的体重变化 记录小鼠给药过程中每周的体重变化。与空白组比较,模型组体重增加,差异有统计学意义(P<0.05)。与模型组比较,阳性组、小剂量组和中剂量组小鼠体重减少,差异有统计学意义(P<0.05),大剂量组体重变化不明显。见图1。
2.2黄连解毒汤对小鼠血清中HDL-C、LDL-C、TC和TG水平的影响 与空白组比较,模型组LDL-C、TC和TG水平均增高,HDL-C减少,差异有统计学意义(P<0.05)。与模型组相比,阳性组、黄连解毒汤各剂量组LDL-C、TC和TG水平均降低,阳性组和中剂量组HDL-C水平升高,差异有统计学意义(P<0.05)。见图2。
表1 RT-qPCR目的基因引物序列
Tab.1 RT-qPCR target gene primer sequence

GenePrimerLength(bp)GAPDHF:5′-GACATGCCGCCTGGAGAAAC-3′R:5′-AGCCCAGGATGCCCTTTAGT-3′95NLRP3F:5′-CTTTATCCACTGCCGAGAG-3′R:5′-AGCTCATCAAAGCCATCC-3′151TNF-αF:5′-GCAAAGGGAGAGTGGTCA-3′R:5′-CTGGCTCTGTGAGGAAGG-3′128IL-1βF:5′-CCCCAGGGCATGTTAAGGAG-3′R:5′-GTCTTGGCCGAGGACTAAGG-3′94Caspase-1F:5′-ACAACCACTCGTACACGTCTTGC-3′R:5′-CCAGATCCTCCAGCAGCAACTTC-3′115

图1 小鼠给药时的体重变化Fig.1 Changes of weight when administered to mice
2.3黄连解毒汤对小鼠血清TNF-α、IL-18和IL-1β含量的影响 与空白组比较,模型组小鼠血清TNF-α、IL-18、IL-1β表达量明显增加(P<0.05)。与模型组比较,阳性组、黄连解毒物各剂量组小鼠血清TNF-α、IL-18、IL-1β表达量明显减少(P<0.05)。见表2。
2.4HE染色观察主动脉形态学变化 与空白组对比,模型组主动脉斑块面积增大(P<0.05),主动脉血管壁增厚且厚薄不一,可见泡沫细胞形成的动脉粥样硬化斑块。与模型组对比,阳性组、黄连解毒汤各剂量组小鼠主动脉血管泡沫化程度减轻,斑块面积明显减少(P<0.05);黄连解毒汤中剂量组斑块面积减少最显著(P<0.05)。见图3、4。

图2 小鼠HDL-C、LDL-C、TC和TG水平的测定结果Fig.2 Determination of HDL-C,LDL-C,TC and TG in miceNote: Compared with the control group,*.P<0.05;compared with the model group,#.P<0.05;compared with the HJD-L group,△.P<0.05;compared with the HJD-M group,★.P<0.05.



GroupsTNF-α (pg/ml)IL-1β (pg/ml)IL-18 (pg/ml)Control group78.98±0.131 059.30±68.6228.68±0.38Model group137.83±0.131)2 199.60±84.811)73.78±0.051)HJD-L group117.01±0.092)1 006.48±93.272)60.82±0.022)HJD-M group114.05±0.312)3)948.49±60.702)58.32±0.052)3)HJD-H group131.95±0.202)3)4)1 157.23±78.892)3)4)63.55±0.032)3)4)Positive group110.98±0.112)1 093.71±37.952)55.17±0.032)
Note:Compared with the control group,1)P<0.05;compared with the model group,2)P<0.05;compared with the HJD-L group,3)P<0.05;compared with the HJD-M group,4)P<0.05.

图3 HE染色观察小鼠主动脉斑块大小(×50)Fig.3 HE staining of mouse aortic plaque size(×50)Note: A.Control group;B.Model group;C.HJD-L group;D.HJD-M group;E.HJD-H group;F.Positive group.
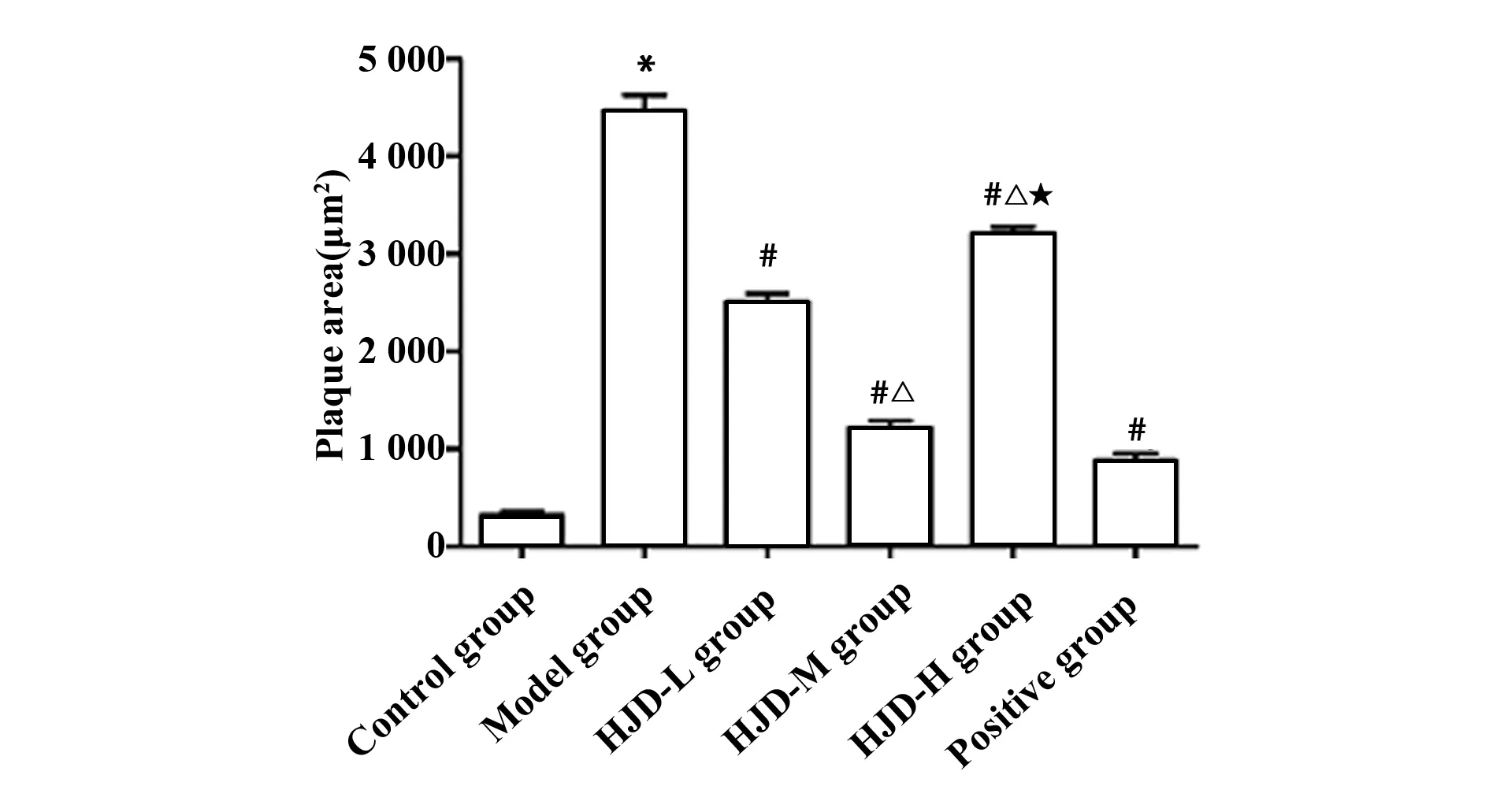
图4 小鼠主动脉粥样硬化斑块的面积Fig.4 Area of mouse aortic atherosclerotic plaqueNote: Compared with the control group,*.P<0.05;compared with the model group,#.P<0.05;compared with the HJD-L group,△.P<0.05;compared with the HJD-M group,★.P<0.05.

图5 小鼠主动脉大体油红O染色Fig.5 Mouse aorta with general oil red O stainingNote: A.Control group;B.Model group;C.HJD-L group;D.HJD-M group;E.HJD-H group;F.Positive group.
2.5油红O染色评估AS斑块的形态和面积 油红O染色显示,与空白组相比,模型组主动脉出现斑块面积明显增加(P<0.05)。与模型组对比,阳性组和黄连解毒汤各剂量组斑块面积明显减少,中剂量组斑块面积减少最明显(P<0.05)。见图5~7。

图6 小鼠主动脉窦油红O染色(×40)Fig.6 Oil red O staining of mouse aortic sinus(×40)Note: A.Control group;B.Model group;C.HJD-L group;D.HJD-M group;E.HJD-H group;F.Positive group.
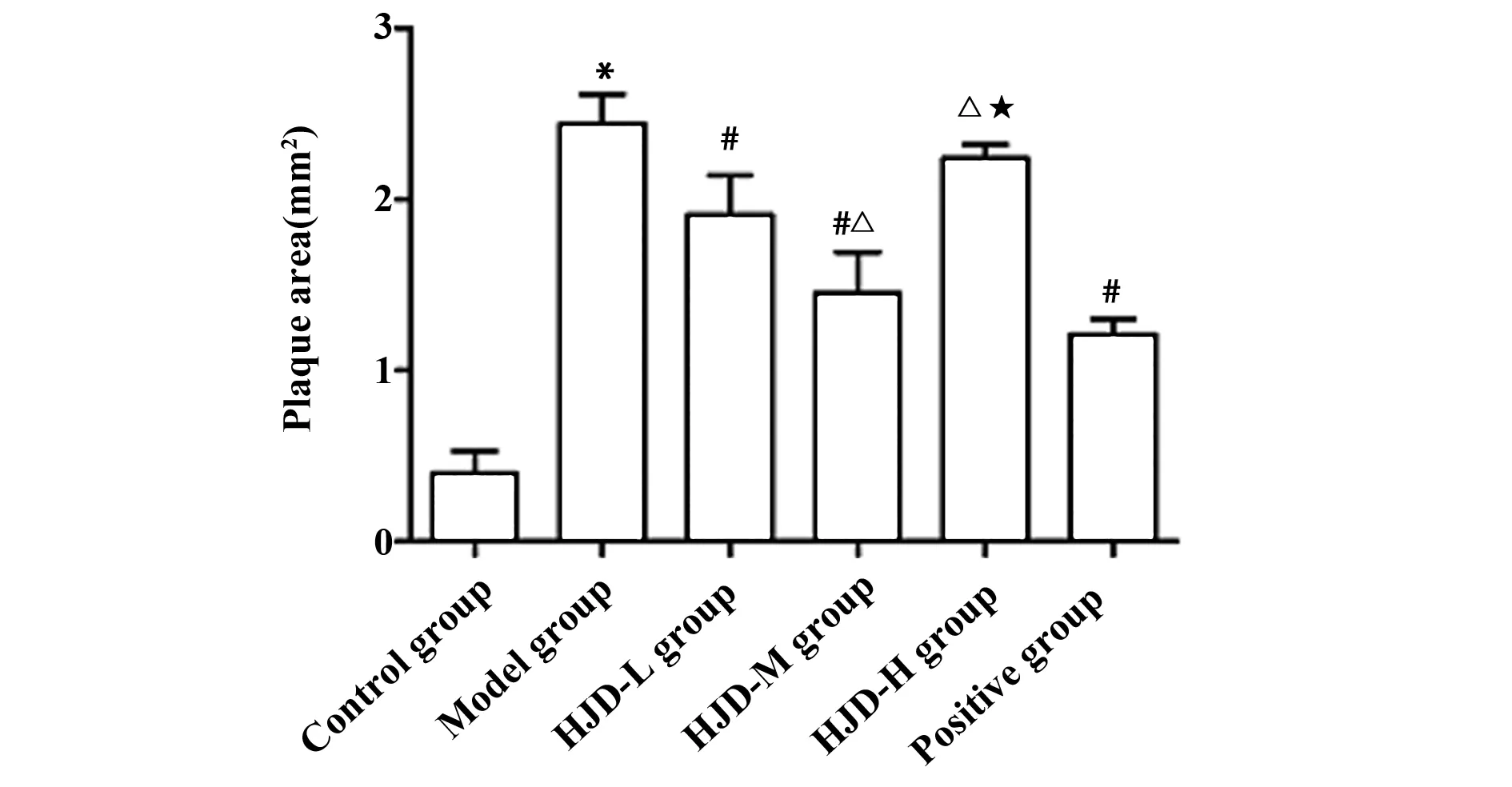
图7 小鼠主动脉油红O染色斑块面积Fig.7 Oil red O staining plaque area of aorticNote: Compared with the control group,*.P<0.05;compared with the model group,#.P<0.05;compared with the HJD-L group,P<0.05;compared with the HJD-M group,★.P<0.05.

图8 免疫组化检测小鼠主动脉窦NLRP3(×200)Fig.8 Immunohistochemical detection of mouse aortic sinus NLRP3(×200)Note: A.Control group;B.Model group;C.HJD-L group;D.HJD-M group;E.HJD-H group;F.Positive group.

图9 小鼠主动脉组织中IL-1β、Caspase-1、NLRP3、TNF-α mRNA表达量Fig.9 IL-1β,Caspase-1,NLRP3,TNF-α mRNA expression in mouse aortic tissueNote: Compared with the control group,*.P<0.05;compared with the model group,#.P<0.05;compared with the HJD-L group,△.P<0.05.
2.6NLRP3免疫组织化学检测 细胞核为蓝色,DAB显示的阳性表达为棕黄色。与空白组比较,模型组NLRP3更为明显。与模型组比较,黄连解毒汤小剂量组、中剂量组、大剂量组和阳性组NLRP3减少,中剂量组减少效果更为明显,见图8。
2.7黄连解毒汤对小鼠主动脉组织中IL-1β、Casp-ase-1、NLRP3和TNF-α mRNA表达影响 与空白组比较,模型组IL-1β、Caspase-1、NLRP3、TNF-α mRNA表达均升高(P<0.05)。与模型组对比,黄连解毒汤中剂量组、高剂量组和阳性组的IL-1β、Caspase-1、NLRP3、TNF-α mRNA含量均显著降低(P<0.05),小剂量组IL-1β、Caspase-1 mRNA表达下降(P<0.05)。见图9。
3 讨论
AS是一种慢性炎症性疾病,由动脉脂质沉积和炎症的恶性循环引起[8,9]。中医认为,AS是由于气血运行失调引起各种病理产物堆积造成的,主要的病理产物有血瘀、痰浊、热毒,可累及全身使患者出现AS病变的临床症状[10]。黄连解毒汤记载于《外台秘要》,对热毒炽盛、机体失调引起的痴呆、胃热型溃疡、痔疮、AS等内外妇儿疾病均有显著疗效[7,11]。黄连解毒汤通过降低血脂、抑制炎症反应[12,13],减少主动脉上泡沫细胞的数量,减轻小鼠AS斑块的病理损伤[5,14],达到抗AS的作用。
血脂含量异常会增加AS发生的风险[15]。HDL-C可清除血液中的LDL-C和中密度脂蛋白达到抗AS的作用[16]。本研究发现,黄连解毒汤小剂量组和中剂量组小鼠血清LDL-C、TC和TG水平明显降低,同时HDL-C水平显著升高。说明一定剂量范围的黄连解毒汤能增加AS小鼠的HDL-C水平和下调LDL-C、TC、TG水平,这与刘玲等[13]和伍世文等[4]的研究一致。同时,高脂饲料喂养的ApoE-/-小鼠体重增长较快,经黄连解毒汤治疗后,小、中剂量组小鼠体重显著降低,说明黄连解毒汤能抑制AS模型小鼠的体重上升。为了研究黄连解毒汤对AS斑块的影响,本研究通过组织形态计量,采用HE染色和油红O染色观察主动脉组织,结果显示,模型组出现明显斑块,提示造模成功。阳性对照组和小、中剂量组斑块明显减少,提示一定剂量的黄连解毒汤具有减少AS斑块的作用,其中,中剂量组治疗效果最为显著。
在AS病变过程中,大量炎症因子和脂质在血管壁积聚,激活免疫细胞使血管内细胞受损,促进炎症反应,从而使胆固醇自胞内外流并堆积,形成AS斑块[11]。NF-κB通路是体内关键的炎症信号传导途径之一,NLRP3炎症小体和TNF-α在该通路上起重要作用,共同促进炎症的形成[17],NLRP3炎症小体被认为是AS有力的药物靶标[9]。NLRP3炎症小体是由NLRP3、凋亡相关斑点样蛋白和Caspase-1组成[18],高脂饮食诱导NLRP3炎症小体活化,激活的Caspase-1介导IL-1β和IL-18的成熟,增强炎症和AS斑块生成[19]。本研究结果表明,模型组NLRP3、Caspase-1、IL-1β和TNF-α mRNA含量均升高,NLRP3表达更为明显且血清IL-1β、IL-18和TNF-α高表达。经过一定剂量黄连解毒汤治疗后,血清炎症因子IL-1β、IL-18和TNF-α表达量下调,NLRP3炎症小体通路上的NLRP3蛋白和NLRP3、Caspase-1、IL-1β、TNF-α mRNA指标含量均降低。提示黄连解毒汤抗AS作用可能与抑制NLRP3炎症小体有关。说明黄连解毒汤可通过调控NLRP3炎症小体阻断IL-1β和IL-18的成熟和分泌来减轻机体的炎症反应。
综上所述,一定浓度的黄连解毒汤能够改善AS小鼠体重和血脂,减少小鼠AS斑块的面积;更值得注意的是,黄连解毒汤可抑制NLRP3炎症小体及其活化通路中Caspase-1、IL-1β、IL-18和TNF-α mRNA的表达,推测与其抗AS的作用有关。其中,黄连解毒汤中剂量对NLRP3炎症小体的调控效果最显著。黄连解毒汤治疗小鼠AS模型的量效关系还需进一步研究。
