QuEChERS-GC-MS/MS法同时测定刺梨中15种有机氯农药残留
2020-05-12冉茂乾张馨允蒋洪亮徐孟怀焦彦朝
李 志,冉茂乾,张馨允,蒋洪亮,徐孟怀,焦彦朝*
(1.六盘水市山地特色生态产品研究中心,贵州 六盘水 553000;2.贵阳海关出入境检验检疫综合技术中心 国家果蔬检测重点实验室(六盘水),贵州 六盘水 553000;3.贵阳海关出入境检验检疫综合技术中心,贵州 贵阳 550081)
刺梨(Rosa roxbunghiiTratt)又名九头鸟、文先果,是一种稀有的果实,主要分布在贵州、四川、湖北、云南等地[1-5],果实富含维生素、糖、有机酸、胡萝卜素,尤其是维生素C含量极高,被称为“维C之王”[6-9]。目前在贵州已有大面积人工种植,为培育出品质优良的刺梨,农药被广泛应用于农产品的除虫杀菌,然而因存在农药的不合理使用,农产品中经常存在农药残留超标的情况被检出,食品中残留小剂量的农药和其他化学试剂会对人和动物的健康产生不良影响,因此食品中农药残留已经成为威胁消费者的一大安全问题。农药多残留分析QuEChERS(Quick、Easy、Cheap、Effective、Rugged and Safe)方法是用于高含水量食物中农药多残留检测的一种样品处理和净化技术[10-14]。近年来国内外已有大量文献研究QuEChERS方法作为农兽药残留检测的前处理,刘婷等[15]采用QuEChERS结合气相色谱-三重四级杆串联质谱法(gas chromatography triple quadrupole mass spectrometry,GC-MS/MS)和液相色谱-串联质谱法(liquidchromatographytandemmassspectrometry,LC-MS/MS)对果蔬农药多残留进行分析研究;高彦等[16]采用QuEChERS结合LC-MS/MS法在动物源性食品中兽药残留分析中的应用研究;CONCHA-MEYER A等[17]使用QuEChER结合GC-MS/MS对智利国内市场冷冻水果和蔬菜中的农药残留进行分析研究;本研究建立QuEChER前处理结合气相色谱-三重四级杆串联质谱法(GC-MS/MS)对刺梨中15种有机氯农药残留进行同时检测,为刺梨农药残留检测提供了新途径。
1 材料与方法
1.1 材料与试剂
刺梨(贵农一号)、刺梨(贵农七号)、刺梨(贵农九号):市售;乙腈、正己烷(色谱纯):德国Merck公司;丙酮、甲苯(色谱纯):美国Tedia试剂公司;硅藻土、氯化钠、无水硫酸钠(分析纯):国药集团化学有限公司;乙二胺-N-丙基硅烷(primary secondary amine,PSA)、石墨化碳黑(graphitized carbon black,GCB)、十八烷基硅烷键合硅胶(C18):均购于德国Dr.Ehrenstorfe公司;ECQUEU750CT-MP 萃取盐包(4 g MgSO4,1 g NaCl,0.5 g柠檬酸二钠和1 g柠檬酸三钠):美国Agilent公司;PestiCarb/NH2柱:上海誉谱化工科技有限公司。
α-六六六、β-六六六、γ-六六六、δ-六六六、五氯硝基苯、百菌清、艾氏剂、狄氏剂、o,p'-滴滴伊、o,p'-滴滴滴、p,p'-滴滴涕、p,p'-滴滴滴、哒螨灵、三氯杀螨醇、硫丹,规格均为(100 μg/mL、1.2 mL):北京坛墨质检科技有限公司。
1.2 仪器与设备
TQ8050气相色谱-质谱联用仪(配AOC-20i+s自动进样器):日本岛津公司;TT-2500-VM型多管涡旋混合器:北京金恒祥仪器有限公司;5427 R台式高速冷冻离心机:Eppendorf(中国)有限公司;HG200均质机:普利赛斯国际贸易(上海)有限公司;AUX220分析天平:日本岛津公司;EYELA旋转蒸发仪:东京理化器械株式会社;HSE-12B固相萃取仪:天津市恒奥科技发展有限公司;TWS-12电热恒温水浴锅:上海喆图科学仪器有限公司;retsch混合型碾磨仪MM 400:德国ReTsch莱驰公司;Thermo ASETM 150 加速溶剂萃取器:美国赛默飞公司;SCQ-5201D超声仪:上海声彦超声波仪器有限公司。
1.3 方法
1.3.1 样品前处理
QuEChERS前处理:称取10.0 g(精确至0.001 g)刺梨匀浆于50 mL离心管中,加入20 mL乙腈旋涡振荡提取5 min后,将ECQUEU750CT-MP 萃取盐包加入离心管中再次剧烈振荡提取5 min,然后在20 ℃、5 000 r/min离心5 min,移取1 mL提取液至装有150 mg无水MgSO4、50 mg PSA、50 mg C18的2 mL微离心管中,经旋涡振荡1 min后10 000 r/min离心5 min,取上清液至自动进样瓶,供GC-MS/MS分析检测。
加速溶剂萃取[18]:称取10 g(精确至0.001 g)刺梨匀浆与10 g 硅藻土混合,移入加速溶剂萃取仪的34 mL 萃取池中,在10.34 MPa 压力、80 ℃条件下加热5 min,用乙腈静态萃取3 min,循环2次,然后用池体积60%的乙腈(20.4 mL)冲洗萃取池,并用氮气吹扫100 s。萃取完毕后,氮吹浓缩至1 mL左右,将浓缩液于已用乙腈-甲苯溶液(3∶1)活化好的Sep-Pak NH2柱中净化,并用20 mL乙腈-甲苯溶液(3∶1)洗涤Sep-Pak NH2柱,净化液于40 ℃氮吹仪浓缩至1 mL,过0.45 μm有机滤膜,供GC-MS/MS分析。
超声波萃取:称取10.0 g(精确至0.001 g)刺梨匀浆于80 mL离心管中,加入20 mL正己烷放入超声提起仪中浸提5 min,超声仪提取条件为:功率120 W、频率500 kHz、温度30 ℃。加入5 g氯化钠,再次浸提5 min,将离心管放入离心机中,在5 000 r/min离心10 min,取上清液于旋转蒸馏瓶中,重复提取3次,合并提取液,旋转蒸馏浓缩至1 mL左右,将浓缩液于已用乙腈-甲苯溶液(3∶1)活化好的Sep-Pak NH2中净化,并用20 mL乙腈-甲苯溶液(3∶1)洗涤Sep-Pak NH2柱,净化液于40 ℃氮吹仪浓缩至1 mL,过0.45 μm有机滤膜,供GC-MS/MS分析。
1.3.2 气相色谱-质谱条件
色谱柱:DB-5MS毛细管柱(30 m×0.25 mm×0.25 μm);升温程序:初始温度50 ℃,恒温2 min,以10 ℃/min的速率升温至180 ℃,恒温1 min,再以3 ℃/min的速率升温至270 ℃,恒温14min;进样口温度:280 ℃;色谱-质谱接口温度:280 ℃;离子源温度:300 ℃;载气:氦气(He),纯度≥99.999%,流速1.2 mL/min;进样量:1 μL;进样方式:无分流进样,1.5 min后开阀;电离方式:电子电离(electron ionization,EI)源;电子能量:70 eV;驻留时间:2.5 min;溶剂延迟时间:3 min;采集参数:质谱多反应监测(multiple reaction monitoring,MRM)(参数见表1)。

表1 15种有机氯农药组分的CAS号、多反应监测参数Table 1 CAS number and multiple reaction monitoring parameters for 15 kinds of organochlorine pesticides

续表
1.3.3 标准曲线的配制
取两个10 mL容量瓶,其中一个容量瓶配10种混合标准中间液,另一个容量瓶配5种混合标准中间液,分别移取有机氯农药标准液(100 μg/mL、1.2 mL)各1 mL于2个10 mL容量瓶中,并用丙酮定容至刻度,即得质量浓度为10 μg/mL混合农药标准中间液,放入4 ℃冰箱中冷藏,有效期3个月。
分别移取标准中间液50 μL、100 μL、200 μL、500 μL、1 000 μL于10 mL容量瓶中,并用丙酮定容至刻度,即得质量浓度为0.05 μg/mL、0.10 μg/mL、0.20 μg/mL、0.50 μg/mL、1.00 μg/mL的标准工作液。按照1.3.2节气相色谱-质谱条件进行分析,以浓度为横坐标,定量离子对的峰面积为纵坐标进行线性回归。
1.3.4 不同溶剂对各组分响应值的影响
样品中残留农药的提取是食品中农药残留分析检测的关键环节,选择一个好的提取溶剂是保证农药残留检测准确性的前提条件,因此对样品残留农药提取溶剂尽可能选择能充分提取样品所含农药成分及其代谢产物,而又尽量少提取样品中其他干扰物质。按照1.3.1 QuEChERS前处理,考察乙腈、正己烷、二氯甲烷3种不同提取溶剂对刺梨中15种待测物提取效率。
1.3.5 不同净化剂对各组分响应值的影响
蔬菜水果中的色素、碳水化合物、有机酸等的净化程度会影响样品的回收率。目前QuEChERS方法常用的净化剂有PSA、C18、GCB等,不同类型的净化剂对最终待测物的提取效率有显著影响,选取PSA-GCB(1∶1)、PSA-C18(1∶1)、GCB-C18(1∶1)三种组合作为净化剂,按1.3.1 QuEChERS前处理,考察不同净化剂对刺梨的净化效果。
1.3.6 分析条件的优化
为进一步得到最优分析条件,分别选取不同萃取方法、正己烷萃取体积、PSA-C18不同配比组合吸附剂作为分析条件的3因素3水正交试验,试验设计见表2。

表2 检测条件优化正交试验因素与水平Table 2 Factors and levels of orthogonal tests for determination conditions optimization
1.3.7 方法的回收率与精密度试验
选取空白刺梨样品基质进行加标回收试验,分别准确添加25 μg/kg、50 μg/kg、100 μg/kg 3个浓度水平的15种有机氯农药混合标准溶液,按照1.3.1 QuEChERS前处理,每个浓度做6平行样品,回收率与精密度如表5所示。
2 结果与分析
2.1 15种有机氯农药混标溶液总离子流色谱图

图1 15种有机氯农药标准品的总离子流色谱图Fig.1 Total ions chromatogram of 15 kinds of organochlorine pesticide standards
2.2 15种有机氯农线性关系及方法检出限
以空白基质产生的3倍信噪比(S/N)计算检出限[19-20],15种有机氯农药保留时间、线性回归方程、相关系数及检出限见表3。由表3可知,15种有机氯农药在0.05~1.00 μg/mL浓度范围内线性关系良好,相关系数(R2)均大于0.997,检出限0.001 2~0.021 2mg/kg。
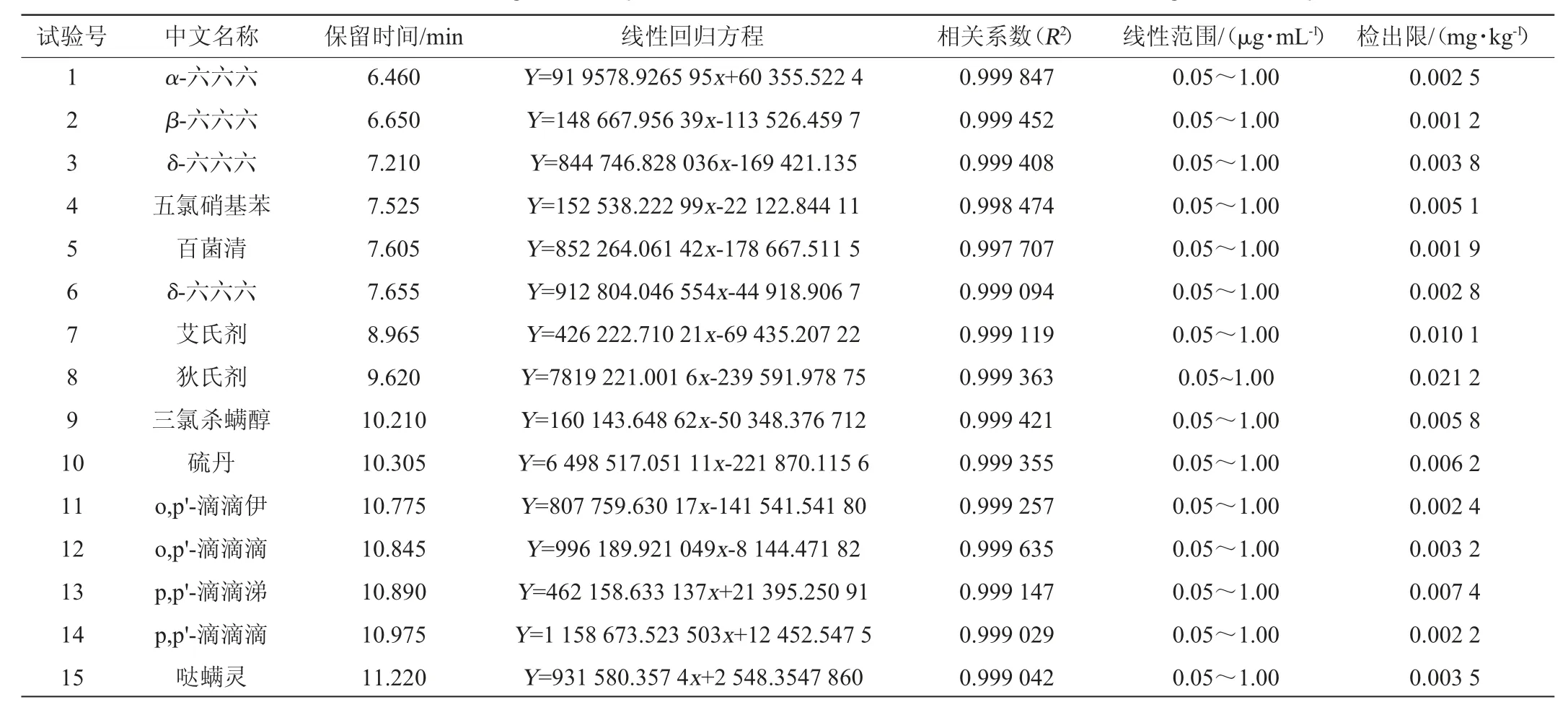
表3 15种有机氯农药的保留时间和线性回归方程及相关系数Table 3 Retention times,linear regression equations and correlation coefficients of 15 kinds of organochlorine pesticides
2.3 提取方法的比较
超声波萃取是基于超声波的特殊物理性质,主要是通过电压换能器产生的快速机械振动波来减少目标萃取物与样品之间的作用力,从而实现固-液萃取分离;QuEChERS萃取是一种适用于高含水量食物中农药多残留检测的样品处理和净化技术,简化了以前繁杂的萃取步骤并且扩大了所萃取农残的范围,因此在食品分析方法中得到了广泛应用;加速溶剂萃取是一种全新的处理固体和半固体样品的方法,通过升高萃取过程温度,提高萃取压力来实现快速、高效的萃取。由图2可知,超声波萃取、QuEChERS萃取、加速溶剂萃取各化合物回收率均在70%~110%,满足农药加标回收率要求。

图2 不同提取方法对回收率的影响Fig.2 Effect of different extraction methods on recovery rates
2.4 提取溶剂的选择
农药残留提取溶剂的选择应遵循“相似相溶”原理,应选择与待测农药极性相似的溶剂作为提取液,有机氯农药极性较弱应选择极性弱的溶剂作为提取液。由图3可知,乙腈、正己烷、二氯甲烷作为提取溶剂时,其平均回收率分别是89.07%、90.93%、81.80%;乙腈沸点较高,不利于浓缩,且价格较为昂贵,对一些热稳定性较差的有机氯农药提取效率有较大影响;二氯甲烷极性较强,其提取平均回收率相对较低,且二氯甲烷毒性较大,不利于实验人员的健康;故选正己烷作为提取溶剂。
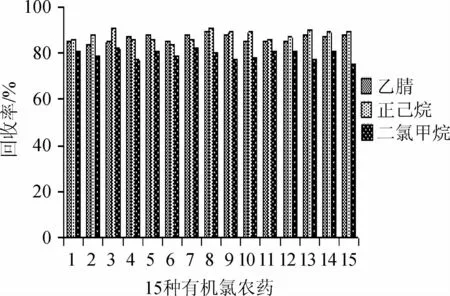
图3 不同提取溶剂对回收率的影响Fig.3 Effect of different extraction solvents on recovery rates
2.5 净化剂种类的选择
QuEChERS方法中最常用的三种净化吸附剂是PSA、GCB、C18。C18净化剂疏水性极强,能够有效去除样品中的脂肪酸和色素,同时它对非极性化合物具有较强的吸附作用[10];PSA对样品基质中各种色素、有机酸以及一些脂肪酸和糖具有良好净化效果[14];GCB可以有效的净化基质中类甾体、叶绿素等色素,但对脂肪的净化能力较差,且具有较强的吸附性,使一些农药不易洗脱,从而影响分析结果。为了能有效去除刺梨中杂质的干扰,本研究分别考察了PSA-GCB(1∶1)、PSA-C18(1∶1)、GCB-C18(1∶1)三种组合净化剂对刺梨中15种有机氯农药回收率的影响,结果见图4,PSA-GCB(1∶1)、PSA-C18(1∶1)、GCB-C18(1∶1)三种组合净化剂对刺梨净化效果的平均回收率分别82.27%、88.73%、81.40%,因此选择PSA-C18(1∶1)组合作为本实验的净化剂。

图4 不同净化剂对回收率的影响Fig.4 Effect of different purifying agents on recovery rates
2.6 分析条件的优化
分别选取不同萃取方法、正己烷体积、PSA-C18组合净化剂配比作为分析条件的3个影响因素,设计了3因素3水平的正交试验,试验结果及极差分析见表4。由表4可知,最优分析条件为QuEChERS作为样品前处理、正己烷体积为20 mL、净化剂为PSA(50 mg)-C18(50 mg)。按该条件进行3次平行验证试验,刺梨中15种有机氯农药的平均回收率为98.87%,优于其他试验条件所得的回收率,因此确认该方法为刺梨农药残留检测的最优分析条件。

表4 刺梨中有机氯农药残留检测条件优化正交试验结果与分析Table 4 Results and analysis of orthogonal tests for determination conditions optimization of organochlorine pesticide residues in Rosa roxbunghii Tratt
2.7 回收率与精密度试验结果
由表5可知,15种有机氯农药的平均回收率为81.98%~105.55%,精密度试验结果相对标准偏差(relative standard deviation,RSD)为1.23%~6.98%,符合GB/T 27404—2008《实验室质量控制规范食品理化检测》相应参数要求,表明该检测方法科学可行。

表5 15种有机氯农药回收率及精密度试验结果Table 5 Recovery rates and precision tests results of 15 kinds of organochlorine pesticides

续表
2.8 实际样品分析结果
采用该方法检测三种刺梨中15种有机氯农药,检测结果见表6。由表6可知,贵农一号刺梨、贵农七号刺梨中检测农药分别有2种呈阳性,分别是五氯硝基苯0.030 8 mg/kg、哒螨灵0.0581mg/kg、百菌清0.0653mg/kg、硫丹0.0397mg/kg;贵农九号刺梨中只有一种农药呈阳性:α-六六六0.0235mg/kg。
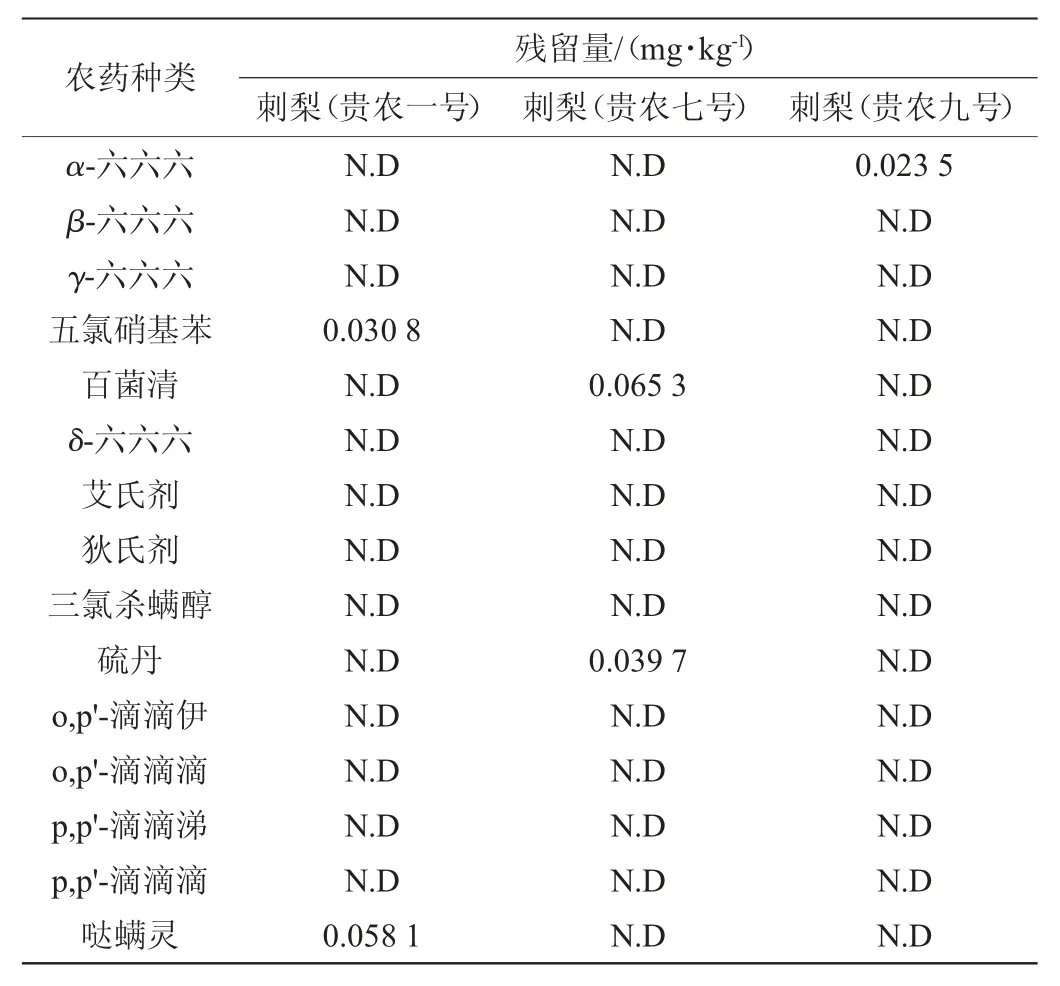
表6 刺梨样品中15种有机氯农药的检测结果Table 6 Determination results of 15 kinds of organochlorine pesticides in Rosa roxburghii Tratt samples
3 结论
建立QuEChERS-GCMS/MS法测定刺梨中15种有机氯农药残留的快速检测分析方法,该方法具有经济、快速、灵敏和足够精确等优势;且具有良好的线性关系、加标回收率均在81.98%~105.55%之间、仪器检出限(S/N=3)均在0.001 2~0.021 2 mg/kg区间,回收率的相对标准偏差(n=6)均小于10%,与其他农药残留检测方法比,具有提取效率高、溶剂用量少、操作简单等优势,在实际刺梨农药残留检测中得到了广泛应用,能满足日常的刺梨农药残留分析检测。
