辣椒酱发酵菌肠膜明串珠菌C27高密度培养条件优化
2020-05-12韩亚楠程方方武亚婷何欢欢宋文军苏丽明欧阳韶杨群慧
韩亚楠,程方方,武亚婷,何欢欢,宋文军,苏丽明,欧阳韶,杨群慧,武 运*
(1.新疆农业大学 食品科学与药学学院,新疆 乌鲁木齐 830052;2.天津商业大学 天津食品生物技术重点实验室,天津 300134)
肠膜明串珠菌(Leuconostoc mesenteroides)是一类进行异型发酵的革兰氏阳性兼性厌氧乳酸菌,是众多传统发酵制品中的优势菌群[1],具有高产酸、抗氧化和拮抗致病菌等能力,可应用于食品、化工、医疗等领域[2]。在食品行业,尤其在辣椒酱、泡菜等发酵食品中,肠膜明串珠菌通过作用于发酵初期,快速启动发酵,发酵糖类产生多种酸和醇,一方面赋予产品特有的风味、质地和口感,另一方面抑制了其他杂菌的生长,提高了产品的安全性[3-6]。
我国发酵辣椒酱历史悠久,传统发酵辣椒酱因为其发酵周期长、品质不稳定、亚硝酸盐易累积超标而逐渐被人工接种发酵辣椒酱所取代[7-8]。人工接种发酵的关键在于直投式发酵剂的开发,目前作为辣椒酱发酵专用直投式肠膜明串珠菌发酵剂的研究尚鲜见报道。MRS培养基作为乳酸菌的商业培养基已经广泛用于各种乳酸菌培养,但是不同乳酸菌菌株对营养需求不同,MRS培养基并不能使一些乳酸菌生长最大化[9-10]。发酵剂的生产和储存是发酵产品大规模生产的关键环节,而优化菌种培养基进行菌种高密度培养是其中的主要环节[11-12]。
实验室前期已利用传统筛菌方法从酸马乳中分离得到一株亚硝酸盐降解率高、发酵辣椒酱风味好的肠膜明串珠菌C27[5]。在此基础上,进一步研究肠膜明串珠菌C27高密度培养的培养基配方和培养条件,以期为辣椒酱专用肠膜明串珠菌发酵剂的工业化生产奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和原料
肠膜明串珠菌(Leuconostoc mesenteroides)C27:由新疆农业大学食品科学与药学学院实验室分离自酸马乳。土豆、西红柿、玉米、平菇:市售。
1.1.2 试剂
蔗糖、乙酸钠、磷酸氢二钾、硫酸镁、柠檬酸三铵、硫酸锰(均为分析纯):国药集团化学试剂有限公司;蛋白胨(生化试剂):山东玉宝生物科技有限公司。
1.1.3 培养基
MRS肉汤培养基、MRS琼脂培养基:北京奥博星生物技术有限责任公司。
1.2 仪器与设备
MJX-100B-Z生化培养箱:上海博迅实业有限公司医疗设备厂;TU-1810APC分光光度计:北京普析通用仪器有限责任公司;LDZX-50KBS高压灭菌锅:上海申安医疗器械厂;LE2002E电子天平、FE28 PLus pH计:梅特勒-托利多国际贸易(上海)有限公司。
1.3 方法
1.3.1 菌株活化
将保藏的肠膜明串珠菌C27接种于10 mL MRS肉汤培养基中,于37 ℃条件下培养24 h。然后按3%(V/V)的接种量接种于装液量为50 mL/250 mL MRS肉汤培养基中,37 ℃条件下培养24 h,备用。
1.3.2 菌密度测定及活菌数的测定
按1%的接种量将活化后的发酵液接种于试验设计的培养基中,37 ℃条件下培养24 h,发酵菌液稀释2倍,采用分光光度计在波长600 nm处测定吸光度值(OD600nm值)。采用平板计数法[13]测定发酵液的活菌数。
1.3.3 肠膜明串珠菌C27发酵培养基配方的优化
以MRS肉汤培养基为对照(CK),考察碳源种类、氮源种类及生长因子对肠膜明串珠菌C27菌体密度的影响。
碳源种类对肠膜明串珠菌C27菌体密度的影响:选择麦芽糖、果糖、乳糖、蔗糖作为碳源代替MRS肉汤培养基中的葡萄糖(20 g/L),用0.10 mol/L HCl调pH值至6.20±0.20,灭菌后分别接入1%(V/V)活化后的发酵液,37 ℃条件下培养24 h,测定菌体密度OD600nm值,确定最佳碳源。
氮源种类对肠膜明串珠菌C27菌体密度的影响:选择酵母浸粉、牛肉膏、胰蛋白胨、蛋白胨作为氮源代替MRS肉汤培养基中的氮源(牛肉膏、酵母膏、蛋白胨)(20 g/L),用0.10 mol/L HCl调pH值至6.20±0.20,灭菌后分别接入1%(V/V)活化后的发酵液,37 ℃条件下培养24 h,测定菌密度OD600nm值,确定最佳氮源。
不同生长因子对肠膜明串珠菌C27菌体密度的影响:分别取玉米汁、土豆汁、平菇汁、西红柿汁各10.00 g/L作为生长因子代替MRS肉汤培养基中的吐温-80,用0.10 mol/L HCl调pH值至6.20±0.20,灭菌后分别接入1%(V/V)活化后的发酵液,37 ℃条件下培养24 h,测定菌密度OD600nm值,确定最佳生长因子。
1.3.4 肠膜明串珠菌C27发酵培养基配方优化响应面试验[14-15]
选择蔗糖添加量(A)、酵母浸粉添加量(B)、土豆汁添加量(C)为考察因素,以菌体密度OD600nm值(Y1)为响应值,采用中心组合设计法(centralcompositedesign,CCD)设计3因素5水平的响应面试验,优化培养基配方,因素与水平见表1。
1.3.5 肠膜明串珠菌C27培养条件优化响应面试验[16]
选择培养温度(X1)、培养基初始pH值(X2)、接种量(X3)为考察因素,菌体密度OD600nm值(Y2)为响应值,采用中心组合设计法(CCD)设计3因素5水平的响应面试验,优化肠膜明串珠培养条件,因素与水平见表2。
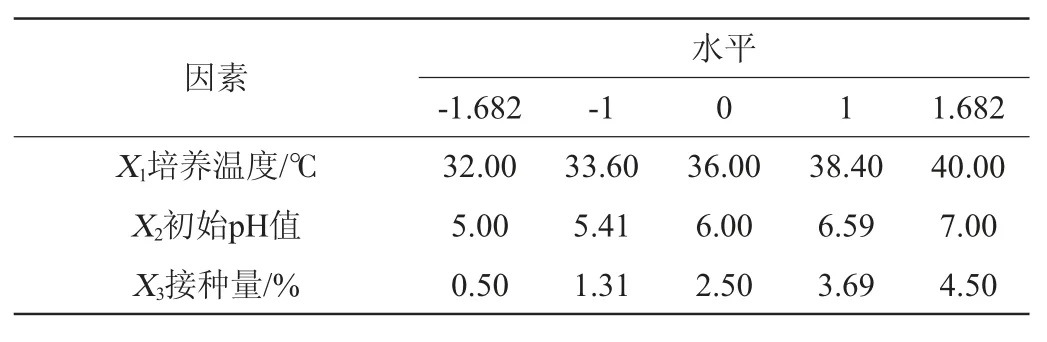
表2 培养条件优化响应面试验因素与水平Table 2 Factors and levels of response surface tests for culture conditions optimization
1.3.6 数据处理
利用Sigmaplot10.0及Design Expert V8.06软件进行数据统计及分析作图。
2 结果与分析
2.1 肠膜明串珠菌C27发酵培养基配方优化
2.1.1 最佳碳源的确定

图1 碳源种类对肠膜明串珠菌C27菌体密度的影响Fig.1 Effect of carbon sources types on the cell density of Leuconostoc mesenteroides C27
由图1可知,葡萄糖、麦芽糖、果糖、乳糖、蔗糖对肠膜明串珠菌C27菌体密度的影响不同,当蔗糖为碳源时,肠膜明串珠菌C27的菌体密度最高,OD600nm值为1.038,其次为果糖(0.624),乳糖(0.213)最低。因此,选择蔗糖为肠膜明串珠菌C27培养基的最优碳源,这与任芸香等[15]研究结果蔗糖是植物乳杆菌(Lactobacillus plantarum)R23的最佳碳源一致,说明蔗糖更容易被吸收利用。
2.1.2 最佳氮源的确定

图2 氮源种类对肠膜明串珠菌C27菌体密度的影响Fig.2 Effect of nitrogen sources types on the cell density of Leuconostoc mesenteroides C27
由图2可知,不同氮源对肠膜明串珠菌C27菌体密度的影响不同。当以酵母浸粉为氮源时,菌体密度最高,OD600nm值为0.719,相比于MRS肉汤培养基,OD600nm值是MRS肉汤培养基的1.51倍,其次是牛肉膏(0.355),蛋白胨(0.206)最低。分析原因可能是酵母浸粉中富含氨基酸及叶酸、尼克酸、钴胺素,且在中性和酸性环境中对热稳定[17]。因此,选择酵母浸粉为肠膜明串珠菌C27培养基的最优氮源。
2.1.3 最佳生长因子的确定

图3 不同生长因子对肠膜明串珠菌C27菌体密度的影响Fig.3 Effect of different growth factors on the cell density of Leuconostoc mesenteroides C27
由图3可知,相比于MRS肉汤培养基,土豆汁、玉米汁对肠膜明串珠菌C27的生长有明显促进作用,其中土豆汁促进作用最大,而平菇汁、西红柿汁对肠膜明串珠菌C27生长促进作用较小,因此,选择土豆汁为肠膜明串珠菌C27培养基的最优生长因子。
2.1.4 肠膜明串珠菌C27发酵培养基配方优化响应面试验肠膜明串珠菌C27发酵培养基配方优化响应面试验
结果见表3,方差分析见表4。
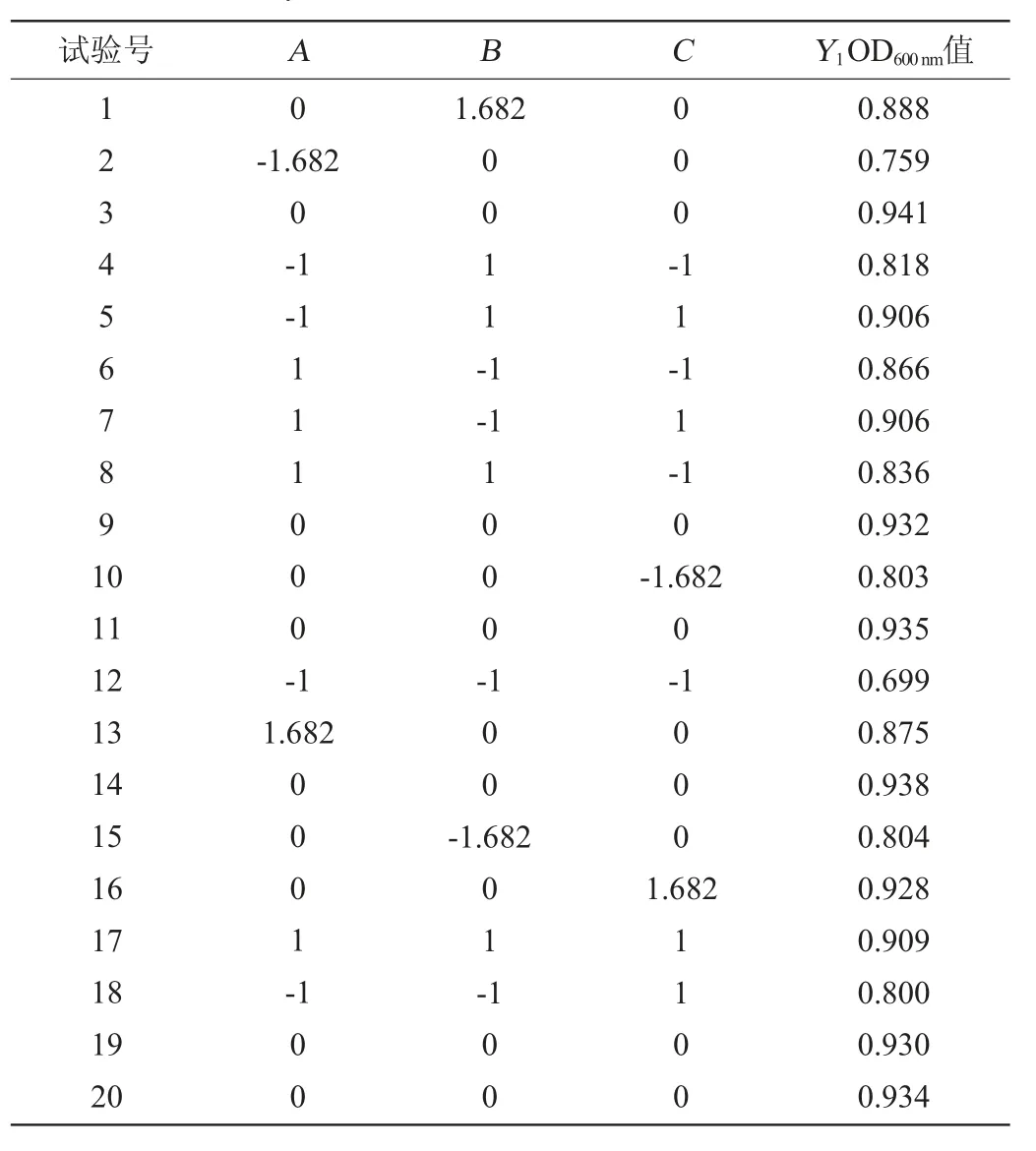
表3 发酵培养基配方优化响应面试验结果Table 3 Results of response surface tests for fermentation medium formula optimization
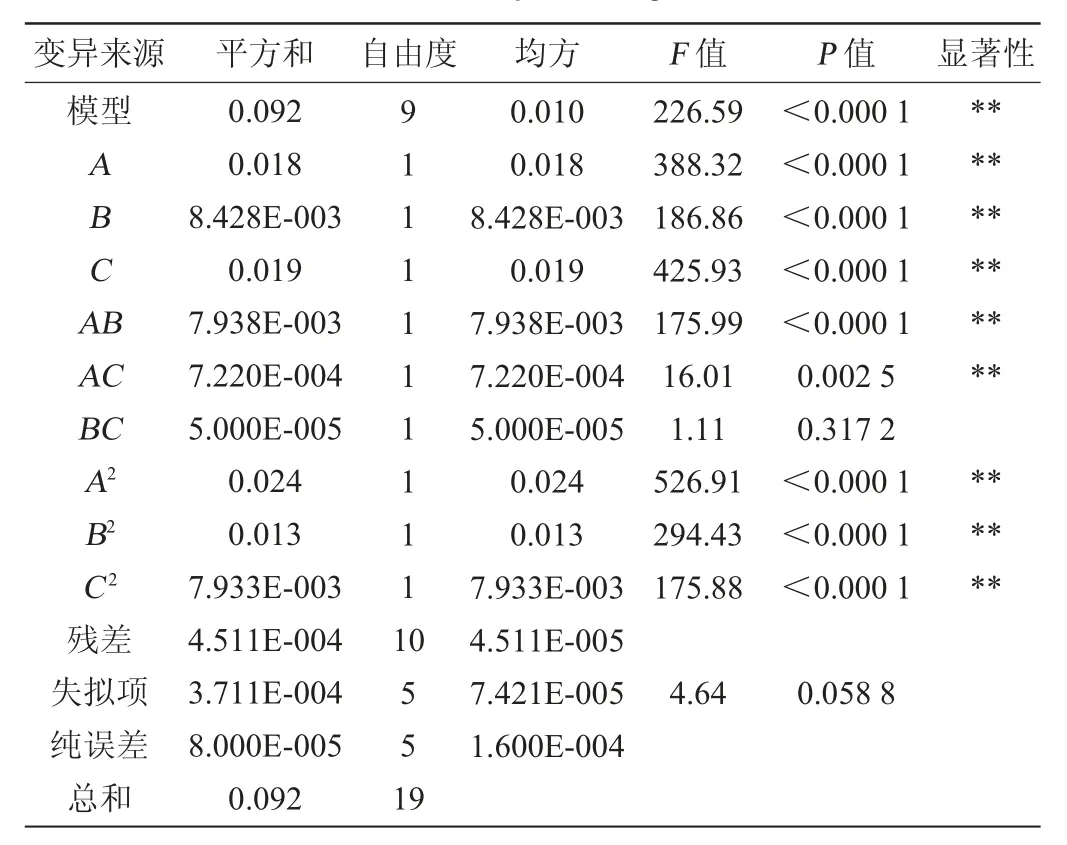
表4 回归模型的方差分析Table 4 Variance analysis of regression model
采用Design Expert V8.06软件对表3的数据进行多元回归拟合,得到以OD600nm值(Y1)为目标函数的二次回归方程:Y1=0.930+0.036A+0.025B+0.038C-0.041A2-0.030B2-0.023C2-0.031AB-9.500E-003AC+2.500E-003BC。由表4可知,模型极显著(P<0.01),失拟项不显著(P>0.05),说明所选模型和试验有较高的拟合度,可用于肠膜明串珠菌C27高密度培养培养基配方优化的预测。回归模型的校正决定系数为0.990 7,说明有99.07%的数据的变异性可由此模型来解释。由回归方程系数显著性检验可知,一次项A、B、C、交互项AB、AC与二次项A2、B2、C2对结果影响均极显著(P<0.01),交互项BC对结果影响不显著(P>0.05)。
响应面图形是响应值对各试验因子所构成的三维空间的曲面图,反映最佳参数及各参数之间的相互作用[18-20]。采用Design Expert V8.06软件根据回归方程式绘制响应面及等高线,结果见图4。
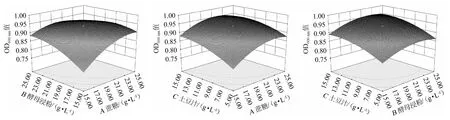
图4 蔗糖添加量、酵母浸粉添加量及土豆汁添加量交互作用对肠膜明串珠菌C27菌体密度影响的响应曲面及等高线Fig.4 Response surface plots and contour lines of effects of interaction between sucrose addition,yeast extract powder addition and potato juice addition on the cell density of Leuconostoc mesenteroides C27
由图4可知,3个响应面均为开口向下的凸型曲线,说明在选取的各因素水平范围内,响应值(菌体密度OD600nm值)存在极大值。由Design Expert V8.06软件分析得出,肠膜明串珠菌C27高密度培养的最优培养基配方为蔗糖添加量21.13 g/L,酵母浸粉添加量21.62 g/L,土豆汁添加量13.85 g/L。在此优化条件下,肠膜明串珠菌C27的菌体密度OD600nm值预测值为0.957。考虑实际操作的可行性,将最优培养基配方修订为蔗糖添加量21 g/L,酵母浸粉添加量22 g/L,土豆汁添加量14 g/L。为验证预测结果的可信度,在该最佳条件下重复试验3次,得肠膜明串珠菌C27菌体密度OD600nm值实际值为0.961,与预测值基本一致,说明响应面法优化得到的肠膜明串珠菌C27高密度培养的最优培养基准确可靠,可用于指导实际生产。
2.2 肠膜明串珠菌C27培养条件优化响应面试验
肠膜明串珠菌C27培养条件优化响应面试验结果见表5,方差分析见表6。
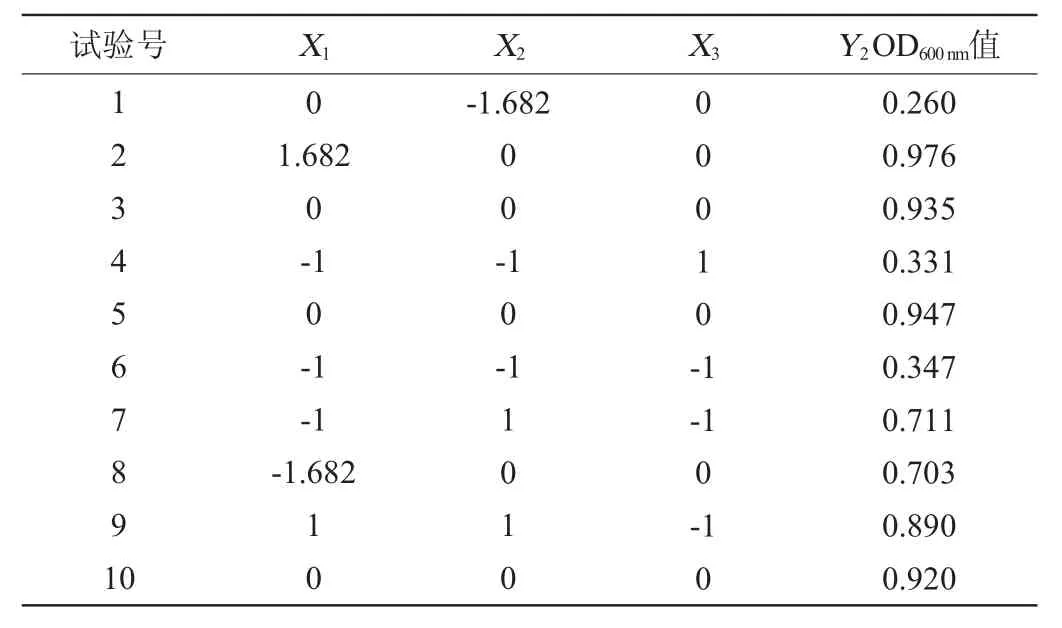
表5 培养条件优化响应面分析试验结果Table 5 Results of response surface tests for culture conditions optimization
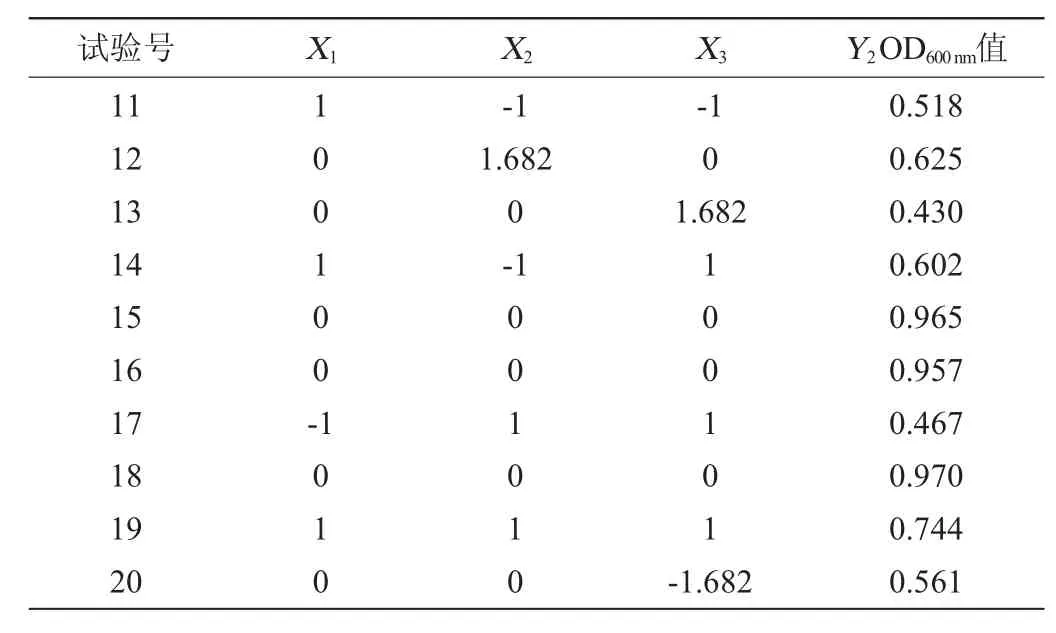
续表
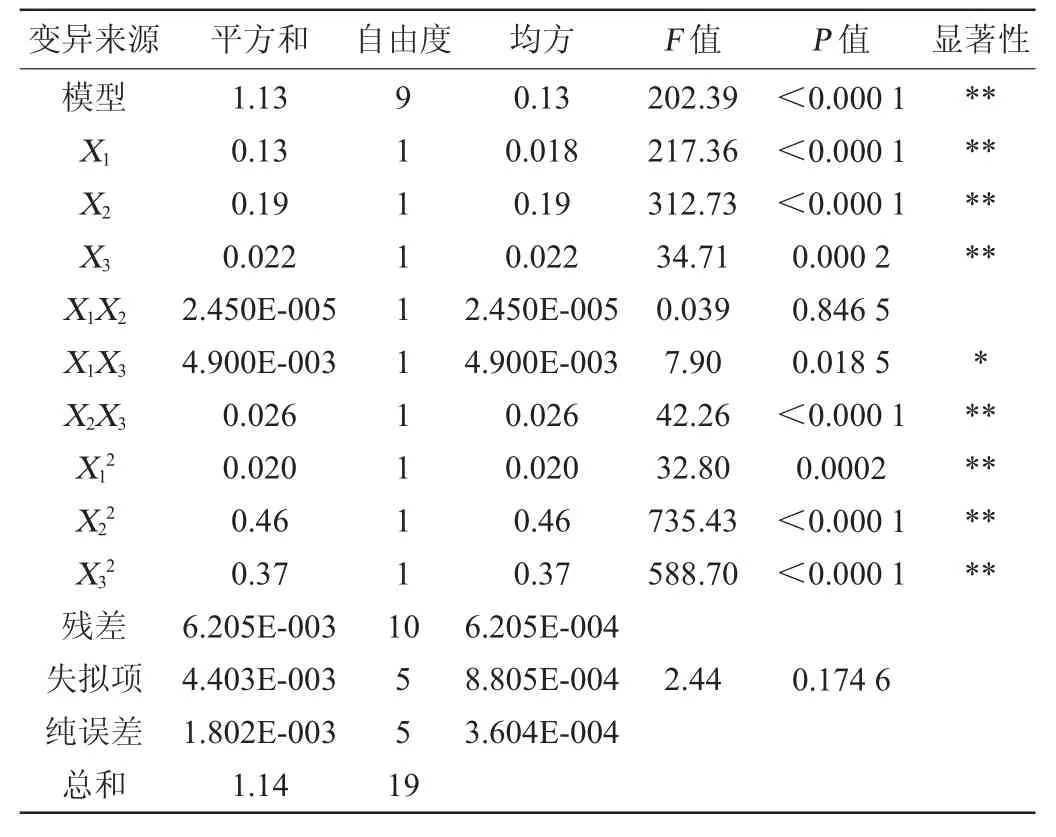
表6 回归模型的方差分析Table 6 Variance analysis of regression model
采用Design Expert V8.06软件对表5的数据进行多元回归拟合,得到以OD600nm值(Y2)为目标函数的二次回归方程:Y2=0.95+0.099X1+0.12X2-0.04X3-0.038X12-0.18X22-0.16X32+1.750E-003X1X2-+0.025X1X3-0.057X2X3。由表6可知,模型极显著(P<0.01),失拟项不显著(P>0.05),说明所选模型和试验有较高的拟合度,可用于肠膜明串珠菌C27高密度培养条件优化的预测。回归模型的校正决定系数R2Adj为0.989 6,说明有98.96%的数据的变异性可由此模型来解释。由回归方程系数显著性检验可知,一次项X1、X2、X3、交互项X1X3及二次项X12、X22、X32对结果影响极显著(P<0.01),交互项X1X3对结果影响显著(P<0.05),交互项X1X2对结果影响不显著(P>0.05)。
采用Design Expert V8.06软件根据回归方程式绘制响应面及等高线,结果见图5。
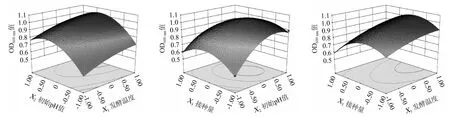
图5 培养温度、初始pH值及接种量交互作用对肠膜明串珠菌C27菌体密度影响的响应曲面及等高线Fig.5 Response surface plots and contour lines of effects of interaction between culture temperature,initial pH and inoculum on the cell density of Leuconostoc mesenteroides C27
由图5可知,3个响应面均为开口向下的凸型曲线,说明在选取的各因素水平范围内,响应值(菌体密度OD600nm值)存在极大值。由Design Expert V8.06软件分析得出,肠膜明串珠菌C27最佳高密度培养条件为培养温度38.38 ℃,初始pH值6.21,接种量2.37%。在此优化条件下,肠膜明串珠菌C27的菌体密度OD600nm值预测值为1.033。考虑实际操作的可行性,将最优培养条件修订为发酵温度38.4 ℃,初始pH值6.2,接种量2.4%。为验证预测结果的可信度,在该最佳条件下重复试验3次,得到肠膜明串珠菌C27的菌体密度OD600nm值实际值为1.034,活菌数为1.30×109CFU/mL,说明响应面法优化得到肠膜明串珠菌C27高密度培养条件准确可靠,可用于指导实际生产。
3 结论
本研究以MRS肉汤培养基为基础培养基,菌体密度OD600nm值为评价指标,采用单因素和响应面法优化得到肠膜明串珠菌C27高密度培养的最优培养基配方为:蔗糖添加量21 g/L,酵母浸粉添加量22 g/L,土豆汁添加量14 g/L;最优培养条件为培养温度38.4 ℃、初始pH值6.2,接种量2.4%。在此优化条件下培养24 h,肠膜明串珠菌C27的菌体密度OD600nm值达1.034,活菌数为1.30×109CFU/mL。
