血管内皮细胞生长因子在咬合创伤大鼠髁突软骨的表达
2020-05-12丛长虹吴立鹏
丛长虹,吴立鹏
(1.天津欧瑞圣彬科技有限公司和平区口腔门诊部,天津 300050; 2.佳木斯大学附属口腔医院 正畸科,黑龙江 佳木斯 154000)
血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)是对血管内皮细胞具有高度特异性的有丝分裂原[1],与细胞表面受体特异性结合后,产生促进新血管生成和增加血管通透性的作用,直接或间接调控血管发生、形成的各个环节,在胚胎发生、创伤愈合和肿瘤发生发展的过程中起重要作用[2]。咬合创伤是一种常见的口颌系统病理状态,这种病理状态不但引起牙体牙髓、牙周等病理性损害,也会对咀嚼肌、神经、颞下颌关节的改建和病变产生一定影响[3-4]。本实验通过抬高咬合的方法建立大鼠咬合创伤动物模型,采用免疫组织化学的方法观察了VEGF在咬合创伤不同时期髁突软骨的表达,探讨VEGF在髁突软骨破坏和改建中的作用。
1 材料与方法
1.1 实验动物和分组 选取2个月龄健康雄性Wistar大鼠50只,体质量240~260 g(由中国医学科学院实验动物中心提供),无缺牙、牙颌畸形及严重牙体组织磨损,标准条件下适应性喂养1周后进行实验。实验动物随机分为实验组(包括咬合创伤7 d组、14 d组、21 d组、28 d组)和对照组,每组10只。所有实验动物采用块状饲料喂养,自由饮食。
1.2 试剂 VEGF抗体(Santa Cruz,美国),抗体稀释液(DAKO,丹麦),通用型生物素化IgG(DAKO,丹麦),DAB显色试剂盒(Santa Cruz,美国)。
1.3 实验方法 实验组动物采用速眠新按0.001 mL·g-1体质量行左后肢肌内注射,麻醉显效后用自制牵引拉钩拉开上下颌,高速手机上直径1.0 mm金刚砂球钻打磨粗糙右上第一磨牙合面。将预先按合面大小修整好高0.5 mm的不锈钢舌侧扣用充填用复合树脂粘接于合面。
1.4 标本制备 对照组和各实验组动物到达预定时间点后,行速眠新麻醉,应用40 g·L-1多聚甲醛心脏灌注固定。切取右侧下颌骨髁突浸入40 g·L-1多聚甲醛液继续固定1周,混合脱钙液脱钙25 h。制成5 μm厚髁突矢状向连续石蜡切片,行HE染色和VEGF免疫组织化学染色。
1.5 免疫组织化学染色观察 石蜡切片经二甲苯脱蜡和梯度酒精水化;于室温下30 g·L-1H2O2孵育10 min,阻断内源性过氧化物酶,切片蒸馏水洗3次;微波修复抗原:将切片浸入0.01 M、pH 6.0的枸橼酸缓冲液中微波修复抗原,5 min 3次,然后室温冷却;PBS缓冲液洗3次,每次5 min;滴加血清封闭液,室温下20 min;滴加VEGF抗体,4 ℃孵育过夜;PBS冲洗3次,每次5 min,滴加通用型生物素化IgG,37 ℃下孵育20 min;PBS冲洗3次,每次2 min;DAB显色,蒸馏水冲洗;梯度酒精脱水,二甲苯透明,封片,光学显微镜下观察。阴性对照采用PBS代替一抗,其余步骤同上。
光镜下,细胞内出现均匀棕色染色定义为VEGF阳性。每个实验标本均随机选取4个高倍视野(×400),计数视野内阳性细胞总数,并通过公式:阳性细胞表达率=阳性细胞总数/细胞总数,计算阳性细胞表达率。

2 结果
2.1 石蜡切片HE染色结果 光学显微镜下,对照组髁突软骨分为4层结构:由表及里分别为关节表面带,主要由互相平行排列的胶原纤维构成,这些纤维与软骨表面平行,其间可见散在纤维细胞;增殖带,由7~10层排列比较密集的细胞构成,细胞体积较小,可见核分裂相;肥大带,含3~5列软骨细胞,细胞体积较大;钙化软骨带,是软骨与其下方的骨组织相互移行的部分。
实验组咬合创伤7 d时,未见明显的软骨表面形态变化,增殖带出现不同程度增厚,同时增殖带细胞数量增多;咬合创伤14 d,软骨表面曲度变平,增殖带的宽度继续增厚,并且软骨细胞增多;咬合创伤21 d,软骨表面变平,关节表面带局部变得不完整,增殖带细胞数量增多;咬合创伤28 d,软骨出现增厚,关节表面带不完整,增殖带细胞呈簇状增生,伴有软骨层次紊乱。见图1。
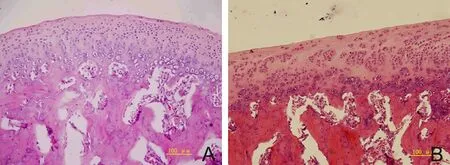
图1 对照组(A)和咬合创伤21 d组(B)髁突软骨(HE×200)
2.2 VEGF免疫组化染色结果 对照组VEGF阳性细胞主要分布于髁突软骨的增殖带和肥大带表层。咬合创伤7 d组、21 d组VEGF在髁突软骨各层细胞的表达均出现增强,在肥大带的表达增强尤为明显。见图2。咬合创伤28 d组VEGF的表达在髁突软骨各层均降低。各组髁突软骨VEGF阳性细胞率统计分析见表1。

图2 VEGF在对照组(A)和咬合创伤21 d组(B)髁突软骨的表达(免疫组化×200)

表1 各组髁突软骨VEGF阳性细胞率比较
注:与正常对照组相比,aP<0.05(Dunnett-t检验)。
3 讨论
咬合创伤是由于不正常的咬合接触关系和咀嚼系统的异常功能,造成咀嚼系统某些部位出现病理性损害或适应性变化。临床中不均匀的磨耗,牙周病,不良修复体,以及正畸治疗中均可能出现咬合创伤。咬合创伤的存在不但对受累牙的牙体、牙髓和牙周组织产生一定的影响,产生牙体磨损、折断、牙髓病变及牙齿松动、移位、牙槽骨吸收等损害,也会影响到颞下颌关节的功能和改建。已有研究表明,严重的咬合创伤可引起颞下颌关节骨关节炎[5]。
在大鼠第一磨牙上粘接充填树脂、正畸用不锈钢方丝或金属冠等方法是常用的建模方法[6-8]。本研究采用在大鼠右上第一磨牙上粘接预先调整的正畸用不锈钢舌侧扣的方法,使咬合抬高0.5 mm。舌侧扣具有网底,易于与磨牙牢固粘接,操作简单,且金属材质较耐磨,便于建立稳定的咬合创伤状态。
通过光学显微镜组织切片观察,咬合创伤初期,关节软骨表面开始出现形态变化。随着咬合创伤的持续存在,髁突软骨出现增厚,增殖带细胞体积变大,数量增多及软骨层次的紊乱,表明在咬合创伤初期,髁突软骨表现出适应性改变,随着咬合创伤的持续,髁突软骨变得逐渐失去代偿,进一步可能导致软骨病理性变化。
VEGF是血管源性多肽,对血管内皮细胞具有强大的特异性的促分裂和趋化作用[9]。在软骨的发育过程中,软骨肥大带细胞产生的VEGF通过与其受体结合,对发育期软骨的血管发生和血管新生起重要作用。实验中发现,VEGF在髁突软骨的表达主要在增殖带和肥大带,咬合创伤后,髁突软骨VEGF的表达水平逐渐增高,且在肥大带的表达增强更为明显。有文献表明,关节在机械负荷的作用下,VEGF通过自分泌的方式对软骨细胞产生影响[10]。关节软骨是一种无血管的组织,咬合抬高后,破坏了关节的正常应力结构,导致髁突软骨的负荷增加。咬合创伤导致的工作侧髁突压力增大,继而诱导产生VEGF,VEGF与软骨细胞表面受体结合后,导致基质产生破坏。结合前述的观点可以推测,VEGF在咬合创伤髁突软骨的改建过程中起重要作用,但确切的作用机制值得进一步探讨。另外,本文仅就咬合创伤时工作侧髁突软骨的VEGF表达进行了实验研究,非工作侧VEGF的表达尚需进一步观察。
