甘草多糖诱导的树突状细胞生物学特性研究
2020-05-11王树琪李华唐中生
王树琪 李华 唐中生

摘要:目的 从人外周血获取单核细胞,并利用GPS将其诱导分化为DCs,研究GPS对DCs分化成熟、表型的影响。方法 密度梯度离心法及细胞贴壁法获取人外周血单核细胞;对不同分组(细胞因子组、甘草多糖组、联合组)的单核细胞进行体外诱导培养;倒置相差显微镜、瑞氏-姬姆萨染色法观察各组DCs形态变化;Western Blot对比各组DCs标志物蛋白表达差异。结果 各组单核细胞体外培养均可诱导为DCs,符合DCs形态学特征,以联合组数量最多、体积最大、突起最显,细胞染色强于它组;Western Blot显示各组细胞标志物蛋白(CD80、CD40、CD83、CD86)均符合DCs表型特征,并随细胞成熟而表达增强,表达量以联合组最明显。结论 GPS可诱导DCs的分化成熟,且协同细胞因子效果更佳。这为进一步从DCs角度探讨GPS增强人体免疫和抗肿瘤机制提供了研究基础。
关键词:树突状细胞;甘草多糖;单核细胞;分化成熟;表型
中图分类号:R285 文献标志码:A 文章编号:1007-2349(2020)02-0072-07
树突状细胞(dendritic cells,DCs)作为目前功能最强的抗原提呈细胞(antigen presenting cell,APC),它能摄取各类抗1-3原,在机体细胞免疫和体液免疫调控中均起着重要作用。因此,从DCs角度来制备相应的抗肿瘤疫苗是当前肿瘤研究的热点[1]。DCs在人体内含量甚微,仅占外周血单核细胞的1%左右,因此体外培养和扩增DCs对制备抗肿瘤DCs疫苗具有重要意义。寻找合适的DCs前体细胞来源,体外诱导分化以獲得足量DCs来制备疫苗是DCs抗肿瘤治疗的前提和关键。国内外众多人员从中医药调节免疫和抗肿瘤的角度开展了很多研究,发现许多中药多糖可诱导DCs在体外的分化成熟,同时,在一定程度上呈剂量依赖性。甘草多糖(Glyeyrrhiza polysaeeharide,GPS)为中药甘草的重要有效成分,主要由鼠李糖、葡聚糖、阿拉伯糖和半乳糖组成,具有多方面的生物活性。药理研究发现[2],GPS具有免疫调节、抗肿瘤、抗病毒、抗氧化、防止骨关节炎等作用,而且具有无细胞毒性的特点。GPS能够提高人体免疫和抑制肿瘤生长,但其具体作用机制有待于进一步探讨。DCs的发现和研究的深入,为GPS免疫抗肿瘤的机制提供了新的视角,即GPS抗肿瘤的机制是否与DCs的增殖、成熟和表型以及功能的改变有关,其诱导成熟的DCs是否具有刺激T细胞增殖的能力,以及与经典细胞因子诱导的DCs在功能上有何区别等?明确GPS与DCs之间的相互作用,从而为GPS应用于临床抗肿瘤和制备相关抗肿瘤疫苗提供理论依据和基础研究支持。
1 实验材料
1.1 实验用人外周血 新鲜人外周浓缩白细胞血:由贵州省血液中心提供。
1.2 实验药物 甘草多糖:纯度>90%,购自南京景竹生物科技有限公司,批号15020609。
1.3 实验试剂 重组人粒细胞巨噬细胞集落刺激因子(rhGM-CSF)、重组人白细胞介素4(rhIL-4)、重组人干扰素α(rhTNF-α):美国PeproTech公司;淋巴细胞分离液(Ficoll,D=1.077 g/mL):达可为生物技术有限公司;快速瑞氏-姬姆萨染液试剂盒:南京建成生物技术有限公司;细胞膜蛋白抽提试剂盒:上海碧云天生物技术有限公司;BCA蛋白定量试剂盒、一步法快速WB试剂盒、抗β-Actin单克隆抗体、蛋白膜印迹再生液:北京康为生物技术有限公司;鼠抗人CD86、鼠抗人CD83、鼠抗人CD80、鼠抗人CD40:北京中杉金桥生物技术公司。
1.4 仪器和设备 CJ-1D型超净台:天津泰斯特公司;TS-100F型倒置相差显微镜:日本尼康公司;CUSA31311型CO2培养箱:美国Napco公司;MSL-3020型三洋全自动45171008型低温高速离心机:湖南长沙湘仪公司;TC20型细胞计数仪、Mini Trans-Blot型蛋白转印系统、164-5050型电泳仪、Mini-PROTEAN型蛋白电泳槽:美国Bio-Rad公司;LIDE20型扫描仪:日本佳能公司。
2 实验方法与结果
2.1 实验方法
2.1.1 单核细胞的分离及imDCs、mDCs的获取 取新鲜人外周浓缩白细胞血40 mL,加入1倍体积RPMI1640培养液,1:1稀释铺于淋巴细胞液面上(淋巴细胞分离液与稀释浓缩白细胞血比例为1:2),以室温,1800 rpm,18 min进行离心。吸取白膜层获得单个核细胞,并加入等体积RPMI1640培养液后,以室温、1000 rpm,10 min进行离心。弃去上清,根据混浊度重复1-2次。以适量RPMI1640 培养液重悬细胞沉淀,加入到75 cm3培养瓶中,培养箱内孵育1~3 h贴壁,即为单核细胞。
将细胞浓度调至5×105/mL,平均分为3组。A细胞因子组:加入rhGM-CSF液(终浓度为1000 U/mL)、rhIL-4液(终浓度为500 U/mL);B甘草多糖组:加入甘草多糖液(终浓度为400μg)。C联合组:加入rhGM-CSF液(终浓度为1000 U/mL)、rhIL-4液(终浓度为500 U/mL)及甘草多糖液(终浓度为400 μg)。入培养箱内常规培养5天,第3天培养基半换液,即可诱导为imDCs。各组imDCs 加入rhTNF-α(终浓度为50 U/mL)培养箱内常规培养3天,即可将 imDCs诱导成熟。
2.1.2 瑞氏-姬姆萨染色 取无菌24孔培养板,以多聚赖氨酸溶液进行包被,烘干清洗后照射紫外杀菌。将各组DCs细胞悬液接种于培养板中,入培养箱内培养1h使细胞贴壁,之后加入4%多聚甲醛固定液用以固定。最后使用快速瑞氏-姬姆萨染液试剂盒进行细胞染色。
2.1.3 免疫印迹法检测 使用细胞膜蛋白抽提试剂盒提取膜蛋白,以4℃,14000转离心5 min,收集上清即为细胞膜蛋白溶液。用酶标仪在562 nm处测定标准品液和各组细胞膜蛋白液的吸光值,并做好记录。对照本实验的蛋白分子量制作分离胶与浓缩胶,按预定上样顺序各样本各20 μL加入泳道,并将上样顺序记录。设置电泳条件,开始电压强度为80 V,电泳时间为30 min,电泳至整个条带进入分离胶后,将电压增加到120 V,稳压继续电泳,待预染蛋白质Marker条带分离清晰时停止电泳。电泳结束后低温转膜2 h。取下转好的PVDF膜,使用一步法快速WB(HRP)试剂盒说明进行操作。将各组PVDF膜放入蛋白膜印迹再生液中再生,并按说明进行内参处理。每个目的蛋白条带及内参条带做3次,曝光后得照片用扫描仪扫描,经Gelpro32 图像软件分析读取灰度值,应用相应软件进行处理,比较各组目的蛋白的表达情况。
2.1.4 统计学分析 统计学处理用SPSS 19.0软件完成,实验数据以平均值±标准差(x±s)为表示方式,采用单因素方差分析,P<0.05为差异有统计学意义,本文柱状图使用专业制图软件:GraphPad Prism软件制作。
2.2 实验结果
2.2.1 单核细胞的获取 每40mL 新鲜人外周血浓缩白细胞可获得1.5×107个单核细胞。倒置相差显微镜观察单核细胞呈圆形贴壁生长,表面光滑,细胞核多位于中央呈圆形。可见计划用于各组的单核细胞无明显差异可用于进一步实验,见图1。
2.2.2 imDCs细胞的获取与鉴定
2.2.2.1 倒置相差显微镜观察 各组imDCs生长状态良好,有悬浮现象,体积较单核细胞增大,大小不等,形态不规则,胞体较大的可见少量突起。镜下观察发现B组与C组细胞数量较A组有所增加,C组增多明显,见图2。
2.2.2.2 瑞氏-姬姆萨染色观察 各组imDCs体积增大,大小不等,形态不规则呈多边形,可见毛刺样突起,细胞核偏位多为圆形,细胞质染成蓝紫色。其中B组与C组的细胞数量较A组多而聚集,C组最明显,见图3。
2.2.2.3 Western Blot法检测imDCs标志物蛋白的表达情况 各组细胞均表达CD40、CD80、CD86,其中CD83各组表达不明显,符合DCs在未成熟阶段表达的特点,尤以联合组表达量最高。
2.2.3 mDCs细胞的获取与鉴定
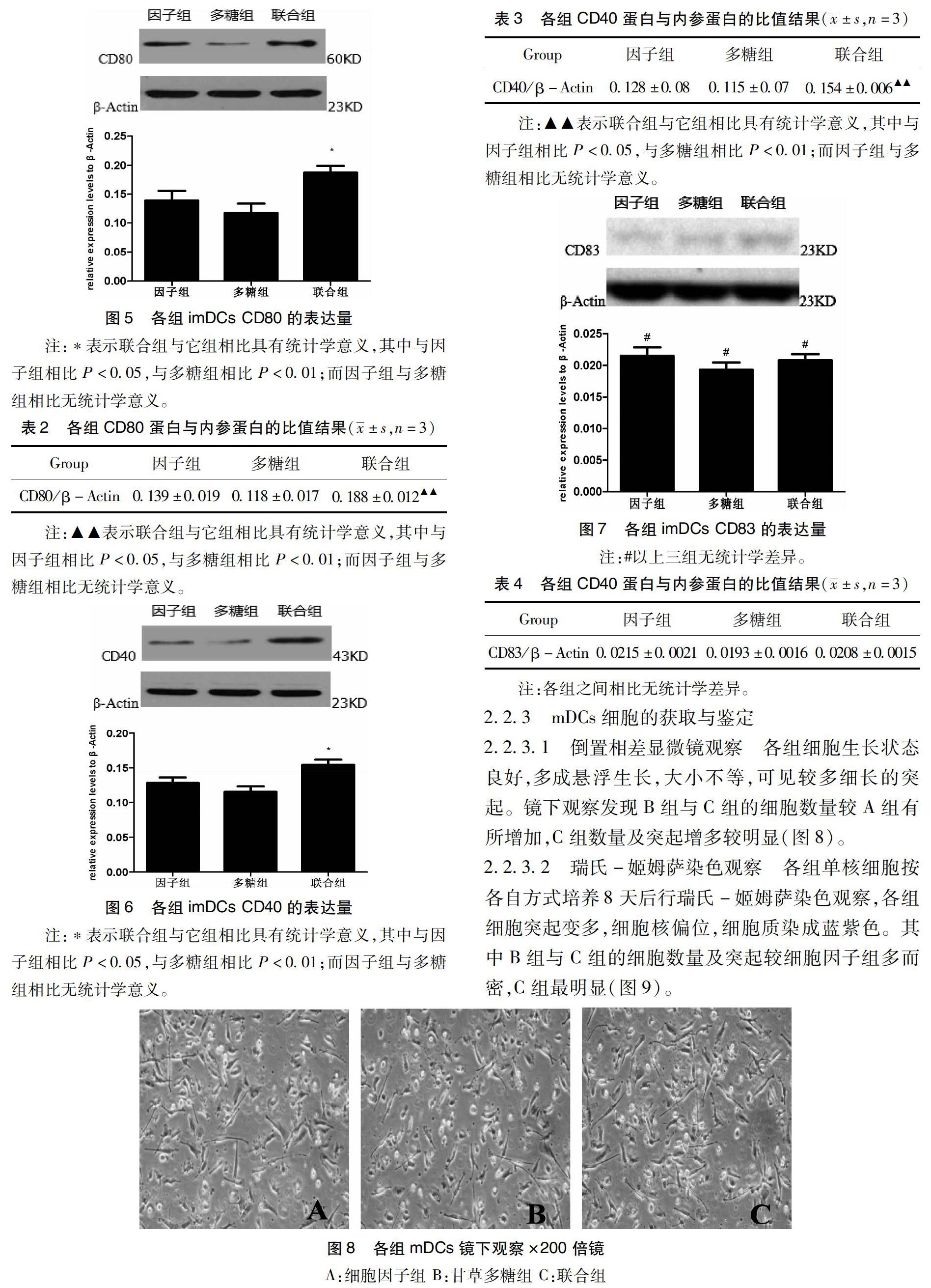
2.2.3.1 倒置相差显微镜观察 各组细胞生长状态良好,多成悬浮生长,大小不等,可见较多细长的突起。镜下观察发现B组与C组的细胞数量较A组有所增加,C组数量及突起增多较明显(图8)。
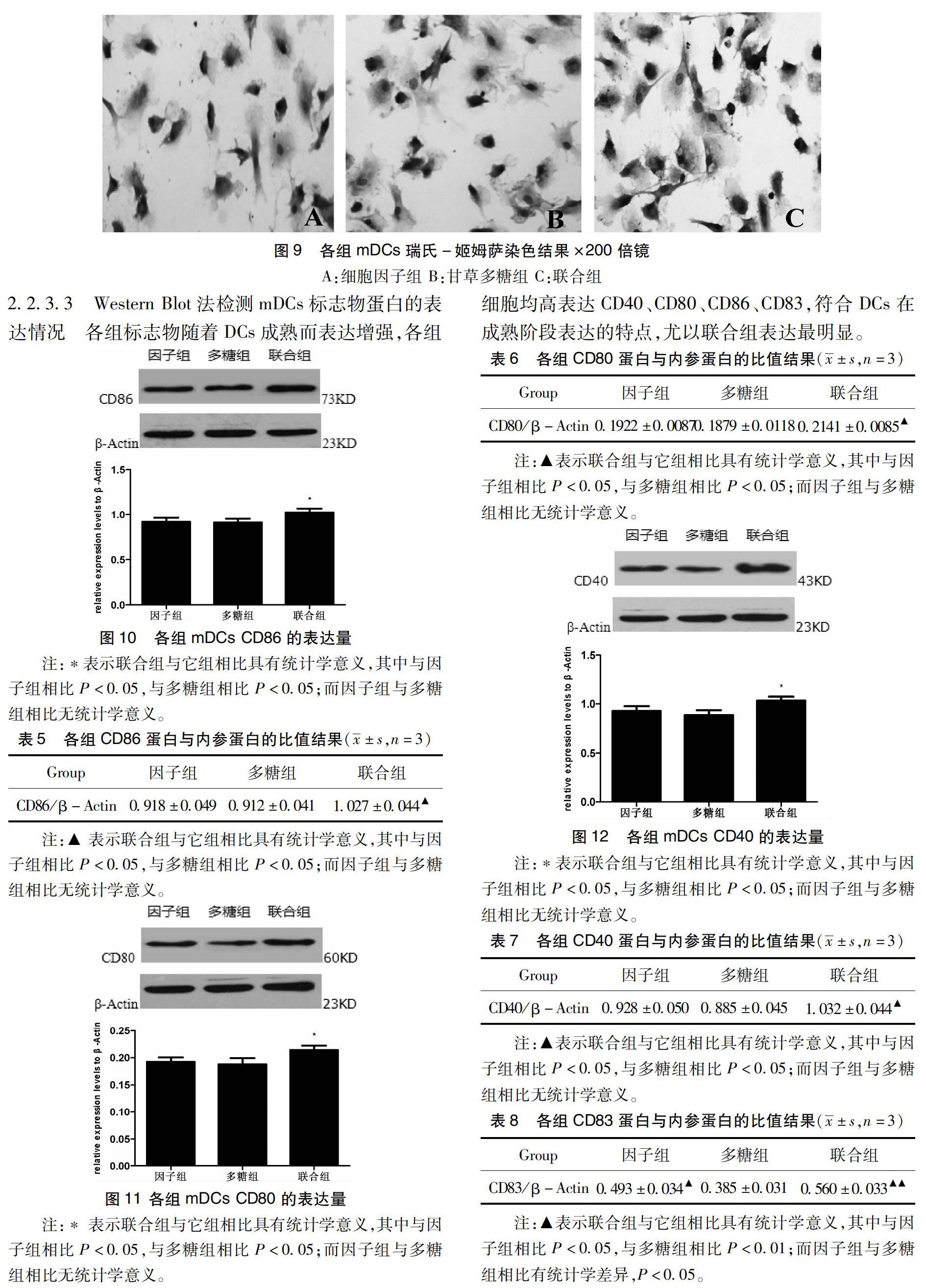
2.2.3.2 瑞氏-姬姆萨染色观察 各组单核细胞按各自方式培养8天后行瑞氏-姬姆萨染色观察,各组细胞突起变多,细胞核偏位,细胞质染成蓝紫色。其中B组与C组的细胞数量及突起较细胞因子组多而密,C组最明显(图9)。
2.2.3.3 Western Blot法检测mDCs标志物蛋白的表达情况 各组标志物随着DCs成熟而表达增强,各组细胞均高表达CD40、CD80、CD86、CD83,符合DCs在成熟阶段表达的特点,尤以联合组表达最明显。
3 讨论
中药甘草有“中药之王”之美誉,在中药的地位无法形容,其横贯中医方剂90%,又有“十方九草”之说,可谓为中药之宝。从中医理论出发认为甘草性味甘平,归心、肺、脾、胃经,具有补气健脾益、清热解毒、止咳化痰、缓痛止急、调和药性等作用;主治心气不足证,脾气虚证,咳喘症,脘腹、四肢挛急痛症,以及热毒疮疡、咽喉肿痛、药食中毒等症。大量实验研究也证实了甘草具有免疫调节及抗肿瘤的作用。随着中药甘草药理成分的深入研究,GPS作为甘草重要的有效成分,因其是一种对正常细胞无毒副作用免疫调节剂,对免疫系统发挥多途径调节作用,故越来越受到重視。笔者就是基于中药甘草及其主要成分GPS调节机体免疫的这一作用特点,与在机体免疫调控中发挥着重要作用且功能最强的抗原提呈细胞DCs结合起来,为进一步探讨中药甘草及GPS调节免疫及抗肿瘤等作用的药理机制提供理论依据。
DCs主要由CD34+造血干细胞或CD14+单核细胞产生,存在于人骨髓、脐血和成年人外周血中。骨髓获取痛苦,脐血来源不便,而外周血获取DCs操作简单,且以外周血单核细胞作为前体细胞诱导的DCs相对纯度比较高[4]。本课题组前期实验[3]以脐血单核细胞为前体细胞,分别以200μg/mL、400μg/mL、800μg/mL GPS悬液诱导DCs,发现以400μg/mL GPS组诱导DCs数量最多,最具形态学特征,此结果显示GPS可体外促进脐血单核细胞分化与成熟为DCs,并确定了最佳浓度。本实验通过加以改进的密度梯度离心法、细胞培养贴壁法,每40mL 新鲜人外周血浓缩白细胞可获得1.5×107个单核细胞。
多种细胞因子组合可诱导单核细胞分化成熟为DCs。经典的培养DCs的细胞因子组合是GM-CSF、IL-4,其中GM-CSF可促进髓系单核细胞、粒细胞发育,诱导DCs前体扩增分化,是DCs生成发育的根本因子;IL-4可抑制髓系向粒细胞、巨噬细胞分化,诱导DCs生长和成熟[5-6]。在此基础上加入TNF-α可进一步阻止粒系的分化而刺激DCs的成熟,并增强其抗原提呈能力,故TNF-α是DCs成熟的一种重要因子[7-8]。同时TNF-α作为第一信号而作用于DCs整个发育过程,特别是DCs早期生成的必须因子,可上调GM-CSF受体水平,进一步促进DCs前体细胞增殖与分化,且能保护DCs免于自发凋亡[9-10]。故我们实验设计也选用经典因子组合作为对照及联合培养组,结果显示甘草多糖组与经典因子组细胞形态相比无明显变化,均符合树突状细胞各阶段的形态学特征,并且联合组的DCs细胞数量、细胞体积、细胞突起等,均明显优于它组。说明甘草多糖可以直接促进单核细胞分化为imDCs,并可促进其分化成熟,协同细胞因子可使DCs数量增多,更具DCs形态学特征,且其细胞状态更佳。
外周血单核细胞来源的imDCs低表达CD40、CD80、CD86,CD83不表达或表达不稳定;而DCs高表达CD40、CD80、CD86,以及CD83;故本次实验选取这几个特异性的表面分子来观察甘草多糖对DCs表型的表达。本实验Western blotting检测结果显示:各组imDCs细胞均表达CD40、CD80、CD86,符合DCs在未成熟阶段表达的特点,其中CD83各组表达不明显,这与CD83作为成熟DCs的标志分子而在未成熟阶段表达不稳定相符;各组DCs细胞诱导成熟后CD40、CD80、CD86的表达量均有上调,且高表达CD83,符合DCs在成熟阶段表达的特点。各组对比DCs标志物蛋白的表达,发现无论处于未成熟还是成熟阶段,尤以联合组表达最强,特别是在成熟后联合组对CD86、CD80、CD40的表达与其它2组相比均有显著差异(P<0.05),但因子组与多糖组相比无明显差异,CD86、CD80、CD40与T细胞的活化增殖、细胞因子的分泌及免疫功能的增强有密切关系,说明联合组DCs的免疫功能明显强于因子及多糖组,而GPS诱导的DCs与经典细胞因子诱导的DCs相比在其表型的表达及免疫功能方面无较大差异。这一结果证实了GPS可诱导人外周血单核细胞分化成熟为DCs,且协同细胞因子诱导效果更佳,为我们以后获得DCs提供了简便、经济的方法。
从本课题实验可以看出,GPS能诱导人外周血单核细胞分化成熟为DCs,且协同细胞因子可使DCs数量增多,更具DCs形态学特征,且其细胞状态更佳。此研究结果说明中药甘草及GPS增强免疫、抗肿瘤的机制可能与影响DCs细胞增殖、分化成熟、表型以及功能有关。
参考文献:
[1]沈季敏,刘欣.基于树突状细胞的肿瘤免疫治疗临床应用方式的研究进展[J].临床血液学杂志,2018,31(1):62-65.
[2]祁增,郑炳真,刘金平,等.甘草生物活性的研究进展[J].特产研究,2016,20(5):71-76.
[3]唐中生,罗亚非,谢高宇,等.不同浓度甘草多糖促进脐血源树突状细胞分化与成熟的研究[J].现代免疫学,2013,33(6):89-91.
[4]郭振红,曹雪涛.肿瘤免疫细胞治疗的现状及展望[J].中国肿瘤生物治疗杂志,2016,23(2):149-160.
[5]Hu W,Jain Y,Dozmorov IM,et al.Differential outcome of TRIF-mediated signaling in TLR4 and TLR3 induced DC maturation[J等].Proc Natl Acad Sci USA 2015;112(45):13994-9.
[6]den Haan JM,Arens R,van ZelmMC.The activation of the adaptive immunne system:Crosstalk between antigen-presenting cells,T cells and B cells[J].Immunol Leett 2014;162(2):103-12.
[7]Delirezh N,Majedi L,Asri Rezaei S,et al.Generation of maturemonocyte-derived dendritic cells in the presence of heparin and monocyte conditioned medium:phenotypic and functional comparison[J].Iran Biomed,2011,15(3):79-84.
[8]Han T H,Jin P,Ren J,et al.Evaluation of 3 clinical dendritic cell maturation protocols containing lipopolysaccharide and interferongamma[J].Immunother,2009,32(4):399-407.
[9]陸莹,罗亚非,唐中生,等.桂枝茯苓丸对脐血来源树突状细胞分化成熟及免疫活性的影响[J].中国民族民间医药,2019,28(2):6-9.
[10]Ding Y,Guo Z,Liu Y,et al.The lectin siglec-G inhibits dendritic cell cross-pressentation by impairing MHC class I-peptide complex formation[J].Nat Immunol,2016,17(10):1167-1175.
(收稿日期:2019-10-28)
