ARTP诱变甘蔗胚性愈伤组织以提高其抗草甘膦能力研究初报
2020-05-11黄忠兴何慧怡樊丽娜劳方业吴嘉云凌秋平徐苑娴
黄忠兴,何慧怡,樊丽娜,劳方业,吴嘉云,凌秋平,徐苑娴
(广东省生物工程研究所(广州甘蔗糖业研究所) 广东省甘蔗改良与生物炼制重点实验室,广东广州510316)
0 引言
甘蔗产业的发展离不开甘蔗良种,培育抗逆性强的甘蔗良种非常重要。目前推广的栽培品种在生产过程中存在或多或少的缺点,如抗性(抗旱性、抗除草剂、抗病性、抗寒性等)方面存在一些的问题。抗除草剂作物的广泛应用带来巨大的农业变革与增产效益[1]。长期以来,甘蔗育种采用常规杂交育种,需要耗费大量人力、物力和财力,且育种周期长、筛选困难[2]。科技日新月异的时代,转基因是改良作物短板最快捷的途径。但基于目前对转基因农产品因安全性而难以推广的问题[3],甘蔗诱变育种是进行甘蔗品种改良的另一快速和有效途径。在这方面,前人利用化学诱变[4]和 Co60辐照诱变[5-7]比较多。但这些诱变手段存在一些问题:化学诱变手段不仅存在处理量小和操作过程中高感染的问题;Co60-γ射线辐射诱变需要特殊的场所和保护措施。而常压室温等离子体(Atmospheric and Room Temperature Plasma,ARTP)诱变育种技术因其放电均匀稳定、活性粒子浓度高、操作简便、诱变快速、环境友好、对操作者安全、无辐射、操作可控性强等特点,已成为一种应用广泛的、快速高效的新型生物诱变育种方法。目前已成功应用于包括细菌、放线菌、真菌、酵母、微藻等在内的40余种微生物的诱变育种[8-15],植物方面在华山松种子诱变方面也有成功的案例[16]。目前国内关于ARTP诱变甘蔗抗性的研究鲜有报道。本研究以甘蔗胚性愈伤组织为试验材料,利用ARTP对其进行不同时间和草甘膦浓度处理,测定和分析诱变处理后胚性愈伤组织成活率,以期为以后筛选高抗草甘膦甘蔗材料提供理论依据。探索ARTP诱变甘蔗胚性愈伤组织最佳的处理技术和方法。
1 材料与方法
1.1 试验材料
1.1.1 试验材料
试验处理 3种基因型甘蔗材料:大茎野生种S.robustum Brandes and Jesw. ex GrassⅠ后代(包括ROC22,粤糖94-128),斑茅E.arundinaceum (Retz.)Jeswit后代(崖城07-71)[17],割手密S.spontaneum L.后代(包括粤糖 93-159,粤糖 00-236),均采自广东省生物工程研究所(广州甘蔗糖业研究所)翁源基地。
1.1.2 试验仪器
HPD-280型ARTP育种机:南京苏曼等离子科技有限公司生产。
1.1.3 试验试剂
95%草甘膦原粉:河南今越生物技术有限公司出品;30% H2O2:消毒用。
1.1.4 试验培养基制备
愈伤组织启动培养基CM1:MS培养基+2,4-D 2.0 mg/L+蔗糖30 g/L+琼脂8 g/L,pH值6.2。培养皿分装。
缓冲培养基CM2:MS培养基+蔗糖30 g/L+琼脂8 g/L,pH值6.2。培养皿分装。
筛选培养基CM3:MS培养基+蔗糖30 g/L+琼脂8 g/L,pH值6.2。玻璃瓶分装。灭菌后分别加入草甘膦 0、0.5、1.0、1.5、2.0、2.5 μmol/L。
1.2 试验地点
广东省生物工程研究所(广州甘蔗糖业研究所)实验室。
1.3 试验方法
1.3.1 甘蔗愈伤组织启动
待蔗茎长出后,割取健壮蔗株尾梢,剥去外部叶片,无菌条件下用75%酒精消毒30 s,切除外层和两端叶片(叶鞘),留下生长点以上10~50 mm嫩叶(嫩鞘)并切成约2 mm的薄片,接种于培养基CM1中,在 26~28℃黑暗条件下培养,每皿 6~8块,诱导产生愈伤组织,然后继代 1~2次,每皿 6~8块,使其产生胚性愈伤组织。
1.3.2 ARTP防菌处理
处理前先盛30% H2O220 mL在培养皿中,放在处理室中,采用抽真空方式进行弥漫消毒。以氮气作为保护性气体。
1.3.3 诱变操作处理
取甘蔗胚性愈伤组织(米黄色)约90粒,然后将铺满胚性愈伤组织的培养皿上盖打开,置于处理室正中位置,按照等离子体操作说明进行辐照诱变。处理完后盖好培养皿上盖,采用聚乙烯薄膜密封。保护性气体为氮气,流量为1.2 L/min,抽真空减压处理,处理功率取中间值为170 W,处理时间设0、80、100、120、140、160、180 s。
1.3.4 缓冲培养
处理后的愈伤组织接种在 CM2进行缓冲培养8~10天,每个培养皿接30粒。
1.3.5 草甘膦胁迫筛选
然后将经过缓冲培养的胚性愈伤组织接种在含有 0、0.5、1.0、1.5、2.0、2.5 μmol/L浓度梯度草甘膦的培养基CM3上进行筛选,每个培养皿接20粒。共42个处理,各设3个重复。筛选时长为7天。
1.3.6 数据测定
参照蔡聪[18]记录各阶段甘蔗胚性愈伤组织(米黄色)的活愈数,并按照下列公式计算活愈率:活愈率=接种后胚性愈伤组织成活数×100%/接种前胚性愈伤组织数
1.4 统计分析
所有数据经整理后,利用 Excel 2007和 DPS 7.05软件进行统计分析。
2 结果与分析
2.1 ARTP诱变处理后各基因型材料的活愈率
不同基因型甘蔗胚性愈伤组织经过ARTP诱变处理80~180 s后,接种在含草甘膦0~2.5 μmol/L浓度梯度的筛选培养基 CM3上,30天后统计活愈率。测定结果见表1和图1。
由表1可知,不同基因型甘蔗胚性愈伤组织的平均活愈率存在一定的差异。含割手密血缘后代材料和大茎野生种血缘后代材料的平均活愈率分别是17.7%和 16.1%,且显著低于含斑茅血缘后代材料(27.2%)。根据杜丹清等[19]、马娜娜等[20]的诱变理论研究,80%~90%的致死率有利于正突变体的产生。甘蔗胚性愈伤组织与微生物都是有生命的物质,对辐射诱变感应具有相似性,即经处理后活愈率偏低(10%~20%)的甘蔗胚性愈伤组织细胞内的 SOS修复机制的容错率比较高,最易产生正突变。因此,选取含割手密血缘后代材料和含大茎野生种血缘后代材料来诱变比较合适。

表1 不同基因型甘蔗胚性愈伤组织的平均活愈率
2.2 ARTP诱变时间的选择
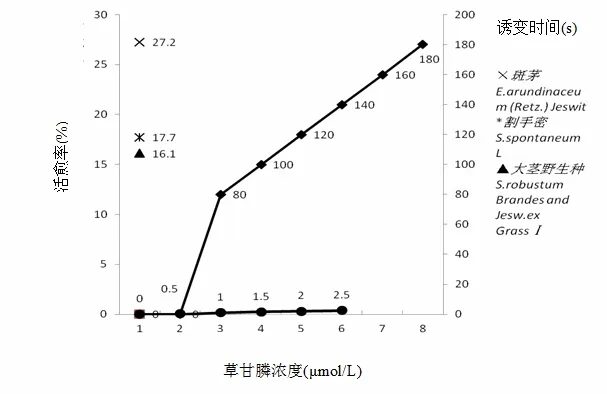
图1 不同基因型甘蔗胚性愈伤组织不同时间处理下和草甘膦浓度梯度筛选下的活愈率
从表 2、图 2可以看出,随着诱变处理时间的增加,胚性愈伤组织活愈率越来越低,当诱变处理时间在120 s时,3种基因型甘蔗的致死率一致达到80%以上。因此,诱变时间最合适的是 120 s。在140~160 s区间内,割手密、大茎野生种的材料致死率仍在85%以上,这个时间阶段仍可选择性地加以利用。
2.3 ARTP诱变后接种培养基中草甘膦浓度的选择
从表 3、图 3可以看出,随着草甘膦浓度梯度增加,接种的胚性愈伤组织活愈率越来越低,当草甘膦浓度在1.5 μmol/L时,3种基因型甘蔗的致死率首次一致达到 80%以上(即活愈率 20%以下),当草甘膦浓度2.5 μmol/L时,含斑茅血缘后代材料和割手密后代材料的致死率仍在 80%~90%。因此,为筛选到抗性强的材料,诱变后的愈伤组织可接种在含草甘膦1.5 μmol/L的培养基上进行首次筛选,一周后再转接到2.5 μmol/L草甘膦培养基上进行第2次筛选。
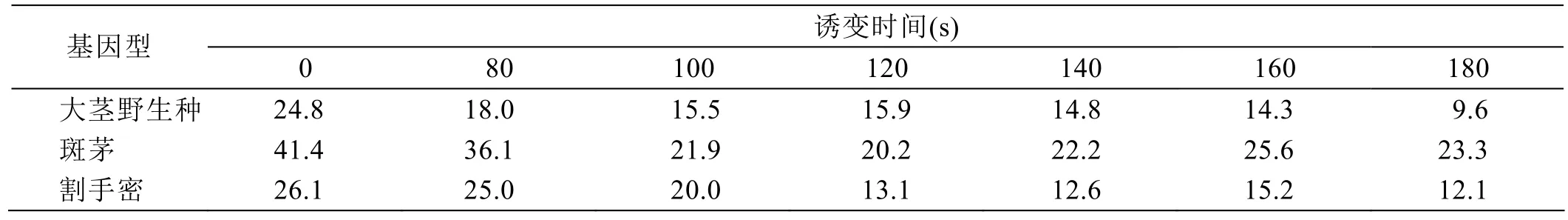
表2 不同基因型甘蔗胚性愈伤组织在不同时间诱变处理下的活愈率 单位:%
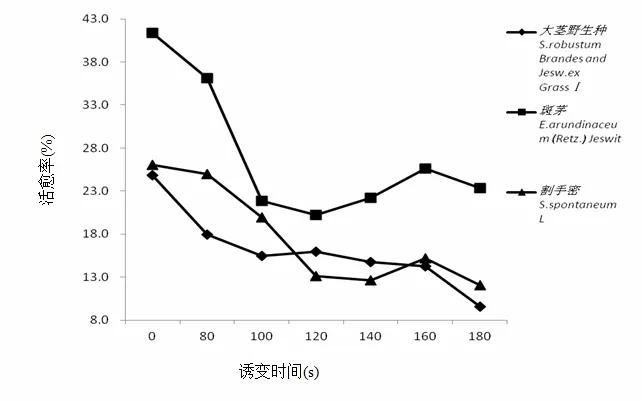
图2 不同基因型甘蔗胚性愈伤组织随着诱变时间增长的成活率变化图
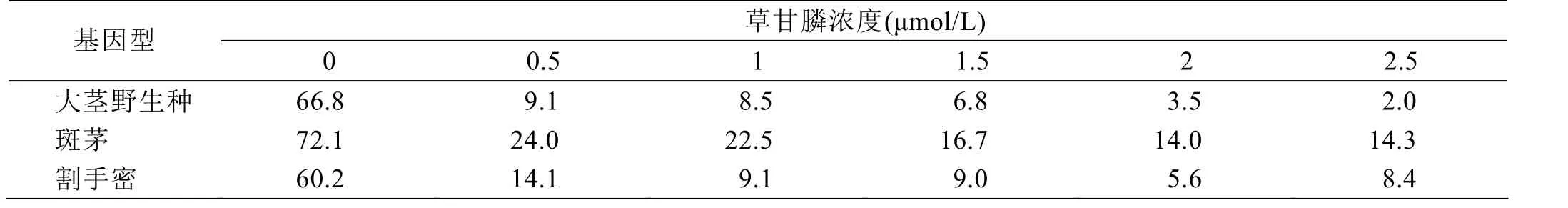
表3 不同基因型甘蔗胚性愈伤组织在不同草甘膦浓度筛选处理下的活愈率 单位:%
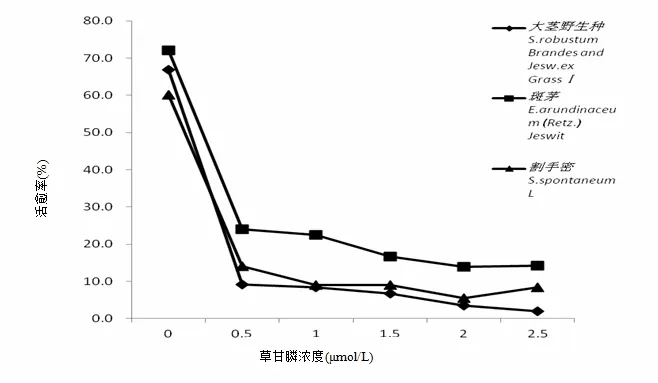
图3 不同基因型甘蔗胚性愈伤组织在草甘膦浓度梯度筛选下的成活率变化图
3 结论与讨论
ARTP诱变技术作为一种新型诱变技术,具有诱变温度低、与细胞作用明显、高活性离子体射流均匀等特点,与传统的物理诱变技术相比较易操作,安全性高且无污染[21]。ARTP具有操作简易、成本低、与生物大分子和细胞作用明显等优点,已成为快速突变微生物基因组的有效方法[22-24]。艾江宁等[25]用ARTP对湛江等鞭金藻进行诱变,以致死率99%的条件进行诱变,每次诱变时间 25 s。由于诱变后还要进行除草剂的筛选,本研究以致死率80%~90%的条件进行诱变选择,结果表明:取含割手密血缘的后代材料和含大茎野生种血缘的后代材料来诱变的突变率高;ARTP每次诱变最合适时间是120 s,这个时间与曹茜、冯凤琴研究的诱变时间一致[26]。
为减少筛选的工作量,本研究对起定向筛选作用的草甘膦用量作了探索。结果表明:二步筛选是比较可靠。即诱变后的胚性愈伤组织首先接种在含有1.5 μmol/L草甘膦的培养基上,7天后再接种在含有2.5 μmol/L草甘膦的培养基上进行筛选,以逐渐提高胚性愈伤组织对草甘膦的抗性。
本研究只是对甘蔗胚性愈伤组织抗性筛选的前期研究,后续还要对具有抗性的胚性愈伤组织分化做进一步研究。
