新型冠状病毒SARS-CoV-2 及临床相关药物研究进展
2020-05-10顾云双李明峰孙建国
顾云双,李明峰,孙建国
(中国药科大学药物代谢动力学重点实验室,江苏 南京210009)
在科技文明飞速发展的今天,紧随人类脚步的不仅有人类社会的进步,也有病毒的突变和进化。已知的第1 株病毒——烟草花叶病毒于1899 年被发现并命名,如今被人类发现的病毒已多达5 000余种。面对许多病毒我们束手无策。1918 年起源于美国的甲型流感病毒夺走了5 000 多万人的生命;病死率高达50% ~ 90%的埃博拉出血热更是难以摆脱的噩梦;始终无法攻克的艾滋病、发病后死亡率100%的狂犬病毒、2003 年的重症急性呼吸综合征(SARS)-冠状病毒(CoV)都是至今无法解决的难题。近年来流行的H5N1、H7N9 等禽流感病毒和中东呼吸综合征(MERS)-CoV 也对人类造成很大危害。
回顾过去几年发生的危机,我们可以看到,面对病毒,无数学者投身科研、医学工作者投身前线,寻找有效的治疗方案,为患者寻求生机。2003 年SARS 病毒爆发,糖皮质激素、抗菌药物、抗病毒药(利巴韦林、洛匹那韦/利托那韦)、中药(甘草甜素)、单克隆抗体、干扰素等都被应用于临床,针对SARS 病毒的疫苗也在研制中,但至今还无特效药。2012 年起源于中东的MERS-CoV 感染爆发,主要采用干扰素和霉酚酸进行治疗[1],期间也使用了抗病毒药物。早在1976 年就被发现的埃博拉病毒几十年间数次爆发,目前也研发了针对埃博拉病毒的调和性抗体Zmapp、siRNA 片段TKM-Ebola 等[2],在抗击病毒的过程中,我们不断收获经验。
2019 年12 月新型冠状病毒(SARS-CoV-2)肺炎(NCP,也称COVID-19)被首次发现并发生快速传播,目前已经发生了全球范围内的感染,造成了极大的损失和恐慌。增加对SARS-CoV-2 的认识和加速开发抗病毒药物刻不容缓。本文将从冠状病毒的分类、传播机制、治疗方案及相关药物等方面进行综述,并从药代动力学角度对药物治疗方案进行分析,为有效阻止疫情提供参考。
1 冠状病毒
1.1 分类
冠状病毒属于套式病毒目、冠状病毒科、冠状病毒属。国际病毒学分类委员会(ICTV)将冠状病毒科分为3 个属即α、β 和γ 属。2010 年中国香港学者Woo 等[3]在论文中将新发现的一类病毒称为δ 属。α 属冠状病毒包括α 属冠状病毒1、人冠状病毒229E(HCoV-229E)、人冠状病毒NL63(HCoV-NL63)、长翼蝠冠状病毒HKU1、长翼蝠冠状病毒HKU8、菊头蝠冠状病毒HKU2 和猪流行性腹泻病毒(PEDV)等8 个种。β 属冠状病毒包括β 冠状病毒1、人冠状病毒OC43(HCoVOC43)、人冠状病毒HKU1(HCoV-HKU1)、鼠冠状病毒、家蝠冠状病毒HKU5、果蝠冠状病毒HKU9、SARS 相关病毒等7 个种。γ 属冠状病毒包含禽冠状病毒和白鲸冠状病毒SW1 这2 种。δ 属包括猪δ 冠状病毒PDCoV、夜莺冠状病毒HKU11、鹅口疮冠状病毒HKU12、文鸟冠状病毒HKU13 等。其中能够感染人类的病毒主要有7 种:包括α 属的HCoV-229E 和HCoV-NL63 以 及β 属 的HCoVOC43、SARS-CoV、HCoV-HKU1、MERS-CoV 和SARS-CoV-2[4]。
1.2 结构
冠状病毒粒子形状不规则,表面分布刺突样蛋白,状如皇冠,得名冠状病毒。直径约60 ~ 220 nm。其基因组是单链、非节段的(+)RNA,长 度 大 约26 ~ 32 kb,具 有 类 似 于mRNA 的5'甲基化帽状结构和3'多聚腺苷酸尾状结构[5]。这种形态能加快病毒在宿主细胞内复制的速度。病毒表面有包膜结构,上面分布着蛋白:刺突糖蛋白(spike protein,简称S)、小包膜糖蛋白(envelope protein,简称E)和膜糖蛋白(membrane protein,简称M),少数种类还有血凝素酯酶(haemaglutinin-esterase,HE 蛋白)。其中,刺突蛋白是冠状病毒表面参与受体结合、膜融合和病毒侵入宿主细胞的重要膜蛋白,能依靠宿主细胞内的蛋白酶裂解成具有活性的亚基,与病毒的高致病性密切相关,也是宿主选择性的决定性因素之一。目前人们发现了很多冠状病毒的受体,其中SARSCoV 和人类冠状病毒HCoV-NL63 的受体是血管紧张素转换酶2(ACE2)[6];MERS-CoV 的受体是二肽基肽酶4(DPP4)[7]。
1.3 生命周期
冠状病毒的生命周期可大致分为黏附、进胞、遗传物质的释放、遗传物质的传递、病毒粒子的组装、出胞几个阶段。病毒表面S 蛋白S1 亚基上的受体结合区与宿主细胞受体结合,导致S2 启动病毒与宿主的膜融合。病毒通过内体途径或细胞表面非内体途径进入细胞,释放RNA,接着翻译出大型复制酶多聚蛋白,并且复制基因组RNA。多聚蛋白pp1a和pp1ab 需要经过PLpro 和3CLpro 这2 种酶的裂解产生能够完成病毒转录和复制的酶。新合成的基因组RNA 和结构蛋白相互作用组装成子代病毒粒子,通过胞吐出胞进行新一轮的感染[8]。
2 SARS-CoV 与血管紧张素转换酶2
ACE 是一类结构中含有锌的跨膜糖蛋白,主要参与肾素-血管紧张素系统(RAS)的调节,ACE催化Ang1(血管紧张素1)转化为Ang2(血管紧张素2),产生升压效果。ACE2 的编码基因同源于ACE 的编码基因,ACE2 位于细胞顶端,组织分布具有器官特异性,主要分布在肾、心血管、胃肠道、肺部等器官[9]。在人类肺和小肠上皮细胞中大量存在。ACE2 具有羧肽酶活性,其底物包括Ang2、缓激肽、神经降压素和运动降压素,能准确消化肽末端一个氨基酸残基,表现为扩血管作用。ACE2 可能以一种反调节的方式作用于ACE,发挥调节心脏和肾脏之间平衡的重要作用[10]。近年来研究表明,ACE2 还与体液平衡、炎症、细胞增殖等过程有关。
SARS-CoV 是β 属的冠状病毒,是引起2003 年非典型肺炎的病原体,以宿主细胞的ACE2 作为受体进入细胞,人患病后发生呼吸系统感染,临床表现为发热、头痛、四肢酸胀并伴随腹泻,主要通过呼吸道传播,具有典型的冠状病毒特征,以非节段的(+)RNA 作为遗传物质。2013 年,石正丽等[11]进一步证明了SARS-CoV 的自然宿主是中华菊头蝠。SARS 事件造成全球8 000 余人确诊,700 余人死亡,是一场全球性的公共卫生事件。
Li 等[6]首先发现ACE2 在SARS-CoV 感染中的作用。他们从SARS-CoV 感染的非洲绿猴肾细胞株中分离出ACE2,发现其可以有效地结合SARSCoV S 蛋白的S1 区域。且ACE2 的可溶性形式能够阻断S1 区域与非洲绿猴肾VetoE6 细胞的结合;转染ACE2 的293T 细胞可与表达S 蛋白的细胞形成多核合胞体;SARS-CoV 能够在ACE2 转染的293T细胞中有效地复制;抗ACE2 的抗体可阻断病毒在VetoE6 细胞中的复制。这些结果都说明了ACE2 是SARS-CoV 的功能性受体,具有介导SARS-CoV 入侵细胞和细胞融合等作用。而人类肺部有丰富的ACE2,病毒易感染病患肺部,导致肺内ACE2 蛋白数量和功能降低,进而出现一系列呼吸道及其他症状,临床可表现出肺衰竭。
3 SARS-CoV-2 研究及相关治疗药物
3.1 病毒简介
SARS-CoV-2 是2019 年12 月在人体分离出来的新型病毒株,曾于2020 年1 月12 日被世界卫生组织(WHO)暂时命名为2019-nCoV。同时,WHO 发布了针对疑似新型冠状病毒感染造成严重急性呼吸道感染的临床处置指南。SARS-CoV-2 属于冠状病毒的β 属。病毒表面分布有S、E、M、HE 蛋白。S 蛋白可与人体内ACE2 结合,使病毒能够感染宿主细胞。2020 年2 月8 日,我国将感染SARS-CoV-2 引起的疾病命名为NCP(novel coronavirus pneumonia,新型冠状病毒)。2 月11 日,WHO 总干事谭德塞在瑞士日内瓦宣布,将新型冠状病毒感染的肺炎命名为COVID-19。同日,国际病毒分类委员会冠状病毒研究小组(CSG)将新型冠状病毒正式命名为SARS-CoV-2。该病毒主要经过呼吸道飞沫、接触传播,存在气溶胶传播的可能。感染后主要表现为发热、乏力、干咳,重症者呼吸困难,发生急性呼吸窘迫综合征等。目前尚未找到有效治疗该病毒的药物或活性分子。3CL pro 和PL pro 是对病毒的成熟和复制起到关键作用的蛋白酶,有望成为治疗SARS-CoV-2 的突破口。1 月26 日,上海科技大学饶子和院士/杨海涛教授课题组测定了SARS-CoV-2 冠状病毒3CL 水解酶的高分辨率晶体结构,为抗SARS-CoV-2 的药物筛选提供了方向。
3.2 病毒相关研究
3.2.1 病毒源头探究
2020 年1 月22 日,石正丽研究小组在bioRxiv上发布了他们对提取到的SARS-CoV-2 病毒基因组的研究结果。比对基因组序列发现SARS-CoV-2 与SARS-CoV 有79.5%的相似性,而与云南菊头蝠的冠状病毒有96%的同源性。此外,研究还证实了SARS-CoV-2 和SARS-CoV 一样都是以ACE2 为受体进入宿主细胞。肺部细胞高表达ACE2 蛋白,因此SARS-CoV-2 会通过呼吸系统感染肺部,造成肺部严重损伤。
病毒感染人体通常需要中间宿主的传递才能完成必要的进化和传播。对于此次爆发的SARSCoV-2,研究者把目标锁定在野生穿山甲上。2 月18 日,管轶教授团队在bioRxiv 上发表了研究结果,他们比对了野生穿山甲组织样品中的冠状病毒和人体中的新型冠状病毒,发现二者的RBD 氨基酸序列高度相似(97.4%),高于蝙蝠冠状病毒与新型冠状病毒的相似性(89.2%)。早在2 月7 日发布会上沈永义教授团队就表示,穿山甲有可能是潜在的宿主。2 月20 日该团队研究成果在bioRxiv 上发表,结果显示穿山甲病毒株与新型冠状病毒毒株序列同源性为99%,穿山甲体内的抗体可以和新型冠状病毒的S 蛋白结合;进化树结果也将中间宿主指向穿山甲。但该结论尚不能确证,还需要后续的研究支撑。
虽然SARS-CoV-2 首次是在武汉的华南海鲜市场被发现,但将其视为疫情的发源地还为时过早。有文献报道称首例感染患者并无华南海鲜市场暴露史[12],这说明海鲜市场很有可能并不是病毒源头,而是从别处传入海鲜市场后爆发。全基因组数据解析结果也支持这种可能。总之,现有的证据还不能将SARS-CoV-2 的源头指向中国。
3.2.2 SARS-CoV-2 与血管紧张素转换酶2
冠状病毒表面的S 蛋白是介导病毒侵染宿主细胞的关键性蛋白,其结构组成具有多样性。2020年1 月21 日,中国科学院上海巴斯德研究所郝沛研究员团队[13]发表的论文表明:与SARS-CoV 相比,SARS-CoV-2 与ACE2 蛋白结合的S 蛋白中的5 个关键氨基酸有4 个发生了变化,但变化后的氨基酸,却在整体性上维持了SARS-CoV 的S-蛋白与ACE2 相互作用的原结构构象。尽管SARS-CoV-2的S 蛋白与ACE2 相互作用能力由于丢失的少数氢键有所下降,但仍然达到很强的结合自由能(-50.6 kcal · mol-1)。所以新型冠状病毒仍然能够与人类的ACE2 结合,实现和SARS-CoV 类似的致病机制。目前,人ACE2 的全长结构、新冠病毒S 蛋白的RBD 和人ACE 的22.5×10-10m 分辨率的晶体结构已经被解析,为新冠病毒的作用机制和药物研发提供了参考。
3.2.3 疾病传播
与SARS-CoV 相似,SARS-CoV-2 以呼吸道飞沫传播、接触传播为主,存在气溶胶传播的可能,其他传播方式有待确证。疾病爆发后,许多学者运用流行病学模型预测此次肺炎疫情的传播和累及人数,并得出了基本再生数(basic reproduction number,R0),R0是指无外力介入时1 名感染者在传染期内在易感人群中引起的新感染者的期望人数,用以评估传染效力,数值越大,传染性越高。综合比较后,R0值大多处于2 ~ 3,其中一篇重点考虑人口流动、采用SEIR 模型分析的文章估计R0值为2.68[14]。虽然2003 年SARS 病毒的R0值为2 ~ 5,但是由于环境、时间等其他因素影响以及R0的不确定性,并不能把二者R0直接比较,随着疾病的发展该值也会不断改变。此外,包括消化道传播在内的其他问题也存在不确定性。
2020 年2 月1 日,《新英格兰医学杂志》(NEJM)上刊载了美国首例确诊COVID-19 患者成功治愈的病例,在该患者粪便中检测到SARS-CoV-2[15]。深圳市第三人民医院肝病研究所发现该院收入的某些确诊患者粪便中SARS-CoV-2 核酸检测呈阳性,其他临床研究中也陆续出现患者粪便显示核酸阳性的案例。这些报道均提示可能存在粪口传播。而单细胞测序数据表明ACE2 在回肠和结肠的吸收性肠上皮细胞中存在高表达[16]。第七版诊疗方案中提示注意粪便及尿对环境污染造成的气溶胶或接触传播。如果存在消化道传播途径,那么人被感染的风险将会进一步增加。至此,我们虽有理由怀疑存在粪口传播,但目前并无定论。
气溶胶传播是指含病毒的飞沫在空气中悬浮的过程中失去水分,剩余的飞沫核(病毒粒子蛋白质)通过气溶胶的形式漂浮造成远距离传播。若存在气溶胶传播,将会进一步增加大众感染风险。而流行病学研究显示,大多病例可追溯出确诊病例接触史。2 月9 日,国家卫健委新公布的《关于印发新型冠状病毒肺炎诊疗方案(试行第五版修正版)》中显示,目前经呼吸道飞沫和接触传播是主要的传播途径。气溶胶和消化道等传播途径“尚待明确”。而在2 月18 日公布的第六版新型冠状病毒肺炎诊疗方案中传播途径一栏在第五版基础上有所增加,提示“在相对封闭的环境中长时间暴露于高度气溶胶情况下存在经气溶胶传播的可能”。此说法限定条件多,说明气溶胶途径传播还是具有不确定性。
3.3 治疗药物研究
3.3.1 治疗方案
面对此次病毒感染,许多学者都参考SARSCoV 和MERS-CoV 的治疗经验进行研究。目前临床主要的治疗药物是抗病毒药物,例如HIV 蛋白酶抑制剂洛匹那韦/利托那韦和广谱核苷类抗病毒药利巴韦林。在此次疫情初期的主灾区——中国主要采用雾化吸入α-干扰素配合口服洛匹那韦/利托那韦治疗,可加用利巴韦林、磷酸氯喹和阿比朵尔并结合患者临床症状给予对症治疗。泰国Rajavithi 医院的格里昂萨专家团队同样采用洛匹那韦/利托那韦并辅以抗流感病毒药物奥司他韦进行治疗,部分患者明显好转。美国首例确诊新冠肺炎患者被成功治愈的案例报道中,治疗期间院方根据病症给药:使用昂丹司琼缓解恶心呕吐症状;使用愈创甘油醚缓解咳嗽症状;使用布洛芬、扑热息痛缓解发热;根据临床症状使用了头孢克肟、万古霉素。患者住院第7 d,医院使用了未获批的试验药物瑞德西韦(remdesivir,GS-5734),隔日症状好转。瑞德西韦是针对埃博拉病毒研发的核苷酸类似物,通过影响病毒聚合酶和校对型核酸外切酶产生抗病毒作用,随后研究发现瑞德西韦对呼吸道合胞病毒、冠状病毒、尼帕病毒、亨德拉病毒也有抑制效果[17-19]。目前该药已在我国中日友好医院启动临床试验。此外,中药也在临床中得到应用。其中,在2003 年非典疫情爆发时应用的连花清瘟胶囊也被用于治疗COVID-19。2020 年2 月8 日,肺炎一号方(透解祛瘟颗粒)在我国获批临床使用。在国家卫健委发布的第六版诊疗方案中,清肺排毒汤等中药制剂都包含在内。
近日,传统抗疟药氯喹再一次进入研究视线,氯喹可通过增加病毒/细胞融合所需的内体pH 值以及干扰SARS-CoV 宿主细胞受体的糖基化来阻断病毒感染。Wang 等[20]比较了几种抗病毒药物在体外的抗病毒活性,氯喹[半数有效浓度(EC50)= 1.13 μmol · L-1]和瑞德西韦(EC50= 0.77 μmol · L-1)显示出良好的抗病毒能力。目前,使用氯喹或类似物羟氯喹治疗COVID-19 的临床试验也在进行中。法匹拉韦是具有广谱抗RNA 病毒活性的RNA 聚合酶抑制剂,针对流感病毒研发。法匹拉韦是一种前药,在细胞内转化为呋喃糖基5'-三磷酸代谢产物,通过干扰病毒聚合酶的功能阻止病毒复制。而法匹拉韦抗COVID-19 的临床试验也在进行中。
2020 年2 月4 日,李兰娟院士研究团队发现阿比朵尔和达芦那韦在体外具有抑制冠状病毒的作用,阿比朵尔是一种抗病毒药物,通过抑制流感病毒脂膜与宿主细胞的融合而阻断病毒的复制[21]。达芦那韦是一种HIV-1 蛋白酶抑制剂,能选择性抑制病毒感染细胞中HIV 编码的gag-pol 多蛋白的裂解[22]。包括达芦那韦在内的抗新型冠状病毒联合性治疗的临床试验正在进行中。
在2003 年非典时期,体外细胞试验显示甘草酸具有抗病毒活性,主要在病毒进入宿主细胞后发挥作用(EC50=300 mg · L-1)[23]。甘草酸是中药甘草中的主要活性成分,具有抗炎、保肝、改善肝功能的作用,主要用于治疗肝炎[24]。临床显示,与SARSCoV、MERS-CoV 感染相同,COVID-19 重症患者也会发生炎症风暴,造成脏器功能衰竭,重者死亡。临床常用糖皮质激素进行治疗,但其效果差,副作用大,并不是理想选择。甘草酸能发挥类激素样作用,不抑制免疫,并且无皮质激素的不良反应。武汉大学药学院丁虹教授根据疾病过程提出了甘草酸二铵联合曲克芦丁和维生素C 的治疗方案,相比于那些具有“杀伤性”的方案,丁教授的方案注重于减少机体损伤,依靠患者自身免疫系统清除病毒,许多未入院患者反映该方案效果较好,但高血压患者应慎重使用。目前甘草酸二铵的联合治疗方案已经在武汉大学中南医院开始临床试验。
恢复期血浆作为一种安全有效的治疗方法,无论在哪种传染性疾病发生时,都被寄予厚望。在此次疫情中,我国也采用了恢复期血浆进行治疗,国家卫健委公布的数据表明,最初接受了恢复期血浆的10 例病人治疗后都处在康复期。虽然血浆治疗也存在着不确定性,但在各种目标药物临床试验结束前,恢复期血浆将是我们最有利的武器。
除了应用抗病毒药物以外,对于重症患者还需要采取干预治疗改善症状,例如体外肺膜氧合(extracorporeal membrane oxygenation,ECMO)和呼吸机等手段。有重症患者应用干预治疗后情况好转。这种干预治疗,能维持患者生命,对重危病人极其重要。而死亡病理尸体解剖报告显示死者远端肺泡损伤,肺部气道存在黏液栓,黏液栓会影响呼吸机的通气效果,提示在临床过程中应先化痰、吸痰,再给予氧支持。疾病的发展过程复杂,所以在治疗时,应结合疾病进程,合理采取措施,谋求患者的最大受益[25]。
中西医结合的治疗方式也在此次疾病中发挥了重要作用。在第六版诊疗方案中描述到:本病属中医“疫”病范畴,病因为感受“疫戾”之气。很多患者在中医药的治疗下明显好转。在临床治疗过程中,中医药能改善轻症患者症状,减少重症向危重症转化,减缓疾病进程。所以,将中西医结合,能够发挥二者优势,协同改善患者症状。
目前应用于临床的各类COVID-19 治疗药物见表1。
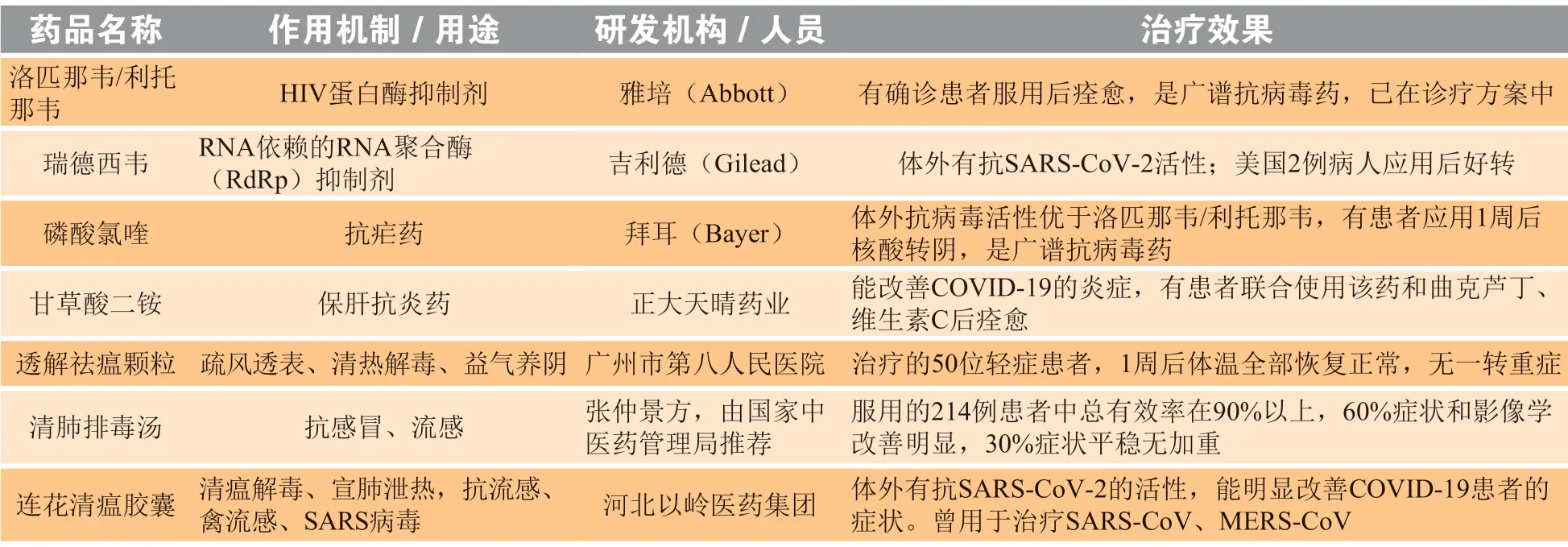
表 1 应用于临床的部分COVID-19 治疗药物Table 1 Some clinically used drugs against COVID-19
3.3.2 药物药代动力学特点
3.3.2.1 洛匹那韦/利托那韦 洛匹那韦和利托那韦的复方制剂商品名为克力芝(Kaletra),是针对HIV-1的蛋白酶抑制剂。主药洛匹那韦可通过阻止HIV 病毒复制过程中的gap-pol 多聚蛋白的裂解,导致病毒组装错误,无法产生具有传染性的成熟子代病毒粒子[26]。洛匹那韦单用生物利用度低,主要经肝脏CYP3A4 代谢。利托那韦也是HIV 蛋白酶抑制剂,低剂量的利托那韦可以通过抑制肝脏代谢,提高洛匹那韦的血药浓度[27]。该复方制剂主要经口服给药,洛匹那韦水溶性差,在体内主要聚集在外周血单核细胞(PBMC)中,多次给药后的t1/2为5 ~ 6 h,血浆蛋白结合率为98% ~ 99%。给药后约4 h 达峰浓度,主要经粪便排泄,少数随尿液排出。不良反应较少,主要为腹泻、恶心、呕吐、高甘油三酯血症和高胆固醇血症[28]。根据药代动力学特点可知,该药经胃肠道吸收,起效稍慢,蛋白结合率高,主要在血液中起效,在用于治疗COVID-19 时,应与其他药物联用增强治疗效果。此外,由于该药经肝P450 酶系代谢,肝损伤患者应慎用。
3.3.2.2 瑞德西韦 瑞德西韦是氰基取代的腺苷酸类似物前药,进入细胞内部被转换为活性代谢物GS-443902,针对埃博拉病毒研发。瑞德西韦的三磷酸形式(remdesivir-TP)能够与ATP 竞争结合,抑制RdRp 功能,使RNA 链终止延迟[29]。动物实验中,使用恒河猴作为模型,静脉给予瑞德西韦,其活性形式在PBMC 中能够持续存在(t1/2为14 h),还
能够扩散到包括睾丸、眼睛和大脑等病毒复制的部位[30]。2018 年WHO 公布的早期临床试验数据显示,静注75 mg 瑞德西韦2 h,PBMC 中活性形式的t1/2在40 h 以上。从药代动力学角度看,瑞德西韦静脉给药无吸收过程,在体内活化后能稳定长时间存在于血液中,有速效长效的优点,还有分布到组织中的特点。目前,瑞德西韦在治疗COVID-19 方面备受瞩目,但在人体中的有效性、安全性还是未知。此前研究证明瑞德西韦体外抑制SARS-CoV-2 的EC50为0.77 μmol · L-1,而对埃博拉病毒的EC50约为0.12 μmol · L-1[31],粗略比较可以看出瑞德西韦抑制SARS-CoV-2 的能力比埃博拉病毒弱,若要提高治疗效果,就要提高给药剂量,随之而来的则是用药安全问题。但由于缺乏临床试验数据,其副作用不明确。目前国内的临床试验剂量采用200 mg 的负荷剂量,100 mg 的维持剂量,给药9 d,可能会出现疗效和安全不能兼顾的问题,所以有效性及安全性问题还有待临床确证。
3.3.2.3 磷酸氯喹 磷酸氯喹是治疗疟疾和类风湿性关节炎的抗疟药和抗炎药。研究发现其还具有抗病毒活性,在2003 年就有关于氯喹抗SARS-CoV 的相关报道[32],可能通过干扰病毒基因表达和内体pH 发挥抗病毒作用[33]。氯喹口服后吸收完全,可进入红细胞,广泛分布于体内包括肝、肺、肾、脾、脑等组织中,血浆蛋白结合率为60%,氯喹可通过细胞色素P450酶迅速脱烷基,生成有药理活性的去乙基氯喹(40%)和双去乙基氯喹(10%),氯喹和去乙基氯喹在体内的浓度下降缓慢,消除的t1/2为5 ~ 60 d[34]。氯喹药代动力学性质良好,口服后在体内分布广泛,可进入肺部,且与洛匹那韦、瑞德西韦等抗病毒药物作用机制不同、药效互补,可联合用药增加疗效、减少耐药性。如果在临床试验中能被证明对COVID-19 有良好的治疗效果,磷酸氯喹也将成为抗击COVID-19 的重要武器。在第六版诊疗方案中,磷酸氯喹已然在列:每日2 次,单次500 mg 给药,疗程不超过10 d。但需要注意的是,其在体内消除慢,单剂量给药后数月还能在排泄物中检测到原型药及代谢物[33],在使用时应重视在体内蓄积产生的副作用,主要是视网膜病变[35],还应联合其他药物,尽量缩短疗程,确保用药安全性。
羟氯喹是氯喹的结构类似物,与氯喹的结构只存在一个羟基的差异。羟氯喹的作用机制与氯喹类似,但羟氯喹毒性更小,在体内吸收更快,分布更广。因此,国内有学者认为,相比于不良反应较重的磷酸氯喹,羟氯喹是治疗COVID-19 的更好选择。目前,羟氯喹治疗COVID-19 的临床试验也正在进行中。3.3.2.4 阿比朵尔 阿比朵尔是非核苷类抗病毒药物,临床主要用于治疗A、B 型流感病毒感染[36],在体外实验中对SARS-CoV 也有抑制作用[37]。可以通过影响流感病毒的血凝素(HA)构象,达到阻断病毒与宿主细胞膜融合的作用,还可以诱导人体的干扰素产生间接抗病毒作用[38]。阿比朵尔口服后能迅速分布到各组织,血浆蛋白结合率在90%左右,t1/2约为16 ~ 21 h,主要经肝脏CYP3A4 和肠道代谢、随粪便排出[39]。阿比朵尔制剂毒性较小、选择性好,是临床上常用的抗流感药物。从作用机制看,阿比朵尔主要影响病毒进入宿主细胞,与上述几种药物机制不同,可联合使用,并且可以分散到组织中。目前也被我国纳入第六版诊疗方案,应用于COVID-19 治疗。
3.3.2.5 法匹拉韦 法匹拉韦是由日本开发的抗流感病毒药物,能选择性抑制RNA 聚合酶,干扰病毒复制和转录[40],曾于2014 年被用于紧急治疗抗埃博拉出血热,效果较好[41]。该药口服吸收良好,能迅速分布于全身组织,tmax约0.5 ~ 1.0 h,血浆蛋白结合率在50%左右,在体内经醛氧化酶和黄嘌呤氧化酶代谢,随尿液排出。不良反应主要是尿酸增高、腹泻、中性粒细胞减少等[42]。法匹拉韦主要通过影响病毒复制发挥作用,机制与多种抗病毒药物相似,并没有被纳入诊疗方案中,但法匹拉韦治疗COVID-19 的临床试验也正在进行中。3.3.3 给药方案分析
目前临床上正在应用或处于临床试验中的药物的药代动力学参数如表2 所示。作为最早一批被应用于治疗COVID-19 的药物,洛匹那韦/利托那韦的血浆蛋白结合率、Cmax较高,有利于发挥药效,但其不良反应发生率较高,在使用时应注意相关副作用,缩短用药疗程。瑞德西韦目前尚未完成Ⅲ期临床试验,并无药代动力学参数指导应用,但现有数据表明其活性形式主要聚集在PBMC 中,有较长的t1/2,能发挥长效作用,临床试验确定的单次给药方式较合理。相比于其他药物,磷酸氯喹的t1/2很长,容易在体内蓄积,服用3 ~ 5 g 可致死,所以在临床给药时,要减少用量,在第七版诊疗方案中,氯喹的给药剂量较第六版有所修改:按体质量将患者划分,体质量低于50 kg 的患者用药第3 d 起给药次数由每日2 次降为每日1 次,可减少蓄积量,降低副作用发生率,也可以考虑用毒性较低的羟氯喹代替磷酸氯喹。抗流感药物阿比朵尔血浆蛋白结合率高、t1/2长,在体内代谢产生多种代谢形式的t1/2较原型药长,临床每日3 次给药,应监测相关指标,注意患者是否发生不良反应。法匹拉韦的不良反应发生率高,目前并没有纳入诊疗方案中,但存在临床使用情况,建议监测相关功能指标,避免出现严重副作用、造成不利影响。甘草酸二铵的Cmax小,在体内药代动力学过程复杂,存在肝肠循环,原型药及代谢形式的血浆蛋白结合率均高于90%,t1/2较长,但不良反应轻,安全性好,主要通过改善炎症反应发挥疗效,可与其他抗病毒药物结合使用。
对于SARS-CoV-2,目前还无特效药。现有药物的治疗效果很大程度上取决于医生的治疗经验和患者的个体差异。目前众多临床方案中,瑞德西韦是唯一完全按国际双盲试验进行的研究。合理的给药方案能够挽救患者生命,所以在临床过程中,应根据药物本身的特点制定给药方案,找到剂量和药效的平衡点,最大限度地发挥药效,避免不良反应。
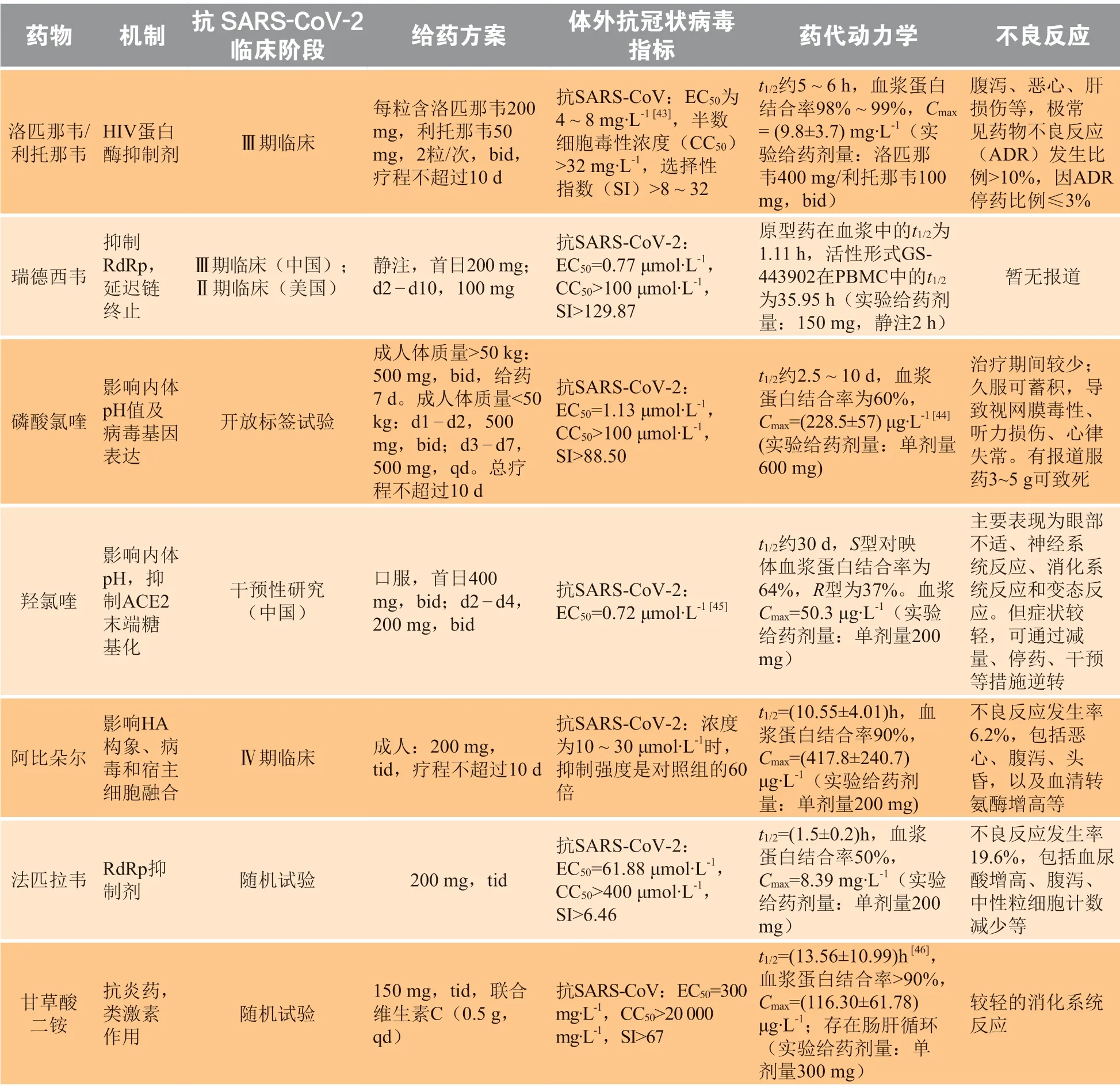
表 2 各类COVID-19 治疗药物的药代动力学信息Table 2 Pharmacokinetic information of various drugs against COVID-19
4 结语
此次COVID-19 疫情传播范围广,波及人数众多,累计死亡人数已超过SARS 疫情时的死亡人数。但与此同时,多种药物已经进入临床试验,有望成为攻克COVID-19 的有效药物。除抗艾滋病药物外,疫苗、抗体类药物也备受关注。未来一段时间,是否存在其他可能的传播途径、病毒中间宿主等问题也会被进一步确证。在这场无烟的战役中,无数勇士前仆后继,相信在各方努力下,人类定能收获经验,战胜病毒。
