2020 年1—2 月美国、欧盟和日本新批准药物概述
2020-05-10孙友松
孙友松
(上海递鸽医药科技有限公司,上海 201210)
1 2020 年1—2 月美国FDA 新批准药物
2020 年1—2 月,美国FDA 共批准16 个新药,包括4 个全球首次批准的新分子实体(avapritinib、tazemetostat、bempedoic acid、rimegepant)、1 个 全 球首次批准的新生物制品(teprotumumab-trbw)、2 个美国首次批准的新分子实体、3 个新复方、2 个新剂型和4 个新增适应证药物(见表1)。
1.1 Avapritinib
Avapritinib 是一种血小板衍生的生长因子α 受体和原癌基因蛋白c-kit 双重抑制剂,由Blueprint Medicines 公司研发,商品名为Ayvakit®。2020 年1月9 日,美国FDA 批准avapritinib 用于治疗不可切除或转移性胃肠道间质瘤[1]。
Avapritinib 此次获得美国FDA 批准基于一项Ⅰ期临床研究(NAVIGATOR 研究,NCT02508532)结果。该研究共招募43 例PDGFRA外显子18 突变的不可切除或转移性胃肠道间质瘤患者。研究结果显示,avapritinib 在受试者中显示出良好的临床疗效,客观应答率(ORR)为84%,其中在PDGFRA D842V突变的受试者中,ORR 高达89%。Blueprint Medicines 公司目前还在开展一项随机、多中心、开放式Ⅲ期临床研究(VOYAGER 研究,NCT03465722),以瑞戈非尼为对照,主要终点指标为无进展生存期(PFS)[2]。
1.2 Tazemetostat
Tazemetostat 是 一 种EZH2 酶 抑 制 剂, 由Epizyme 公司研发,商品名为Tazverik®。2020 年1月23 日,美国FDA 批准tazemetostat 用于治疗16岁及以上不适合手术切除、转移性或局部晚期上皮样肉瘤[3]。
Tazemetostat 此次获美国FDA 批准基于1 项多中心、开放性、单臂Ⅱ期临床研究(EZH-202 研究,NCT02601950)结果。该研究共招募62 例上皮样肉瘤受试者,中位年龄为34 岁。研究结果显示,tazemetostat 在全部受试者中的ORR 为15%,其中1.6%的受试者达到完全应答,13%的受试者达到部分应答,其中67%的受试者应答时间超过6 个月,研究达到临床主要终点[4]。

表1 2020 年1—2 月美国FDA 新批准药物Table 1 New drugs approved by FDA in January and February 2020
1.3 Teprotumumab-trbw
Teprotumumab-trbw 是一种胰岛素样生长因子-1受体拮抗剂,由Horizon Therapeutics 公司研发,商品名为Tepezza®。2020 年1 月21 日,美国FDA 批准teprotumumab-trbw 用于治疗甲状腺相关性眼病[5]。
Teprotumumab-trbw 此次获得美国FDA 批准基于一项多中心、双盲、安慰剂对照的Ⅱ期临床研究(NCT01868997)和一项随机、双盲、安慰剂对照的Ⅲ期临床研究(OPTIC 研究,NCT03298867)结果。2 项研究共招募171 例中重度甲状腺相关性眼病受试者,每3 周接受1 次teprotumumab-trbw治疗,共治疗8 次,持续24 周。研究结果显示,teprotumumab-trbw 治疗组82.9%的受试者眼球突出症(≥ 2 mm)有显著改善,teprotumumab-trbw 治疗组53%的完全复视受试者得以治愈,而安慰剂对照组治愈率仅25%,研究达到临床主要终点和次要终点[6]。
2 2020 年1—2 月欧盟新批准药物
2020 年1—2 月, 欧 盟 委 员 会(European Commission,EC)共批准8 个新药,包括1 个全球首次批准的新分子实体(osilodrostat)、3 个欧盟首次批准的新分子实体、2 个欧盟首次批准的新生物制品、1 个新复方和1 个新生物类似药(见表2)。
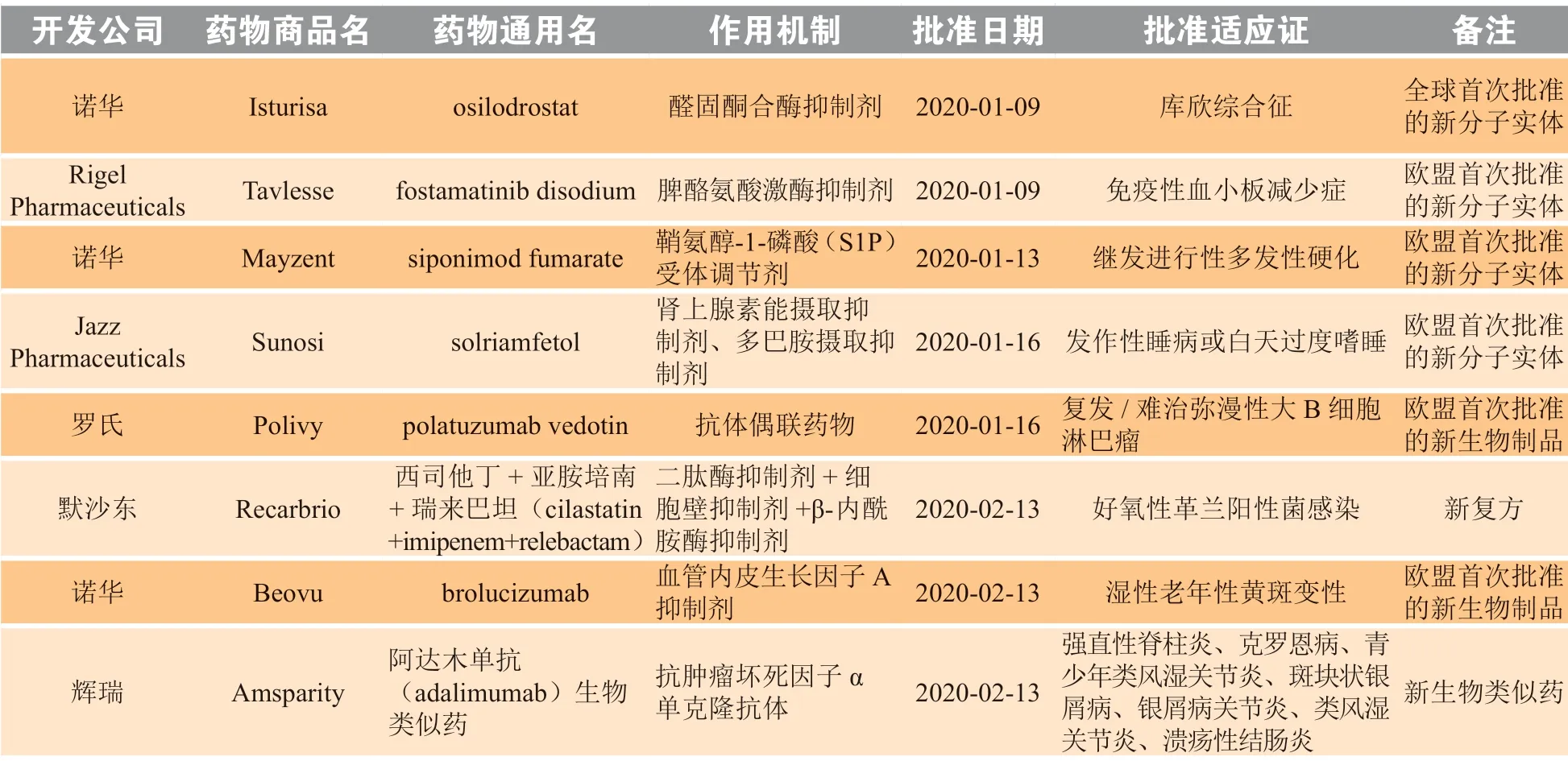
表2 2020 年1—2 月欧盟新批准药物Table 2 New drugs approved by European Commission in January and February 2020
3 2020 年1—2 月日本新批准药物
2020 年1—2 月,日本厚生劳动省(Ministry of Health, Labour and Welfare,MHLW) 共 批 准23 个新药,包括2 个全球首次批准的新分子实体(dotinurad、delgocitinib)、8 个日本首次批准的新分子实体、1 个新复方、1 个新剂型和11 个新增适应证药物(见表3)。
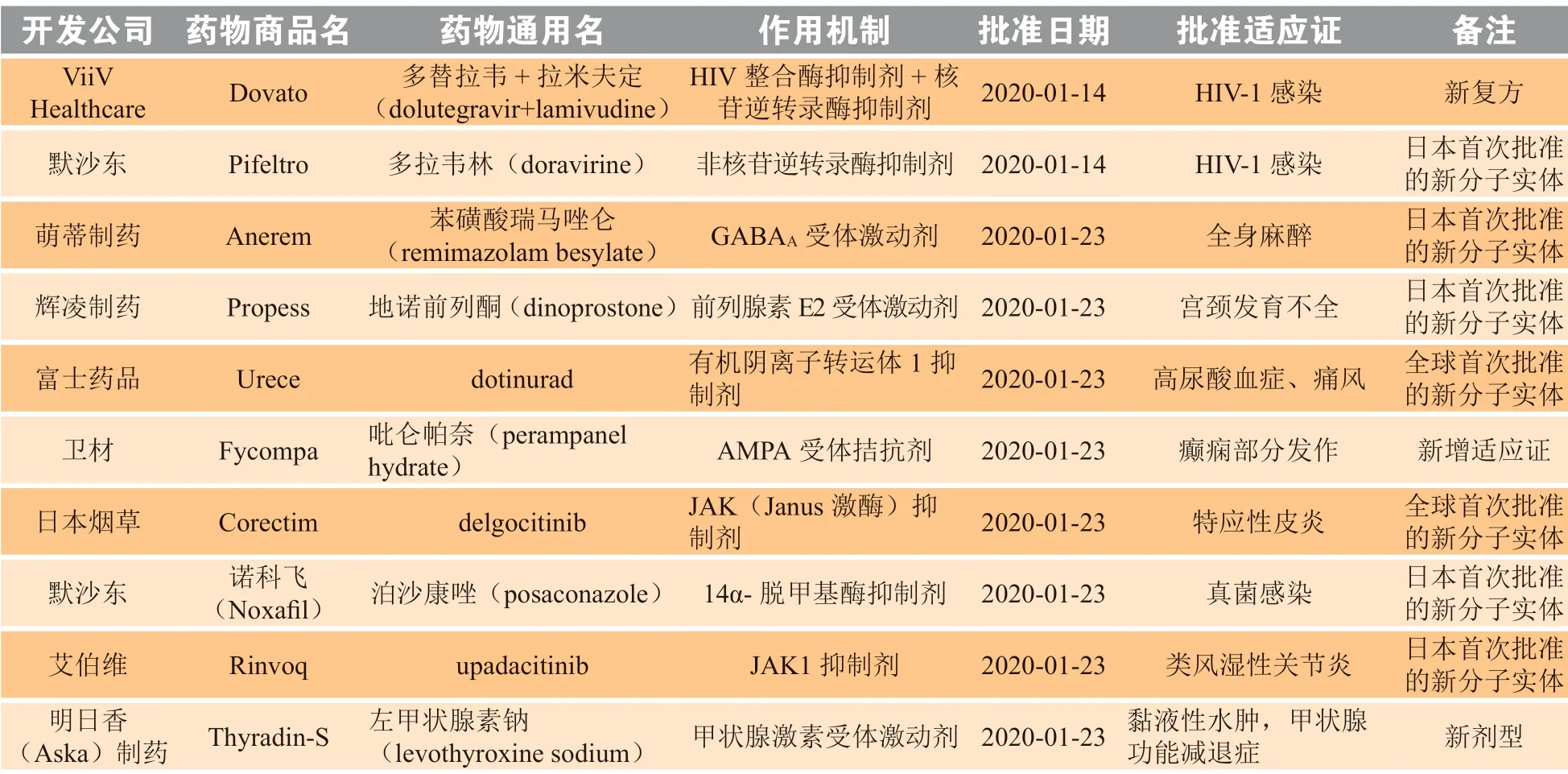
表 3 2020 年1—2 月日本新批准药物Table 3 New drugs approved in Japan in January and February 2020
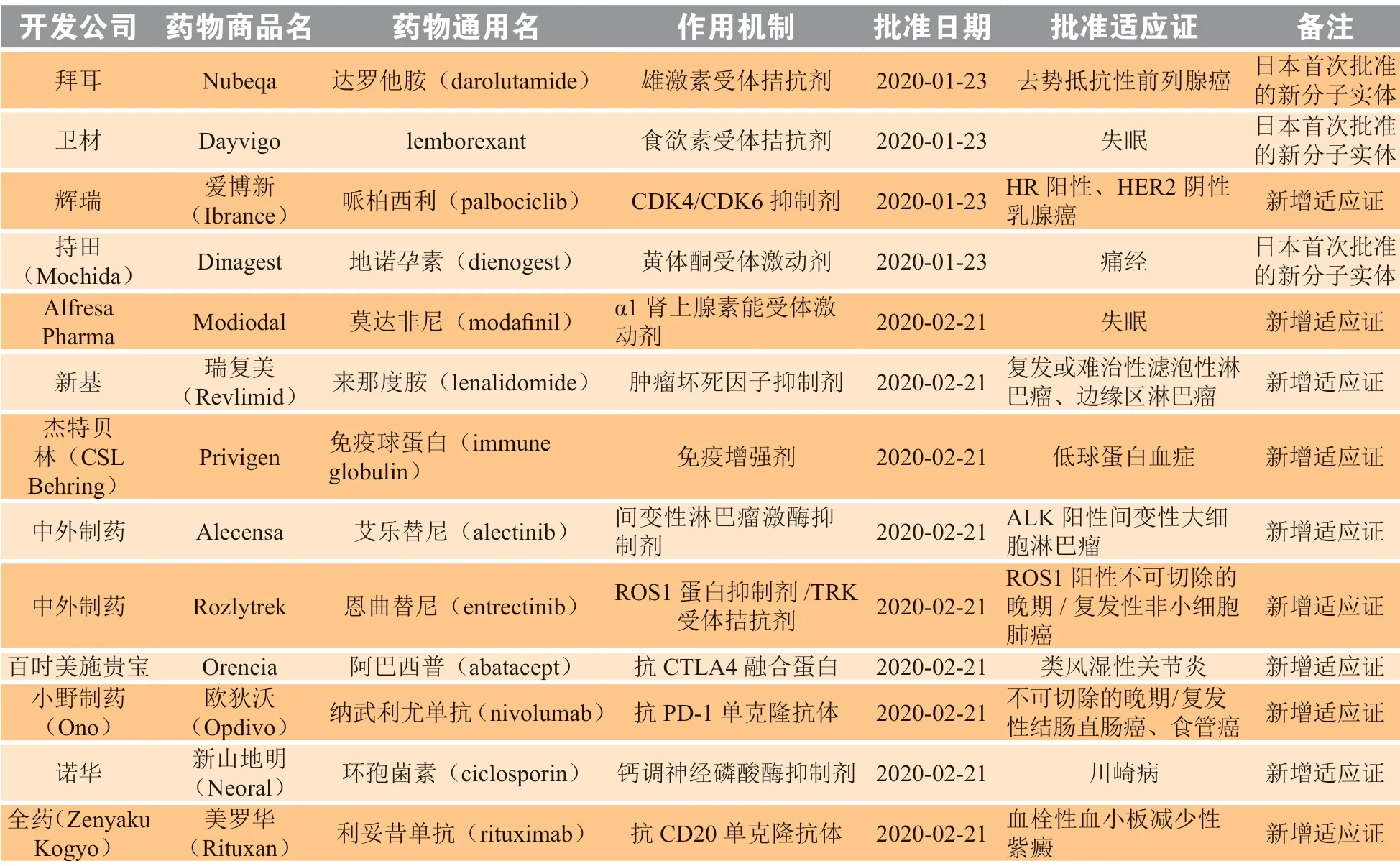
续表3
拉库沙星(lascufloxacin)是一种新型氟喹诺酮类抗生素,由日本杏林制药开发,商品名为Lasvic®。2020 年1 月20 日,日本PMDA 批准拉库沙星用于治疗社区获得性肺炎、呼吸道感染和耳鼻喉科感染[7]。
