细胞周期蛋白依赖性激酶9 及其抑制剂研究进展
2020-05-10阚少鑫卢娜
阚少鑫,卢娜
(中国药科大学基础医学与临床药学学院江苏省肿瘤发生与干预重点实验室,江苏 南京 210009)
细胞周期蛋白依赖性激酶(cyclin-dependent kinase,CDK)是一类丝氨酸/苏氨酸激酶,它们在细胞转录、细胞周期以及神经分化过程中发挥着重要的作用[1]。CDK 按照功能可以分为2 种:一种控制细胞周期,一种调节细胞转录。CDK9 和其他CDK 不同的是,它只在转录延长阶段发挥作用,不参与细胞周期的调节。CDK9 与细胞周期蛋白(分别是T1、T2 和K)形成异源二聚体,即正性转录延长因子b(positive transcription elongation factor b,P-TEFb)。P-TEFb 能够磷酸化RNA 聚合酶Ⅱ(RNA polymerase II,Pol II)的碳末端结构域上的2 位丝氨酸,激活Pol Ⅱ。
近来研究证实了CDK9 在许多病理过程中的重要性,如肿瘤、病毒复制、炎症反应及心血管疾病等。
CDK9 存在于所有的哺乳动物细胞中,其能与对应的细胞周期蛋白结合形成P-TEFb,促进转录延长。人类免疫缺陷病毒1(human immunodeficiency virus 1,HIV1)的转录主要由反式激活蛋白(transactivating protein,TAT)控制。TAT 直接与P-TEFb的亚基CycT1 结合,而P-TEFb 由CDK9 和CycT1组成。这些分子对Pol Ⅱ的碳端结构域(carbonterminal domain,CTD)的磷酸化起着重要作用。
病理性心肌肥大是心肌细胞和冠状动脉血管生长不平衡的结果。心肌细胞肥大可归因于细胞内整体RNA 含量升高所导致的蛋白质合成增加,而负责编码RNA 转录的Pol Ⅱ被认为是心肌肥大的限制因素[3]。
越来越多的研究表明,CDK9 与血液肿瘤[4]、肝癌[5]、前列腺癌[6]、成神经细胞瘤[7]等有关。因此,CDK9 被认为是治疗肿瘤的一个潜在的药物靶点。
本文综述了CDK9 的功能及CDK9 抑制剂的研究进展,旨在为CDK9 抑制剂类抗肿瘤药物的研发提供参考。
1 CDK9 的生物学功能
CDK9 最初因其特征性的氨基酸基序(Pro-Ile-Thr-Ala-Leu-Arg-Glu)被命名为PITALRE,其功能首次在人类免疫缺陷病毒的研究中得到阐明[8]。CDK9 在细胞中包括CDK942与CDK955这2 种亚型。其中,在结构上CDK955仅在N 端比CDK942多出117 个氨基酸,2 种亚型的磷酸化的方式可能相同,但是二者在细胞内分布的位置、表达的模式、调节的方式,以及在组织中的表达都有差异[9]。据报道,CDK942主要在核质中,而CDK955在核仁中。在未分化的单核细胞中,CDK942的表达水平高于CDK955,而在巨噬细胞分化时会诱导CDK955的表达[10]。在原始淋巴细胞中虽然CDK955与CDK942的基因编码相同,但二者的启动子区域不同。所以2 种亚型的差异性表达和细胞信号传导以及细胞类型有关。二者在组织中分布也有差异,CDK942主要分布在睾丸和脾,而CDK955主要分布在肝组织、脑和肺[11]。
在细胞中这2 种亚型都可以与细胞周期蛋白(分别是T1、T2 和K)形成P-TEFb 复合物。但由于CDK9 的单体不够稳定,所以在与细胞周期蛋白结合前,需要与伴侣蛋白(CDC37、HSP70 和HSP90)结合形成瞬时复合物。随后,CDK9 从这个瞬时复合物释放出来,再与细胞周期蛋白结合。CDK9 与细胞周期蛋白结合以后,CDK9T 环上的第186 位苏氨酸残基(T186)发生磷酸化,从而活化P-TEFb。活化后的P-TEFb 可以磷酸化Pol Ⅱ CTD的2 位丝氨酸(Ser2),从而使得转录的延伸阶段得以正常进行(如图1 所示)。
2 CDK9 在肿瘤中的作用机制
肿瘤被认为是一种增殖性疾病,肿瘤细胞的生存主要依赖于抗凋亡蛋白。研究表明,通过抑制CDK9 介导的转录过程,可以减少抗凋亡蛋白的表达,进而促使肿瘤细胞发生凋亡。
2.1 急性髓系白血病
CDK9 作为转录过程中的重要角色,可以调控下游Mcl-1、Bcl-2、XIAP 和Myc 等短寿命凋亡蛋白。通过抑制CDK9 的活性,能够降低这些抗凋亡蛋白的水平,从而诱导癌细胞的凋亡,尤其是在人类髓系白血病中,以急性髓系白血病(acute myeloid leukemia,AML)最为敏感。在由核型定义的AML的不同的亚型的数据库中,研究人员可以直接比较某个基因在白血病细胞和正常细胞中的表达水平。研究者通过该数据库发现,在AML 样本中CDK9的mRNA 表达水平增加,且在AML 的不同亚型之间表达也有所差异[12]。
AML 占成人急性白血病的80%,患者的主要治疗方法是联合治疗,并且在33% ~ 57%的AML病例中可见多药耐药[13],所以需要新的分子靶向疗法来更广泛地改善AML 的治疗效果和预后。在许多血液肿瘤和实体恶性肿瘤中Myc 是过表达的,它受到多个信号级联的调节,并且调节许多细胞过程(包括增殖、细胞周期进程、分化和细胞凋亡)中的转录因子。因此,Myc 的失调可能导致不受控制的细胞增殖,基因组不稳定以及逃避免疫监视[14]。尽管Myc 在白血病中具有重要作用,但是通过药理学途径直接靶向Myc 较为困难。但通过间接途径干扰Myc,可以起到抗AML 的疗效。
当前的复杂工程突发事件的研究仍处于数据融合阶段。现有研究主要关注复杂工程突发事件的信息融合问题,缺少面向应急决策需求响应的深层次整合应用。同时,多数还停留在解决某一局部决策的层面上,缺乏站在复杂工程突发事件全生命周期视角的系统性分析。在大数据环境下,建立一套以复杂工程突发事件信息需求为基,以知识融合为力,以应急决策为标的知识融合框架,进而快速响应突发事件。
CDK9 介 导Mcl-1 和Myc 的 转 录,而Mcl-1以及Myc 对肿瘤细胞的生长和存活至关重要,抑制CDK9 可导致肿瘤细胞发生凋亡。其中CDK9通路对Mcl-1 和Myc 的调节跟AML 发病机制有关。有研究表明,在R/R AML 的病例中,有一半都有Mcl-1 的表达升高,并且预后不良[15]。在小鼠模型中,Mcl-1 的高表达与AML 的发生有关,同时Mcl-1 对人AML 细胞的存活和增殖也起着关键作用[16]。研究者发现混合谱系白血病(mixed lineage leukemia,MLL)基因常与11-19 白血病蛋白(eleven-nineteen leukemia,ENL)基因、激活增强子结合蛋白4(activating enhancer binding protein 4,AF4)基因、AF9基因和AF10基因等伙伴基因形成MLL融合基因[17]。研究表明,ENL 不仅是Pol Ⅱ的延伸因子,也是延伸阶段促进转录的同源核蛋白[18],因此MLL-ENL 融合蛋白可以影响转录延伸过程。
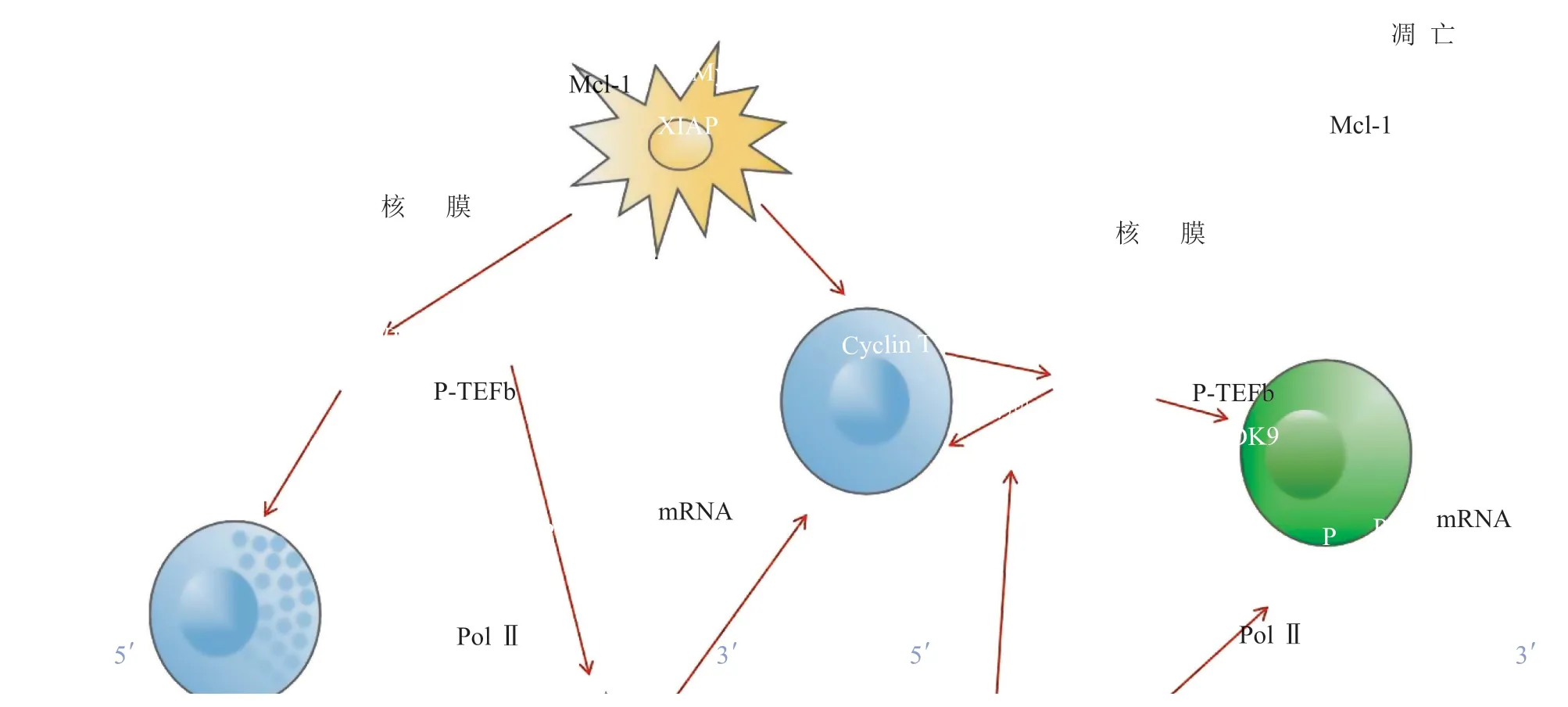
图 1 CDK9 介导的转录过程示意图Figure 1 Schematic diagram of CDK9-mediated transcription process
2.2 肝细胞癌
从全球的癌症死亡率来看, 肝细胞癌(hepatocellular carcinoma,HCC)排在第4 位。原发性肝癌类型中,最常见的是肝细胞癌,其主要的危险因素是肝硬化,常由慢性病毒性肝炎、酒精滥用和非酒精性肝病引起。在晚期HCC 的患者中,尽管使用多激酶抑制剂进行靶向治疗,也只能将预期寿命从8 个月延长到11 个月[19]。在HCC 发病的发病机制研究中,发现Myc 癌蛋白是HCC 中的驱动因素之一,Myc 的过表达可以诱导异常增殖。在小鼠肝癌模型中,抑制Myc 的表达会诱导肿瘤的退化。Myc 在DNA 复制、转录激活、转录延伸中起着重要作用,虽然具体机制尚不清楚。但是研究发现,肝癌中CDK9 介导的转录延伸对维持Myc 的高表达有着密切联系[5]。
2.3 前列腺癌
前列腺癌(prostate cancer,PCa)是男性中最常见的癌症,在疾病的初始阶段具有雄激素依赖性,并响应雄激素剥夺疗法(androgen deprivation therapy,ADT),80% ~ 90%的患者出现明显的临床消退和缓解,但2 ~ 3 年后癌症会再次复发,并发展成为去势抵抗性前列腺癌(CRPC),此阶段ADT 疗效较差。最终,癌细胞会转移到其他器官,如骨骼、肺、脑和肝脏。疾病进入到晚期阶段,患者的预后较差。雄激素受体(androgen receptor,AR)是PCa 存活和进展的关键转录因子。在一般条件下,AR 被激活并在雄激素诱导后形成同源二聚体,AR 的同源二聚体会在靶基因的启动子区域结合抗氧化反应元件(anti-oxidant response element,ARE),从而介导转录。当PCa 进展为CRPC 后通过持续激活AR 才能在雄激素的去势水平中存活。去势抵抗机制可大致分为3 个途径:雄激素依赖性、雄激素非依赖性和旁路。其中旁路途径由抗凋亡蛋白如Bcl-2 和Mcl-1 的上调介导。CDK9 可以调控抗凋亡蛋白的表达,与许多转录因子相互作用并调节它们的活性,其中包括AR。在治疗PCa 的过程中AR 是众所周知的分子靶标。CDK9 可以磷酸化AR结构域上第81 位的丝氨酸(Ser81),激活下游通路。尽管CDK1 也可以磷酸化Ser81,但其在AR 转录活性调节中的功能仍值得怀疑[20]。利用CDK9 介导的磷酸化作用调节AR 的催化特性。通过抑制CDK9 可以限制AR 的激活,并抑制疾病进展至CRPC 期[21]。研究表明,在小鼠异种移植模型研究和Ⅰ期临床试验中均发现CDK9 抑制剂具有抗肿瘤活性[22]。
3 具有抗肿瘤活性的CDK9 小分子抑制剂
近年来,通过分子模型设计的CDK9 抑制剂在体外显示出良好的抗肿瘤活性。CDK9 抑制剂按照化学结构主要可以分为:黄酮类、吡唑并嘧啶类、嘌呤类和氨基噻唑类。
3.1 黄酮类
3.1.1 夫拉平度 天然黄酮类化合物夫拉平度(flavopiridol)是第1 个进入临床试验的CDK 抑制剂。该化合物的盐酸盐形式(alvocidib hydrochloride)目前处于Ⅱ期临床研究。在2007 年,因治疗慢性淋巴细胞白血病(chronic lymphocytic leukemia,CLL)而获得欧盟孤儿药资格;2014 年,因治疗AML 而在美国获孤儿药资格;2015 年,因相同的适应证在欧盟获孤儿药资格。研究证明,夫拉平度可以通过抑制CDK9 的活性和减少Pol Ⅱ的磷酸化形式,进而促进细胞凋亡。与其他癌症相比,AML 一直缺乏有效的治疗药物,并且药物开发缓慢。在临床试验中发现当以定时序贯疗法与阿糖胞苷和米托蒽醌组合时,夫拉平度在AML 中表现出稳定的疗效。在405 例AML 患者中以定时序贯方案(夫拉平度与米托蒽醌合用,并持续输注阿糖胞苷)进行研究,发现复发和难治性AML 的完全缓解率为36%,低风险的AML 中,完全缓解率为68%[23]。
另一项临床研究显示,夫拉平度能降低Mcl-1的表达。同时在对AML 患者使用夫拉平度结合阿糖胞苷或米托蒽醌的Ⅱ期随机研究中,58%的AML患者获得了完全应答,但有8%的患者因不良反应退出研究,13%患者死亡[24]。在CLL 的Ⅰ期研究中发现,42 例患者中,有19 例获得部分应答;中位应答持续时间为12 个月。12 例17p13 染色体缺失患者中有5 例获得部分缓解,18 例11q22 染色体缺失患者中有13 例获得部分缓解[25]。在临床试验中发生了不良反应,如血小板减少症、栓塞、中性粒细胞减少症等。
3.1.2 Voruciclib hydrochloride CDK9 抑制剂voruciclib hydrochloride 是一种小分子黄酮类衍生物,由Piramal Life Sciences 研发,目前处于Ⅰ期临床研究阶段。该化合物在结构上类似于夫拉平度,但对CDK9 具有更好的选择性,可以减少非预期的脱靶介导的副作用。弥漫性大B 细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)是常见的非霍奇金淋巴瘤之一,通常对R-CHOP 方案(利妥昔单抗联合环磷酰胺、多柔吡星、长春新碱和泼尼松)有应答[26]。然而,仍有约40%的患者继续表现出对化疗耐药的DLBCL 或复发,并最终死于该疾病。Voruciclib hydrochloride 在 多 种DLBCL 模 型中可抑制Mcl-1 的表达,且与Bcl-2 特异性抑制剂venetoclax联用可诱导肿瘤细胞死亡、抑制肿瘤生长,实现协同的抗肿瘤功效,包括高风险的激活B 细胞亚型(active B cell,ABC)[27]。
3.2 吡唑并嘧啶类
3.2.1 Dinaciclib Dinaciclib 是一种小分子CDK 抑制剂,其对CDK1、CDK2、CDK5 及CDK9 均有抑制活性[28]。Dinaciclib 由默沙东公司研发,目前处于Ⅲ期临床研究,用于治疗难治愈的CLL。2011年,FDA 授予dinaciclib 治疗CLL 的孤儿药资格。在骨髓瘤治疗方面,dinaciclib 是单独使用就可发挥疗效的药物之一,而同类其他许多药物需联用。与夫拉平度比,dinaciclib 具有更高的抗骨髓瘤活
性和治疗指数,并被证明对CLL 具有良好的临床疗效[29]。一项由CLL 患者参加的临床研究显示,接受dinaciclib 治疗的52 例患者其总体应答率为54%;25 例17p13.1 染色体缺失的患者中,有19例获得应答;而21 例没有这种异常的患者中有12例获得应答。难治性患者在接受dinaciclib 治疗后并未出现常见的感染、疲劳和腹泻。尽管17p13.1染色体缺失的患者比例高达45%,但应答率仍有54%,并且中位无进展生存期接近1 年。与夫拉平度相比,dinaciclib 可以长期给药,并对大多数难治性患者有效[30]。
3.2.2 BS194 BS194 对CDK2、CDK5 及CDK9 的抑制活性的IC50 值达纳摩尔级别。药动学研究表明,本品可口服给药,且能抑制CDK 底物的磷酸化和异种移植瘤的生长,有望成为具有临床疗效的CDK抑制剂[31]。
3.3 嘌呤类
3.3.1 Seliciclib Seliciclib 是一种口服有效的CDK2、CDK7 和CDK9 抑制剂,该化合物由法国国家科学研 究 院、ManRos Therapeutics 与Cyclacel 共 同 研发,目前处于Ⅱ期临床研究阶段。Seliciclib 在鼻咽癌(nasopharyngeal carcinoma,NPC)和非小细胞肺癌(non-small-cell lung carcinoma,NSCLC)的Ⅰ期和Ⅱ期临床研究中作为单一用药显示出临床疗效。在鼻咽癌的Ⅰ期临床研究中,某些患者在治疗后出现与肿瘤细胞增殖和生存相关的基因转录下调。在Ⅰ期临床研究中,有77 例不同实体瘤患者在多次治疗方案失败后接受seliciclib 治疗。其中有10 名患者病情稳定,至少持续4 个月。同时还有2 名晚期NSCLC 患者在4 种治疗方案失败后,病情保持稳定,分别持续14 和18 个月[32]。
3.3.2 CR8 CR8 是seliciclib 的衍生物[33],其在抑制CDK9、抑制Pol Ⅱ的磷酸化和诱导凋亡方面的活性均要强于seliciclib,但是CR8 的毒性和抗肿瘤活性还需要在动物模型中进行进一步研究。
3.4 氨基噻唑类
3.4.1 SNS-032 SNS-032 是一类具有氨基噻唑类结构的化合物,可选择性抑制CDK2、CDK7 和CDK9。研究显示,其能在体外有效抑制CLL,其机制是抑制Pol Ⅱ的活性,进而减少相应RNA 的合成[34]。
3.4.2 THAL-SNS-032 THAL-SNS-032 是一种选择性CDK9 降解剂,由SNS-032 与沙利度胺拼合形成。目前传统的CDK 抑制剂是可逆的且需要连续地占据靶点,而由于ATP 结合口袋的同源性,开发高选择性的CDK 抑制剂更具有挑战性[35]。THAL-SNS-032以Cereblon 蛋白(CRBN)依赖性方式选择性诱导CDK9 降解,实现不可逆性抑制细胞转录,进而发挥更有效的抗肿瘤作用。与传统的CDK9 抑制剂相比,THAL-SNS-032 具有更稳定和持久的药效。
在实验中发现,虽然THAL-SNS-032 与另2 种传统CDK9 抑制剂NVP-2 和SNS-032 都可以迅速诱导细胞凋亡,但洗脱去除药物后,只有接受过THAL-SNS-032 处理的细胞仍处于增殖抑制状态,这可能是CDK9 被降解的结果[36]。因此,THALSNS-032 比传统的CDK9 抑制剂更具有治疗优势。这种将底物降解的策略有助于开发出活性和选择性良好的其他抑制剂(例如以组蛋白乙酰转移酶、组蛋白脱乙酰酶、脱氢酶和磷酸酶等为底物的抑制剂)。虽然降解具有更持久的药理学作用,但是传统抑制剂起效速度更具有优势,因此需要进一步研究THAL-SNS-032 的药动学和药效学特性。
4 结语与展望
CDK9 和细胞周期蛋白结合形成的复合物,对转录过程的调节至关重要,一些研究已经表明CDK9 在转录过程中起着重要调节作用。CDK9 对维持Mcl-1 等短寿命抗凋亡蛋白的表达起着重要作用,并且有一部分肿瘤细胞需要CDK9 才能存活。有研究证明,间接调节Mcl-1,可以使肿瘤对BclxL 的直接抑制剂敏感[37]。由于Mcl-1 对CDK9 功能的依赖,并且有报道证明CDK 抑制剂和Bcl-2 同源结构域3(Bcl-2 homology domain 3,BH3)拟合物之间存在着协同作用[38]。这使得以CDK9 为靶点的药物更具有研究价值。
目前为止,已经有多个CDK 小分子抑制剂处于临床研究阶段,某些抑制剂通过与传统化学疗法联用产生了较好的疗效。但是CDK 家族成员众多,它们之间的结构相似性、在不同肿瘤之间的表达差异以及CDK9 与细胞周期蛋白所组成的复合物的具体功能等基础研究尚未完全清楚,使得现有的CDK9 抑制剂存在选择性差、脱靶等问题。因此,寻找具有高特异性的CDK9 抑制剂,并探索CDK9抑制剂与其他药物联用的可能性及相关策略,有望推动CDK9 抑制剂在抗肿瘤治疗方面的进展。
