促红细胞生成素抑制大鼠创伤性脑水肿形成☆
2020-05-09唐兆华霍钢孙晓川刘自力廖正步陈飞兰王文涛郑履平杨刚
唐兆华 霍钢 孙晓川 刘自力 廖正步 陈飞兰 王文涛 郑履平 杨刚○☆
创伤性脑水肿是颅脑损伤最重要的继发性脑损害,严重的创伤性脑水肿可导致患者出现不可逆性或致死性脑损害,其分子机制的研究和临床防治一直都是神经外科领域的难题。国内外及本课题组前期研究发现促红细胞生成素(erythropoietin,EPO)在神经系统中具有减轻脑水肿的神经保护功能[1],但其分子机制尚不明确。细胞外调节蛋白激酶 (extracellular regulated protein kinases,ERK)作为EPO的下游信号通路之一,在颅脑损伤病情发展过程中具有重要作用[2]。水通道蛋白4(aquaporin 4,AQP4)是脑组织中分布最重要的跨膜水分子转运蛋白,其异常的过度表达可致脑内水电解质失衡,导致脑水肿加重[3]。本研究拟通过相关实验探讨参与EPO抑制创伤性脑水肿的潜在分子机制。
1 材料与方法
1.1 研究对象 重庆医科大学实验动物中心提供的90只健康成年雄性SD大鼠,体质量200~260 g,符合国家二级实验动物标准。SD大鼠随机分为:假手术组、创伤组和EPO组,每组30只。假手术组:只在颅骨上做一个直径约为4 mm的骨窗,不作脑创伤。创伤组:制作改进式Feeney's创伤性脑损伤模型。EPO组:成功制作Feeney's脑损伤后1 h及每隔24 h时,给大鼠腹腔注射rhEPO(5000 UI/kg)。所有动物的处理符合重庆医科大学第一附属医院伦理委员会有关规定。p-ERK1/2多克隆抗体及ERK1/2多克隆抗体购置于Cell Signaling公司,AQP4及 β-actin多克隆抗体购置于 Santa Cruz公司。
1.2 制作大鼠脑创伤模型 采用改良Feeney's硬膜外撞击法制作大鼠脑创伤模型[4]。于伤后1 d、3 d和5 d,检测各组大鼠行为学评分。创伤后72 h,检测各组大鼠脑组织含水量情况,脑组织磷酸化ERK(phosph orylated ERK,p-ERK)、AQP4 mRNA 与AQP4蛋白的表达。因不可控因素导致造模失败或大鼠死亡共6只,通过随机抽样的原则重新取大鼠造模,以补齐各组动物数目。
1.3 干湿比重法测定脑组织含水量 将各组大鼠创伤后脑组织放在铺有生理盐水浸湿滤纸的培养皿中,用电子天平(精确度:0.0001 g)称取脑组织的湿质量,然后置于85℃的恒温干燥箱24 h,质量恒定后,称得脑组织的干质量。计算脑含水量:脑组织含水量=(湿质量-干质量)×100%/湿质量。
1.4 行为学评分 采用平衡木行为学评分法[5],评估其神经功能缺损情况,得分越高表示神经功能受损越严重。具体评分标准见表1。

表1 脑出血大鼠行为学评分标准
1.5 RT-PCR法检测AQP4 mRNA表达情况 按Trizol试剂盒说明书步骤,提取样本AQP4的总RNA,逆转录为cDNA后进行PCR扩增。AQP4引物:上游 5'-CCTACAGAACCAAGGCGTAA-3',下游 5'-TCCCTGGAAATGACTGAGAA-3',扩增片段261bp;β-actin:上游 5'-ACCTCCAACACCCCAGCCATG-3',下游 5c-CTGATCCACATCTGCTGGAAGGTGG-3c,扩增片段为 691 bp,反应体系 25 μL(引物合成由上海生工公司提供)。PCR扩增条件:94℃预变性5 min;94℃变性30 s,58℃退火45 s,72℃延伸1 min,循环30次,72℃延伸10 min。PCR产物电泳,照相,以Quantity One对电泳条带吸光度(A)进行分析。AQP4/β-actin的积分A值作为AQP4 mRNA表达水平。
1.6 Western blot法检测p-ERK、ERK和AQP4蛋白表达情况 在样本中加入蛋白裂解液和PMSF,冰上裂解20 min,测定裂解液蛋白浓度,加入上样缓冲液,裂解液在沸水中变性5 min。每孔加入含40 μg蛋白样品电泳,使用PDVF膜转膜,封闭,加入一抗 (p-ERK 1/2 1∶1000,ERK 1/2 1∶1000,AQP4 1∶300)4 ℃孵育过夜,加二抗,在 37 ℃孵育 1 h,ECL显影,β-actin作为内对照参数。使用Quantity One分析荧光条带的平均光密度值(A),以p-ERK/ERK和AQP4/β-actin的积分A值分别作为p-ERK和AQP4表达水平。
1.7 统计学方法 采用 SPSS 17.0进行统计分析,计量资料均采用均数±标准差表示,p-ERK、AQP4 mRNA和蛋白表达和脑含水量检测的组间比较采用单因素方差分析,两两比较采用Turkey法;大鼠行为学评分评分以M(QL,QU)表示,采用Mann-Whitney U秩和检验。检验水准α=0.05。
2 结果
2.1 干湿重法检测大鼠脑组织含水量 假手术组大鼠脑组织含水量相对较少;与假手术组比较,创伤组脑含水量出现明显增加 (F=25.78,P<0.01);与创伤组相比,EPO组大鼠脑含水量则显著降低(P<0.01)。 见表 2。
2.2 平衡木法检测大鼠伤后神经功能障碍行为学评分 在脑损伤后24 h、72 h和120 h时,创伤组及EPO组大鼠都出现行为学评分增高。与创伤组相比,EPO组大鼠在伤后各时间点行为学评分均显著降低 (Z值分别为 -2.318、-4.326和-2.459,P均<0.05),见表 3。
2.3 Western blot法检测各组大鼠脑创伤后ERK磷酸化水平 伤后72 h时,假手术组大鼠脑组织中有少量的p-ERK蛋白表达,ERK磷酸化水平较低;与假手术组相比,创伤组大鼠脑组织中的p-ERK 水平在伤后显著上升 (F=35.88,P<0.01);与创伤组相比,EPO组大鼠脑组织中p-ERK明显降低(P<0.01)。 见图 1,表 2。
2.4 RT-PCR法检测各组大鼠脑创伤后AQP4 mRNA的表达 伤后72 h时,假手术组大鼠脑组织存在少量AQP4 mRNA表达;与假手术组相比,创伤组大鼠脑组织中AQP4 mRNA表达在创伤后显著增高(F=35.88,P<0.01);与创伤组相比,EPO组大鼠脑组织中AQP4 mRNA表达水平出现明显降低(P<0.01),见图 2 和表 2。
2.5 Western blot法检测各组大鼠脑创伤后AQP4蛋白表达 伤后72 h时,假手术组大鼠脑组织有少量AQP4蛋白表达;与假手术组相比,创伤组大鼠脑组织中AQP4蛋白表达在创伤后出现了显著增高 (F=23.48,P<0.01);EPO 组大鼠脑组织中AQP4蛋白表达水平较创伤组明显降低 (P<0.01)。 见图 3和表2。

表2 各组大鼠伤后72 h p-ERK、AQP4 mRNA和蛋白表达量及脑含水量情况
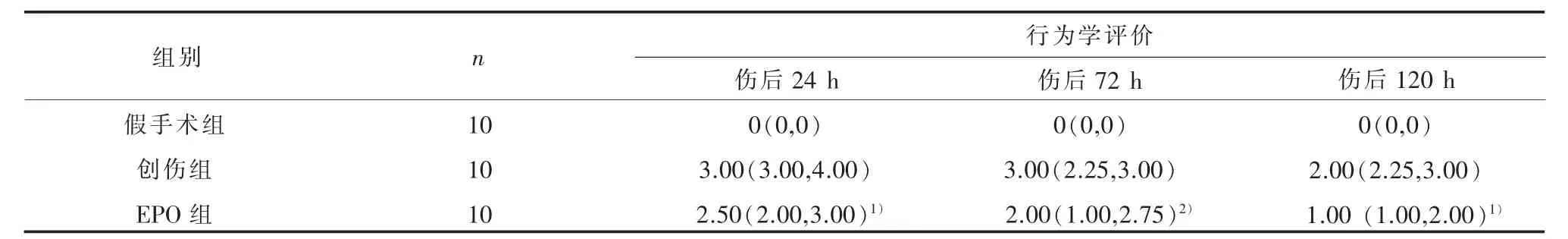
表3 平衡木法检测各组大鼠神经功能障碍的行为学评分[M(QL,QU)]
3 讨论
颅脑损伤后创伤性脑水肿是最常见的并发症,也是脑损伤治疗关键环节,其发生发展的分子机制与临床的有效防治一直未得到解决。近年研究发现 EPO及其受体不仅存在于血液系统,还广泛存在于中枢神经系统,在各种病理及生理情况下发挥了非常重要的保护功能[6]。但EPO抑制创伤性脑水肿的分子机制仍尚不明确。

图1 Western blot检测p-ERK在各组大鼠在脑创伤后72 h时的表达变化(Sham:假手术组,TBI:创伤组,EPO:EPO 组)

图2 RT-PCR法检测AQP4 mRNA在各组大鼠脑创伤后72 h时的表达水平(Sham:假手术组,TBI:创伤组,EPO:EPO 组)

图3 Western blot法检测AQP4蛋白在各组大鼠脑创伤后72 h时的表达水平(Sham:假手术组,TBI:创伤组,EPO:EPO 组)
MAPKs超家族是细胞各种生物学反应的重要信号传导通路,广泛分布于各类细胞胞浆内,主要包括3种亚家族:分别是ERK、p38和JNK[7]。ERK作为EPO下游信号通路之一,在颅脑损伤、蛛网膜下腔出血、脑卒中等疾病信号传导过程中发挥着重要作用[8]。AQP4是水通道蛋白家族 (已发现10种 )中的一种,也是存在于脑内最主要水通道蛋白,具有特异的水转运功能,是胶质细胞内外及其与血管之间水调节和转运的结构基础[3]。在脑外伤及脑卒中等损伤情况下ERK通路过度激活和AQP4过度表达与脑内水电解质失衡、脑含水量上升,脑水肿加重的病理变化密切相关[9]。在本研究中,我们发现大鼠脑创伤后脑含水量增加,出现了严重的创伤性脑水肿,大鼠神经功能明显障碍,脑组织中ERK磷酸化水平明显增加,AQP4的mRNA和蛋白表达明显上升。以上结果证实ERK通路在脑创伤后过度激活及AQP4过度高表达可能促进了创伤后脑水肿的发生发展。
在本研究后续实验中,为了研究EPO是否可通过调节脑伤后ERK信号通路活化及AQP4蛋白表达影响创伤性脑水肿,我们在大鼠脑创伤后腹腔注射rhEPO处理,结果显示ERK磷酸化水平明显降低,ERK信号通路活性被抑制,ERK信号通路活性下降可下调其下游AQP4的表达水平[10]。本研究中发现rhEPO处理后大鼠脑组织AQP4的mRNA和蛋白表达均明显降低。AQP4过度表达被抑制可控制水分子大量进入脑组织间质和胶质细胞内,使脑胶质细胞内外及其与血管之间水转运失衡得到明显改善,减少伤后脑含水量[3]。本研究发现rhEPO处理后大鼠脑组织含水量较普通外伤组大鼠确有显著降低,创伤性脑水肿缓解,大鼠神经功能障碍也得到明显改善。这表明rhEPO可阻断大鼠脑创伤后ERK信号通路过度激活,下调其下游AQP4蛋白高表达,恢复脑胶质细胞内外及其血管之间水转运平衡,保持脑组织正常含水量,缓解创伤性脑水肿,减轻大鼠继发性脑损伤。
EPO调控伤后ERK通路活化程度及AQP4的表达水平,抑制创伤性脑水肿的作用及其分子机制,为创伤性脑水肿的治疗提供了新的思路。参与EPO调节创伤性脑水肿的作用机制复杂,需要后续深入研究。
