慢性阻塞性肺疾病患者血清中IL-17和ICAM-1的表达水平及临床意义
2020-05-08
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种慢性气道炎性疾病,以持续气流受限和进行性发展为主要病变特征,与慢性炎性反应增强有关[1]。研究表明,COPD 是由于多种炎性细胞因子介导,与机体免疫系统协同作用的慢性炎性疾病,其中CD4+T 细胞是人体免疫功能的最佳体现,机体免疫系统功能紊乱可激活多种炎症细胞、趋化因子的释放,最终导致肺功能进行性下降[2]。细胞间黏附分子-1(intercellular cell adhesion molecule-1,ICAM-1)又称CD54,属于免疫球蛋白超家族中的成员,在促进炎症部位的黏连性、调节机体免疫反应中起重要作用。IL-17 由CD4+T 细胞分泌,能够诱导气道上皮细胞、内皮细胞合成分泌多种炎症介质,促进ICAM-1的表达[3]。目前关于IL-17 和ICAM-1 在COPD 不同发病阶段的研究尚少,本研究根据肺功能严重程度进行分级,分别检测各组患者CD4+和CD54+T 淋巴细胞表达情况,探讨IL-17 和ICAM-1 在COPD 发生发展中的临床意义。
1 材料与方法
1.1 一般资料随机选取2018年9月~2019年9月在我院就诊的COPD 患者120例作为研究对象,所有纳入对象均符合最新发布的GOLD 指南[4],并签署知情同意书。根据GOLD 肺功能严重程度分为A~D组,A组(轻度):男18例,女12例,平均年龄(69.6±15.2)岁;B组(中度):男16例,女14例,平均年龄(68.6±16.9)岁;C组(重度):男19例,女11例,平均年龄(71.6±17.8)岁;D组(极重度):男21例,女9例,平均年龄(74.6±19.2)岁,选择20例健康志愿者做为正常对照组。各组患者间性别、年龄等一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1 CD4+和CD54+T 淋巴细胞检测 采集各研究对象静脉血5ml,置于EDTA 抗凝管中,各样本加入BD 公司提供的CD54-FUTC、CD4-PE 荧光单克隆抗体试剂,采用FACS Calibur 型号流式细胞仪分析CD4+、CD54+T 淋巴细胞数。
1.2.2 ELISA 检测IL-17 和ICAM-1的含量 采集各组静脉血5ml,离心留取血清置于-80℃待检测。IL-17、ICAM-1 试剂盒购于上海雅吉生物科技公司,严格按照说明书操作,于波长450nm 酶标仪检测各组样本吸光度值,并通过标准曲线计算各样本IL-17、ICAM-1 浓度值。
1.3 统计学分析采用SPSS 24.0 软件分析,研究数据符合正态分布,计量资料以均数±标准差(±s)表示,计数资料用率(%)表示,组间比较采用单因素方差分析,采用ROC 曲线分析IL-17、ICAM-1用于诊断的敏感度和特异度,P<0.05 表示差异具有统计学意义。
2 结果
2.1 各组CD4+和CD54+T淋巴细胞计数比较A组、B组CD4+和CD54+T 淋巴细胞计数和对照组比较差异无统计学意义(P>0.05);C组、D组CD4+计数低于A组、对照组,组间比较差异具有统计学意义(P<0.05)。A组和对照组CD54+计数均低于C组、D组,组间比较差异具有统计学意义(P<0.05),见表1。
表1 各组CD4+和CD54+T 淋巴细胞计数比较(±s,%)
注:与对照组比较,*P<0.05;与A组比较,#P<0.05
组别 n CD4+ CD54+A组 30 48.7±10.2 13.5±3.6 B组 30 40.3±9.7 20.4±6.4 C组 30 32.6±9.1*# 29.3±6.7*#D组 30 27.1±7.6*# 36.6±8.2*#对照组 20 51.7±10.8 12.7±2.7 F 19.23 28.61 P 0.001 0.001
2.2 各组IL-17和ICAM-1检测水平比较A组IL-17和ICAM-1表达与对照组比较无明显差异,组间比较差异无统计学意义(P>0.05);B组、C组和D组的IL-17 和ICAM-1 表达均明显高于A组和对照组,组间比较差异具有统计学意义(P<0.05),见表2。
表2 各组IL-17、ICAM-1 水平(±s)
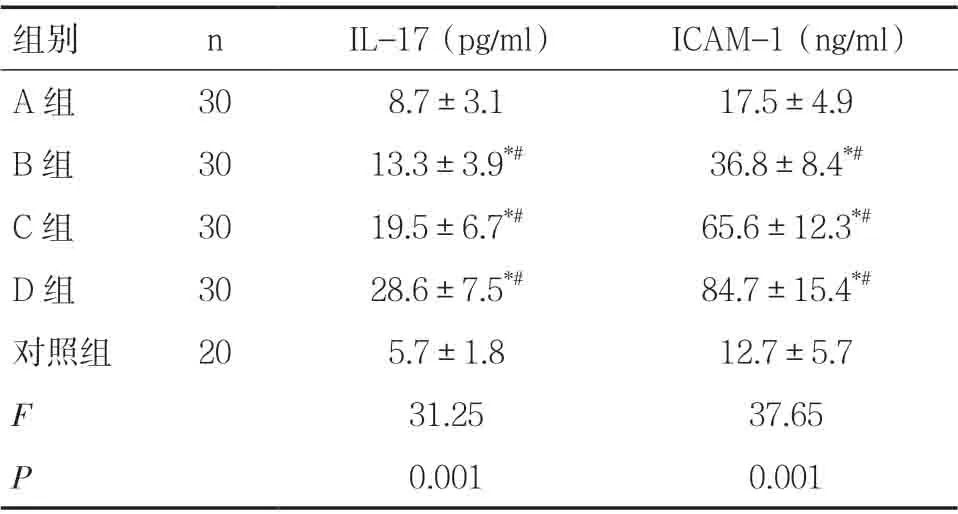
表2 各组IL-17、ICAM-1 水平(±s)
注:与对照组比较,*P<0.05;与A组比较,#P<0.05
组别 n IL-17(pg/ml) ICAM-1(ng/ml)A组 30 8.7±3.1 17.5±4.9 B组 30 13.3±3.9*# 36.8±8.4*#C组 30 19.5±6.7*# 65.6±12.3*#D组 30 28.6±7.5*# 84.7±15.4*#对照组 20 5.7±1.8 12.7±5.7 F 31.25 37.65 P 0.001 0.001
2.3 ROC曲线分析IL-17和ICAM-1应用价值IL-17、ICAM-1在COPD诊断中的ROC曲线下面积分别为0.719、0.785,二者AUC 均具有统计学意义(P<0.05),见表3、图1。

表3 IL-17 和ICAM-1 用于COPD 诊断的指标
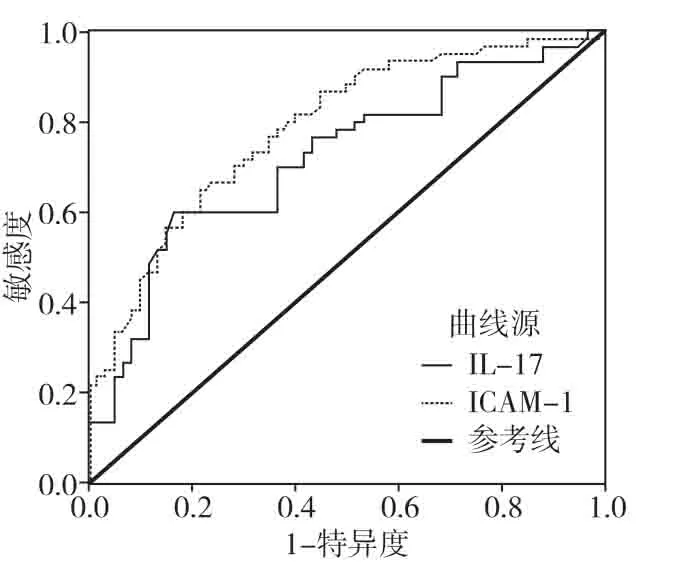
图1 IL-17 和ICAM-1的ROC 曲线
3 讨论
COPD 属于全身系统性疾病,持续存在的气道炎症可以导致小气道的重塑,气管壁痉挛,引起气流受限,加速肺功能下降,在疾病的进展过程中发挥着重要的作用[5]。目前气道炎症发病机制仍不明确,有学者认为与机体免疫反应有关,CD4+T 淋巴细胞在免疫系统中充当着重要群体角色,在不同内环境中可产生各种不同生物功能的细胞因子,参与机体细胞免疫和体液免疫应答,如Th1 表达的TNF-α、IL-2、IFN-γ 等细胞因子介导细胞免疫调控;Th2 表达IL-4、IL-13 参与体液免疫调节,促进保护性抗体产生[6]。本研究分析不同肺功能严重程度COPD 患者的CD4+T 和CD54+T 淋巴细胞表达情况,发现T 淋巴细胞与病情严重程度密切相关,尤其是肺功能明显受限的患者。
Th17 细胞作为CD4+T 细胞亚群一个重要成员,主要产生IL-6、IL-17 等细胞因子。其中IL-17 作为T 细胞活化产生的特征性促炎因子,能够诱导内皮细胞、胶质细胞、上皮细胞、成纤维细胞等细胞合成分泌多种效应分子,包括IL-6、ICAM-1、G-CSF、IL-8 等,参与机体炎症反应过程[7]。IL-17是炎症早期启动因子,可诱发机体免疫细胞炎性反应,催化疾病的进程,参与疾病的生理和病理过程[8]。IL-17 作为炎症反应过程中的诱导和趋化细胞因子,在免疫宿主防御中发挥重要作用,IL-17 通过诱导T细胞活化可上调表达进入组织ICAM-1。CD54又称ICAM-1,是CD11b/CD18的配体,分布于多种细胞表面,尤其是在淋巴细胞,本研究通过流式细胞检测发现CD54+T 淋巴细胞计数亦随着肺功能的恶化而升高,从细胞学方面反映炎症因子ICAM-1 参与气道炎性过程,它可以通过诱导扩增免疫应答IL-6、前列腺素E2的产生,最终参与炎症免疫反应的病理和生理过程[9]。相关研究表明,IL-17 与ICAM-1 存在一定相关性,miR-146a 通过靶向影响IL-17/ICAM-1 途径,参与调节多发性肌炎/皮肌炎中免疫细胞的炎性浸润,可促进免疫细胞在血液循环和外渗炎症中的反应[10]。
总之,IL-17 与ICAM-1 在气道炎症反应过程中发挥重要作用,二者在评估COPD 病情严重程度方面有一定的特异度和敏感度,联合检测IL-17、ICAM-1 水平有助于判断气道炎症程度,有可能成为COPD 诊治的新思路。
