低强度脉冲声波对大鼠骨关节炎软骨细胞凋亡的作用及机制研究
2020-05-07陈安忠耿泽振李德盛
陈安忠 耿泽振 李德盛
(1.聊城市第二人民医院,山东 聊城 252600;2.中国康复研究中心运动疗法3科,北京 100068)
骨关节炎(Osteoarthritis,OA)是一种严重危害中老年人身心健康的退行性关节疾病,其主要病理变化为关节软骨的磨损和退化。OA的临床表现为关节反复疼痛、关节功能障碍等症状[1]。关节软骨的主要功能是维持细胞外基质合成和分解代谢平衡,软骨细胞凋亡会打破细胞外基质的代谢动态平衡,进而破坏关节软骨结构和功能的完整性,最终导致OA[2]。
低强度脉冲式超声波(low-intensity pulsed ultrasound,LIPUS)作为新型物理治疗方法,具有低成本、高安全性等优点,近年来在治疗关节炎中被广泛应用。研究表明,LIPUS具有促进软骨细胞增殖、促进关节软骨的缺损修复和软骨形成等多种作用[3-4]。本实验拟从体内水平研究LIPUS对OA的保护机制。
1 材料与方法
1.1材料
1.1.1实验动物 10周龄SPF级雄性SD大鼠40只,体质量200~220 g,购于北京华阜康生物科技股份有限公司。
1.1.2主要仪器与试剂 低频声波治疗仪(HT2009-1型)购于日本伊藤公司,TNF-α、IL-1β和IL-6测试盒,购自武汉博士德生物有限公司;β-actin,Bax,Caspase-3和p53抗体购自Abcam公司,二抗购自Santa crus公司。RT-PCR相关试剂均购于Thermo Fisher公司。
1.2分组与模型建立
1.2.1分组实验 大鼠在37 ℃恒温环境,自然光线下,昼夜12 h:12 h交替饲养,适应性喂养一周,过程中对动物的处置严格遵守2006年科学技术部发布的《关于善待实验动物的指导性意见》。利用随机数字表法分为4组,每组10只:假手术组(Sham组);模型组(OA组);30 mW/cm2组;60 mW/cm2组。术前1 d剔除术区毛发。
1.2.2模型 建立本次实验构建内侧半月板撕裂(MMT)模型[5],2%戊巴比妥钠(50 mg/kg)腹腔麻醉,待大鼠肌肉松弛提示麻醉成功,将大鼠仰卧固定于手术台。术区常规消毒、铺单,取大鼠右后肢膝关节内侧纵行切口,长约2 cm,逐层切开,暴露内侧副韧带,将其切断,然后将髌韧带牵拉至一旁,镊子牵拉内侧半月板找到其与胫骨平台相连位置,尖刀半环状切断(避免尖刀损伤胫骨平台关节面),镊子提起半月板暴露其髁间止点,并将其切断,取出半月板,予以止血,大量生理盐水冲洗关节腔后,逐层缝合,碘伏消毒。术后预防性应用青霉素3 d。Sham组切开关节腔但不切除内侧半月板,其余操作相同。LIPUS治疗4周后处死大鼠并取右后肢膝关节胫骨平台,一部分迅速置于-80 ℃冰箱中保存,另一部分固定液经固定后,常规石蜡包埋。
1.2.3LIPUS干预方法 MMT术后3 d起,对大鼠右膝关节处施加超声刺激,将超声发生器头固定于膝关节内侧,超声耦合剂充分结合,30 mW/cm2组及60 mW/cm2组治疗强度分别为30 mW/cm2、60 mW/cm2,其余参数为FREE模式,通断比20%,频率3 MHz,20 min/次,1次/d,共4周。
1.3检测方法
1.3.1番红固绿染色10%EDTA处理固定后标本3周进行脱钙,常规酒精脱水、浸蜡、石蜡包埋和切片(厚度4μm),常规番红固绿染色。
1.3.2TUNEL染色石蜡组织切片经脱蜡水化处理后,修复抗原37 ℃与Proteinase K作用,封闭非特异性反应加上胎牛血清和小牛血清白蛋白,用PBS漂洗,加入TUNEL缓冲液,PBS漂洗,给予3%甲醇溶液阻断内源性过氧化物酶,PBS漂洗,再次封闭非特异性抗原加羊血清,PBS漂洗,加1∶2稀释的POD,PBS漂洗,DAB显色,苏木精衬染,通过光学显微镜观察,细胞核黄染为阳性着色。
1.3.3生化检查IL-1β、IL-6、TNF-α检测。各项指标检测方法严格按试剂盒说明书操作。
1.3.4RT-PCR检测Bax、Caspase-3、p53表达水平:RNA提取试剂盒提取组织总RNA,各组取等量RNA进行反转录,通过PCR扩增Bax、Caspase-3及内参β-actin的cDNA。每个检测点设3个平行反应管,以cDNA为模板对Bax、Caspase-3基因进行定量PCR扩增。引物序列如下:Bax,正义5’-GGTTGCCCTCTTGTACTTGC-3’,反义5’-TCTTCCAGATGGTGAGCGAG-3’;Caspase-3,正义5’-ATGGAGAACAACAAAACCTCAGT -3’,反义5’-TTGCTCCCATGTATGGTCTTTAC -3’;p53,正义5’-TTGCCGTCCCAAGCAATGGATGA-3’,反义5’-TCTGGGAAGGGACAGAAGATGAC-3’;β-actin,正义5’-CCCGCCGCCAGCTCACCATGG -3’,反义5’-AAGGTCTCAAACATGATCTGGGTC -3’。根据各反应管的靶基因循环阈值(Ct)和内参基因Ct值,采用比较Ct值法(2-ΔΔCt)计算Bax、Caspase-3、p53水平。
1.3.5免疫组化检测 Bax、Caspase-3表达水平石蜡切片常规脱蜡至水,抗原修复,血清封闭,滴加一抗,4℃冰箱过夜,滴加二抗,二氨基联苯胺(DAB)显色,苏木素复染,脱水,透明,封片。阳性判定标准:以被染成棕褐色为阳性结果。
1.3.6Western blot法检测 p53蛋白表达组织蛋白的提取:将标本储存于-80℃低温冰箱中,提取蛋白时取出标本称重,每100 mg组织加入1 mL RIPA,加入10 μL PMSF,组织匀浆,低温离心15 min,10 000~14 000 r/min,取上清加入5×蛋白上样buffer,煮沸5 min分装,-70 ℃保存,现用现取。提取蛋白后灌胶上样,加样后先用恒流(10mA),再用恒压(100V)电泳至溴酚蓝到凝胶底部。待电泳停止后,将凝胶转移PVDF膜上,转移电压为100 V,时间120 min。然后将PVDF膜移至含有封闭液的平皿中,室温下摇床上摇动封闭2h。取出PVDF膜,加入稀释后的一抗(1∶1 000)冰箱里4 ℃过夜。再用TBST室温下脱色摇床上洗3次,每次10 min。然后加入1∶1 000稀释的辣根酶标记羊抗兔IgG抗体室温孵育1 h,用TBST室温下脱色摇床上洗5次,每次10 min。将显色剂滴加于晾干的PVDF膜上,显色照相。最后用quantity one软件对条带进行分析。

2 结 果
2.1LIPUS对IL-1β、IL-6、TNF-α的影响 与Sham组比较,OA组TNF-α、IL-1β和IL-6含量均增高,差异有统计学意义(P<0.05)。与OA组比较,LIPUS组(30mW/cm2组和60mW/cm2组)TNF-α、IL-1β和IL-6含量降低,差异有统计学意义(P<0.05)。与30mW/cm2组比较,60mW/cm2组中TNF-α、IL-1β和IL-6含量降低,差异有统计学意义(P<0.05)。见表1。

表1 大鼠软骨组织中TNF-α、IL-1β和IL-6的比较
注:与Sham组比较aP<0.05;与OA组比较bP<0.05;与30 mW/cm2组比较cP<0.05。
2.2各组大鼠关节软骨结构的比较 番红固绿染色结果:Sham组大鼠关节面光滑,细胞排列整齐有序,未见细胞基质溶解;OA组大鼠关节面溃疡形成,软骨面严重剥脱,表浅软骨细胞严重缺失;30 mW/cm2组大鼠关节面较深裂隙形成,可见溃疡或少量软骨面剥脱,表浅软骨细胞部分缺失;60 mW/cm2组大鼠软骨细胞排列略紊乱,无明显关节面溃疡形成,软骨面轻微剥脱,表浅软骨细胞轻微缺失。见图1。

图1 各组大鼠关节软骨结构比较
2.3各组大鼠关节软骨凋亡细胞数比较 TUNEL法镜下显示Sham组可见极少量软骨细胞凋亡,散布在软骨表层;OA组可见大量阳性的凋亡细胞,呈片状分布;30 mW/cm2组可见的凋亡细胞数量明显少于OA组,但多于Sham组,不均匀分布于软骨组织中;60 mW/cm2组与Sham组比较,凋亡细胞数量增加,与OA组比较凋亡细胞数量明显减少,与30 mW/cm2组比较,凋亡细胞数量明显减少,部分凋亡细胞核破裂,核仁染成棕黄色。见图2。

图2 各组大鼠TUNEL结果比较
2.4RT-PCR及免疫组化检测 Bax、Caspase-3表达水平与Sham组比较,OA组大鼠的Bax、Caspase-3表达增高;与OA组比较,30 mW/cm2组和60 mW/cm2组大鼠的Bax、Caspase-3表达降低;与30 mW/cm2组比较,60 mW/cm2组大鼠Bax、Caspase-3表达降低。见图3。
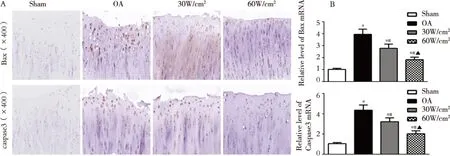
注:与Sham组比较*P<0.05;与OA组比较#P<0.05;与30mW/cm2组比较▲P<0.05。图3 Bax、Caspase-3表达情况
2.5各组大鼠关节软骨中p53蛋白表达测定 Western blot法蛋白含量检测显示,与Sham组比较,OA组p53蛋白表达均显著升高(P<0.05);与OA组比较,LIPUS组(30 mW/cm2组和60 mW/cm2组)p53蛋白表达降低(P<0.05),差异有统计学意义(P<0.05);与30 mW/cm2组比较,60 mW/cm2组中p53蛋白表达降低,差异有统计学意义(P<0.05)。见图4。

图4 各组大鼠关节软骨中p53表达比较
3 讨 论
骨关节炎主要病理特征是关节软骨退化和软骨细胞外基质破坏[6],软骨细胞外基质主要由软骨细胞分泌[7]。研究[8]表明,OA中软骨细胞丢失率高达20%,这表明软骨细胞在维持细胞外代谢机制中起着重要作用,其凋亡会导致关节软骨退化。LIPUS能通过增强软骨周围基质黏附,激活细胞骨架形成,促进软骨细胞增殖[9]。软骨组织中一些敏感性较高的酶,如胶原酶,能对LIPUS的热效应做出反应,促进软骨细胞代谢,抑制软骨细胞凋亡[10]。此外,LIPUS能够促进血液与关节滑液之间的小分子物质交换,改善关节软骨营养[11]。
IL-1β、IL-6和TNF-α是体内重要的细胞因子。研究表明,细胞凋亡是由同源的IL-1β转化酶蛋白酶家族激活引起的。一方面,它将新合成的IL-1β前体转化为活性的IL-1β[12];另一方面,它导致维持细胞结构和功能的基质蛋白分解,通过激活家族其他成员介导细胞凋亡[13]。IL-6影响多种细胞的生长、分化和基因表达。其表达异常与细胞凋亡密切相关[14]。TNF-α具有很强的促凋亡作用[15]。本研究发现,与Sham组比较,OA组大鼠软骨组织中IL-1β、IL-6和TNF-α显著升高;与OA组比较,30 mW/cm2及60 mW/cm2组大鼠软骨组织中IL-1β、IL-6和TNF-α显著降低;与30 mW/cm2组比较,60 mW/cm2组大鼠软骨组织中IL-1β、IL-6和TNF-α亦明显降低,表明LIPUS干预后,可减少软骨组织中促凋亡细胞因子,且60 mW/cm2效果优于30 mW/cm2。番红固绿及TUNEL染色结果表明,与OA组相比,30 mW/cm2及60 mW/cm2组关节软骨损伤程度明显减轻,细胞基质溶解及软骨面剥脱程度减轻,软骨细胞缺失减少,60 mW/cm2组较30 mW/cm2组损伤程度更轻。由此可见,LIPUS能通过抑制促凋亡细胞因子,减轻软骨细胞损伤及凋亡。
Bax是Bcl-2家族促凋亡的成员之一,Bax表达上调促进细胞凋亡[16]。另外,Caspase-3是一种定位于细胞质的非活性酶原,其能汇聚多种凋亡刺激信号。Caspase-3激活会导致细胞固缩、染色质凝聚和DNA断裂,进而细胞发生不可逆转的凋亡[17]。RT-PCR及免疫组化结果可见,与Sham组比较,OA组大鼠的Bax、Caspase-3表达增高;与OA组比较,30 mW/cm2组及60 mW/cm2组大鼠软骨组织中Bax、Caspase-3表达降低;与30 mW/cm2组比较,60 mW/cm2组大鼠的Bax、Caspase-3表达更低。这提示LIPUS可通过调控凋亡基因表达,从而减轻OA中关节软骨细胞凋亡。
细胞凋亡是一种基于遗传机制的细胞死亡形式,其诱导了一系列重要的病理生理变化[18]。p53是公认的凋亡基因,在细胞凋亡中起着重要作用。p53调控细胞凋亡的作用机制主要为两方面:抑制细胞增殖及诱导细胞凋亡[19]。RT-PCR及western-blot结果可见,与Sham组比较,OA组大鼠的p53表达增高;与OA组比较,30 mW/cm2及60 mW/cm2组大鼠软骨组织中p53表达降低;与30 mW/cm2组比较,60 mW/cm2组大鼠的p53表达更低。这提示LIPUS可通过调节凋亡相关信号转导,减轻OA中关节软骨细胞凋亡。
综上所述,本实验从体内水平研究LIPUS对OA的保护机制,发现LIPUS可通过抑制促凋亡细胞因子、调控凋亡基因表达及相关信号转导等机制减轻OA中软骨细胞凋亡,这为临床使用LIPUS治疗OA提供新的实验依据。
