TGF-β1/Smad2信号通路参与海水淹溺肺损伤引起的细胞凋亡
2020-05-07金发光
段 锐 金发光
溺水是意外死亡常见的原因之一,世界卫生组织(WHO)估计,在世界范围内,每年因溺水而死亡的人数高达4.5万,目前仍然是一项重要的医学和社会问题[1]。在溺水期间,气道被堵塞且呼吸被抑制,缺氧是溺水后最主要的生理异常现象,由于呼吸暂停,溺水受害者最初表现为低氧血症,但随着时间的推移,会导致急性肺损伤(acute lung injury, ALI)或急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)[2-4]。而具有高渗透压的海水,可直接通过肺泡上皮引起严重的ALI或ARDS,并引起肺组织细胞发生凋亡[5],但海水淹溺肺损伤(seawater induced acute lung injury, SWD-ALI)引起肺组织细胞凋亡的机制尚不清楚,有待深入挖掘。转化生长因子-β1(TGF-β1)在多种生命活动中扮演重要角色,而Smad蛋白是TGF-β超家族的直接底物,Smad2可被TGF-β1直接激活,TGF-β1/Smad2信号通路与多种原因引起的肺损伤有关[6-7],且参与调控细胞凋亡的过程[8-9],但在SWD-ALI引发细胞凋亡中的作用尚未见报道。于是本研究在细胞水平上初步探讨TGF-β1/Smad2信号通路是否参与SWD-ALI引发的细胞凋亡过程。
材料与方法
一、药物与试剂
TRIpure、Super M-MLV反转录酶、RNase inhibitor、2×Power Taq PCR MasterMix购自北京BioTeke公司;SYBR Green购自北京Solarbio公司;全蛋白提取试剂盒、BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶快速制备试剂盒、Western洗涤液、SDS-PAGE电泳液(干粉)、SDS-PAGE蛋白上样缓冲液、ECL发光液购自中国wanleibio公司;PVDF膜购自美国Millipore;TGF-β1、p-Smad2、Smad2、Cleaved Caspase-3抗体购自中国wanleibio公司;Hoechst染色试剂盒购自中国Beyotime公司;细胞凋亡检测试剂盒、MTT试剂购自中国wanleibio公司。
海水的制备:根据中国国家海洋局第三海洋研究所,海洋生化研究室提供的我国东南沿海海水主要成分配制,pH 8.2,比重1.05,NaCl 26.518 g/L,MgSO43.305 g/L,MgCl22.447 g/L,CaCl21.141 g/L,KCl 0.725 g/L,NaHCO30.202 g/L;SB431542购自中国阿拉丁公司:称取3.8 mg的SB431542溶于1 ml的DMSO中,配制成浓度为10 mM的母液,备用。
二、动物与细胞株
1. 实验材料: A549人肺癌细胞系(由本实验室保存)。
2. 实验仪器: 超纯水系统(香港Heal Force公司);-70 ℃超低温冰箱(安徽中科美菱公司);超净工作台(苏州净化公司);CO2培养箱(上海力申公司);酶标仪(美国BIOTEK公司);荧光定量PCR仪(韩国BIONEER公司);紫外分光光度计(美国Thermo公司);双垂直蛋白电泳仪(北京六一公司);超速冷冻离心机(湖南湘仪公司);流式细胞仪(美国BD公司)。
三、实验方法
1. 细胞培养与药物处理: A549细胞用含10%胎牛血清的F-12K培养基于37 ℃、5% CO2条件下进行培养。取对数期细胞接种于细胞培养板中,于37 ℃、5% CO2、饱和湿度条件下培养24 h后,分成3组,即对照组、海水组和抑制剂组,其中对照组细胞正常培养,海水组细胞用浓度为40%的海水处理4 h,抑制剂组细胞用浓度为10 μm的SB431542预处理2 h后,加入浓度为40%的海水处理4 h,处理完毕后,收集细胞进行后续检测。
2. MTT检测细胞活力: 取对数期细胞接种于96孔板中,每孔4×103个细胞,设置5个复孔,待细胞贴壁后,分别加入浓度为20%、40%、60%的海水,于37 ℃、5% CO2、饱和湿度条件下处理4 h。弃去各组细胞的培养基,更换成浓度为0.5 mg/ml MTT混合液,于37 ℃、5% CO2条件下孵育4 h,弃上清后,加入150 μl DMSO避光静置10 min,溶解细胞内形成的紫色结晶,然后在酶标仪上测定其在570 nm处的OD值。
3. 细胞凋亡的检测: ①流式细胞术检测细胞凋亡情况:将细胞按1×105的细胞量接种于6孔板中,于37 ℃、5% CO2、饱和湿度条件下培养24 h后,按照细胞加药方式处理后,收集各组细胞,1 000 g离心5 min,弃上清,加入195 μl Annexin V-FITC结合液轻轻重悬细胞,加入5 μl Annexin V-FITC混匀后,加入10 μl Propidium Iodide混匀,于室温避光孵育15 min,随即应用流式细胞仪进行检测; ②Hoechst染色观察细胞凋亡情况:将细胞按4×104的细胞量接种于12孔板中,于37 ℃、5% CO2、饱和湿度条件下培养24 h后,按照细胞加药方式处理后,弃去上清,PBS洗涤2遍后,加入0.5 ml固定液,室温固定15 min,弃固定液,PBS洗涤2遍后,均匀滴加0.5 ml Hoechst染色液,染色5 min,弃染色液,PBS洗涤2遍后,封片,于荧光显微镜(400×)下进行观察拍照。
4. Real-time PCR: 收集按照细胞加药方式处理后的细胞,采用TRIpure法提取细胞中总RNA,使用紫外分光光度计测量RNA的浓度后,将其反转录为cDNA,作为模板,备用。取1 μl cDNA模板,加入待测基因上下游引物各0.5 μl、SYBR GREEN mastermix 10 μl和ddH2O 8 μl,于荧光定量仪进行定量分析(反应条件为94 ℃ 5 min、94 ℃ 10 s、60 ℃ 20 s、72 ℃ 30 s,4 ℃保存)。
5. Western blot: 收集按照细胞加药方式处理后的细胞,采用全蛋白提取试剂盒提取细胞中的总蛋白,用BCA法测量其浓度后,行SDS-PAGE,转膜、封闭后。滴加一抗(TGF-β1 1︰500、Smad2 1︰500、p-Smad2 1︰400、Cleaved Caspase-3 1︰1 000),于4 ℃条件下过夜孵育,滴加二抗(羊抗兔IgG-HRP 1︰5 000),于37 ℃条件下孵育45 min(注:如是普通抗体,封闭液、一抗、二抗的孵育液为5%脱脂奶粉,如是磷酸化抗体,则封闭液、一抗、二抗的孵育液为1% BSA溶液),再进行ECL底物发光,然后用凝胶图像处理系统分析目标条带的光密度值。
结 果
一、不同浓度的海水对A549细胞活力的影响
分别用浓度为20%、40%、60%的海水处理A549细胞4 h后,采用MTT法对细胞活力进行检测,结果如图1所示,随着海水浓度的增加,A549细胞的活力逐渐下降,其中浓度为20%海水并未引起细胞活力显著性下降,当浓度大于40%时,细胞活力开始明显下降,且具有统计学意义(P<0.001)。本结果中选用浓度为40%的海水进行后续实验。
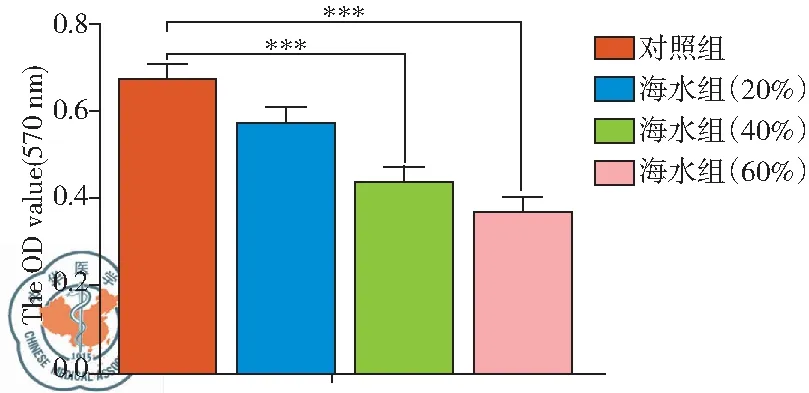
图1 MTT法检测细胞活力结果
二、海水引起A549细胞发生凋亡
当用浓度为40%的海水处理A549细胞时,细胞凋亡相关蛋白Cleaved Caspase-3的表达水平显著上调,且具有统计学意义(如图4B所示,P<0.001);采用Hoechst染色观察凋亡情况,结果如图2A、2B所示,海水处理后,A549细胞核呈现出致密浓染,颜色发白,提示细胞发生凋亡现象;同时我们还采用了流式细胞术对细胞凋亡情况进行检测,对照组细胞的早期凋亡率为0.068,晚期凋亡率为0.006,而海水处理后,细胞的早期凋亡率变为0.064,晚期凋亡率变为0.220,总凋亡率显著上升,且具有统计学意义(P<0.001)。以上结果提示SWD-ALI可引起细胞发生凋亡。

图2 Hoechst染色观察细胞凋亡结果(400×)
三、TGF-β1/Smad2信号通路参与海水淹溺肺损伤细胞凋亡过程
用海水处理A549细胞后,TGF-β1 mRNA与蛋白表达水平显著上调,且用TGF-β1受体抑制SB431542处理后,TGF-β1的表达显著下调(如图3A、3B所示,P<0.001),而Smad2 mRNA与蛋白表达水平无显著性变化,但海水处理后,Smad2磷酸化蛋白的表达水平显著上调,且抑制剂处理后明显被恢复(如图3B所示)。另外发现海水使A549细胞发生显著性凋亡,但用抑制剂处理后,由海水引起的凋亡现象被显著缓解,且具有统计学意义(如图2所示,P<0.001),同时抑制剂组细胞中凋亡相关蛋白的表达水平也显著降低,趋于对照组,且具有统计学意义(如图3B所示,P<0.001)。以上结果提示SWD-ALI可通过激活TGF-β1/Smad2信号通路,促使细胞凋亡。
讨 论
在意外死亡原因的排行榜上,溺水位列第二,主要发生在儿童和青少年群体中[10-11],溺水后果的严重与否主要依赖于吸入水的成分与数量[12],具有渗透压的海水吸入是引起ALI的重要原因之一,其主要症状为肺水肿和严重的难治性低氧血症[13-14]。探究其症状的机理是开发新的治疗药物的关键。

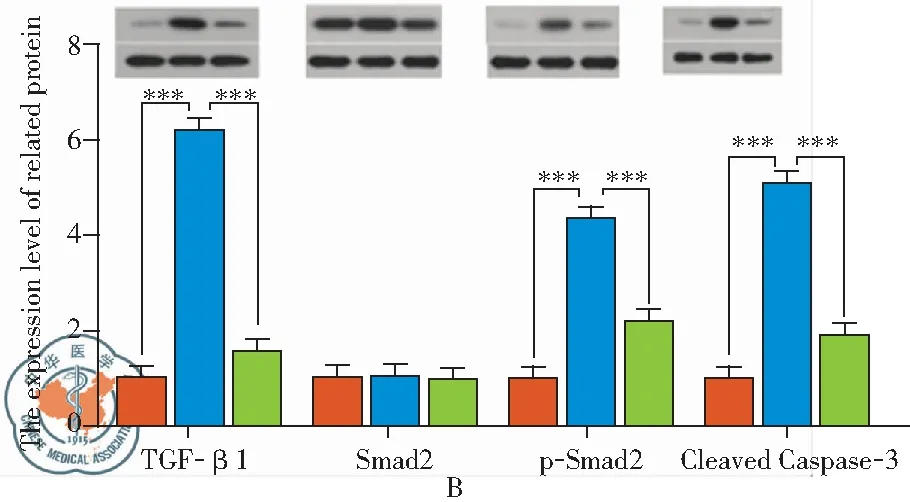
图3 TGF-β1/Smad2信号通路相关指标mRNA与蛋白表达水平;注:A:Real-time PCR检测相关指标mRNA表达水平;B:Western blot检测相关指标蛋白表达水平
凋亡是细胞为了维持内环境的稳定而由基因调控的程序性死亡,此过程是一个主动过程,它涉及一系列基因表达与调控的过程,是细胞的一种保护性措施。目前已知多种原因引起的肺损伤均会引起细胞发生凋亡[15-16],Han等[5]用海水建立SWD-ALI大鼠模型及细胞模型,发现海水可激活凋亡相关蛋白Caspase-8与Caspase-3;Li等[17]采用TUNEL法观察SWD-ALI大鼠模型肺组织时,发现肺组织细胞发生凋亡,且Caspase-3的表达水平上调;在本研究中,我们用海水处理A549细胞后,通过流式细胞术检测发现,海水使细胞凋亡率显著增加;Hoechst染色观察发现海水使细胞核呈现出致密浓染,颜色发白,且数量增多;Western blot对凋亡相关蛋白cleaved Caspase-3蛋白表达水平进行检测,发现海水使该指标表达水平显著上调,以上实验结果提示海水可引起细胞发生凋亡,并与前人的报道相符合。由此可见,海水淹溺肺损伤(SWD-ALI)引起细胞发生凋亡的现象比较常见,不可忽略,探索其发生的机制刻不容缓。
转化生长因子-β1(TGF-β1)是由TGF-β超家族中重要的一员,参与多种生命活动,包括细胞生长、迁移、分化及凋亡等。研究表明,在百草枯引发的ALI中,TGF-β1被激活[18];在脂多糖引起的ALI中,TGF-β1亦被激活[19];同样在本研究中,海水处理A549细胞后,细胞中TGF-β1 mRNA与蛋白水平表达显著上调,可见TGF-β1在ALI中具有重要作用。众所周知,TGF-β1与细胞凋亡密切相关[9,20-21],但TGF-β1在SWD-ALI引发的细胞凋亡中的作用还未见报道。Smad蛋白是TGF-β超家族的直接底物,可将TGF-β传递的信号携带进入细胞核中,从而影响细胞中转录调控过程[22-23]。而Smad2可被TGF-β1直接激活,TGF-β1活化后与Smad2磷酸化形式相互作用,进而调节细胞生命活动[24-30]。同时,研究发现TGF-β1/Smad2信号通路参与地塞米松调节A549细胞凋亡的过程[8],但TGF-β1/Smad2信号通路是否参与SWD-ALI引发细胞凋亡过程尚不清楚,本研究通过使用TGF-β1受体抑制剂SB431542预处理A549细胞后,再用海水进行处理,流式细胞术、Hoechst染色及Western blot等检测均发现,由海水引起的凋亡现象被抑制剂显著缓解,同时发现TGF-β1的异常上调也被缓解,而Smad2的表达无明显变化,但其磷酸化形式的变化与预期结果一致。本次实验结果与前人研究报道相一致,均表明TGF-β1/Smad2信号通路参与海水淹溺肺损伤引发的细胞凋亡过程。
本文结果可为探索海水淹溺肺损伤引发的细胞凋亡的机制提供一定的理论基础,同样也可为临床开发有效治疗药物提供新的思路。
