白藜芦醇对小细胞肺癌C-myc基因表达的调控研究
2020-05-07李王平马李杰金发光
李王平 马李杰 潘 蕾 金发光
白藜芦醇(Resveratrol, Res)广泛存在于葡萄,浆果,花生和葡萄酒中,并具有多种已知的治疗作用,如抗氧化、抗炎、抗凋亡及抗癌等作用[1-4]。实际上,Res可抑制恶性细胞生长并降低癌症相关基因的表达水平,诱导细胞周期停滞和凋亡[5-7]。myc是人类癌症中最高度扩增的致癌基因之一,包括C-myc,N-myc,L-myc,70%的人类癌症都有myc 表达下调或上升,其中C-myc在肺癌组织中过度表达,而正常组织无表达,在小细胞肺癌中表达率增高[8-9]。研究发现C-myc 蛋白分子中有诱导凋亡活性的结构域,可双向激活介导细胞增殖的基因和诱导凋亡的基因[10]。前期研究证实,Res可通过内源性线粒体功能障碍途径诱导SCLC H446细胞的凋亡并可调控Bcl-2、Bc1-xL、Bax等调亡调控因子[11]。因此,本文的目的评估白藜芦醇对易在小细胞肺癌表达C-myc基因的调节作用,探讨其在小细胞肺癌中的可能抑癌机制。
材料和方法
一、实验材料
人小细胞肺癌H446细胞由空军军医大学第二附属医院呼吸内科实验室提供。FBS培养基、RPMI1640培养基、RPMI1640培养基购自美国Hyclone公司,白藜芦醇购自Sigma 公司,DMSO 购自Invitrogen 公司,胎牛血清、胰蛋白酶购自Gibco公司,BCA 蛋白定量试剂盒购自凯基公司,核蛋白/胞浆蛋白提取试剂盒购自贝博公司,HRP 标记二抗购自碧云天。主要仪器设备:细胞培养箱(美国热电公司),光学显微镜、倒置拍摄显微镜(蔡司公司),低速离心机(湘仪),酶标检测仪(赛默飞),一体式化学发光成像仪(天能化学发光成像系统),实时荧光定量 PCR 仪 (罗氏) Western blot使用一抗为兔来源的抗C-myc抗体、兔来源的抗LaminA/L抗体);相应的二抗为(山羊抗兔和山羊抗鼠)。
二、研究方法
1. 细胞培养及分组方法:(1)将对数生长期的细胞接种至6孔细胞培养板,3 ml/每孔,密度为 5×104cells/ml,每组梯度3个复孔,5% CO237 ℃进行培养;(2)实验分组1:将白藜芦醇分别用完全培养基稀释至20 μg/ml,30 μg/ml,40 μg/ml,设空白对照组,给药后培养24 h;(3)实验分组2:将白藜芦醇用完全培养基稀释至30 μg/ml,分别给药处理0、3、6、12、24 h;(4) 实验分组3:将 NAC用完全培养基稀释至2 mmol/L,预处理细胞1 h,将白藜芦醇用完全培养基稀释至35 μg/ml 再处理细胞24 h。实验分组为:空白对照组(CK)、Res组(35 μg/ml)、NAC组(2 mmol/L)、 Res+NAC 组;(5)实验分组4:顺铂浓度为 5 μg/ml,Res浓度为35 μg/ml,给药处理24 h,实验分组为:空白对照组(CK)、Res组(35 μg/ml)、顺铂组(5 μg/ml)、顺铂+Res 组;(6)收集各组细胞,抽提RNA和蛋白进行Western blot、PCR检测。
2. Western blot检测目的蛋白质的表达水平: 根据蛋白质提取试剂盒说明书提取细胞质、核蛋白和总蛋白样本。使用商用试剂盒通过BCA定量分析不同组的总蛋白量。12%SDS-PAGE分离等量的变性蛋白(20 μg),并转移至PVDF膜上。用5%(W/V)脱脂牛奶封闭,加入的一抗(稀释度为1︰2 000),4 ℃孵育过夜。将膜与二抗室温下孵育1 h。一体式化学发光仪记录Western blot结果,拍摄照片。注:一抗分别为(小鼠来源的抗GAPDH抗体、兔来源的抗C-myc抗体、兔来源的抗LaminA/C抗体);相应的二抗为(山羊抗兔和山羊抗鼠)。运用Image J软件进行灰度分析,并将灰度分析整理在 Excel 工作簿中,并且作出对应的柱状图。
3. Real-Time PCR检测myc基因表达: 依照以下次序进行:RNA的抽提、逆转录c DNA(方法按第一链c DNA合成试剂盒所示步骤进行c DNA的合成)、聚合酶链式反应(PCR,Real-time PCR所需引物使用Primer Premier 5.0软件进行设计,内参为管家基因GAPDH)、Real time- PCR反应体系(反应液的配制按Real-time PCR反应体系要求进行)、PCR扩增条件(94 ℃ 10 min,(94 ℃ 20 s,55 ℃ 20 s,72 ℃ 20 s)40个循环,72 ℃ 5 min),最后于实时荧光定量PCR仪自动分析结果。
引物由上海生工公司合成,引物序列如下:
C-myc(Human)-RT-F:5′-CCGAAGGGAGAAGG
GTGT-3′
C-myc(Human)-RT-R:5′-CTGCGACGAGGAGG
AGAA-3′
Human GAPDH -RT-F:5′-AGAAGGCTGGGGCT
CATTTG-3′
Human GAPDH -RT-R:5′-AGGGGCCATCCACA
GTCTTC-3′
三、统计学分析
采用SPSS 23.0进行数据分析,计量数据采用均数±SD表示,组间比较采用t检验;以P<0.05为检验水平。
结 果
一、Western blot结果
1. 不同浓度 Res 给药时各观察指标蛋白的表达情况: Western blot 条带观察及灰度分析结果表明,与CK相比,不同浓度Res作用时,随着Res给药浓度的增加,胞浆蛋白和胞核蛋白中C-myc 表达均在Res浓度为 30 μg/ml 显著下降,差异有统计学意义,P<0.01。并随着浓度增高,进一步下降,组间(Res浓度为30 μg/ml和40 μg/ml)差异有统计学意义,P<0.01。P值:胞浆蛋白:20 μg/ml(P=0.3766)、30 μg/ml、40 μg/ml(P=0.00);胞核蛋白:20 μg/ml (P=0.37837)、30 μg/ml、40 μg/ml(P=0.00),见图1、2。
2. Res给药不同时间相关蛋白的表达: Western blot条带结果及灰度分析结果表明,与CK组相比,随着Res给药时间的延长,胞浆蛋白中C-myc表达下降,同样胞核中C-myc表达随作用时间延长逐渐降低,胞核与胞浆蛋白中C-myc表达呈同向变化。P值:胞浆蛋白: 3 h(P=0.16764)、6 h(P=0.09045)、12 h、24 h(P=0.00);胞核蛋白:3 h(P=0.09631)、6 h(P=0.37860)、12 h、24 h(P=0.00),见图3、4。
3. NAC 预处理后对蛋白表达的影响: 从前面的 Res 浓度及作用时间实验结果可知,Res对C-myc蛋白表达有明显的调控作用。而与Res组相比,NAC预处理后再给予Res的Western blot条带及灰度分析结果表明,给予NAC预处理后,可使Res给药后,胞浆中C-myc表达上升,即起到拮抗Res效应的作用,差异有统计学意义,P<0.01。胞浆蛋白:与CK比较Res(P=0.00)、Res+NAC(P=0.00222)、组间比较(P=0.00);胞核蛋白:与CK比较Res(P=0.00)、Res+NAC(P=0.00)、组间比较(P=0.00201),见图5、图6。

图1 不同浓度Res作用时蛋白的表达变化(μg/ml) 图2 不同浓度 Res作用时蛋白的表达灰度分析(μg/ml )
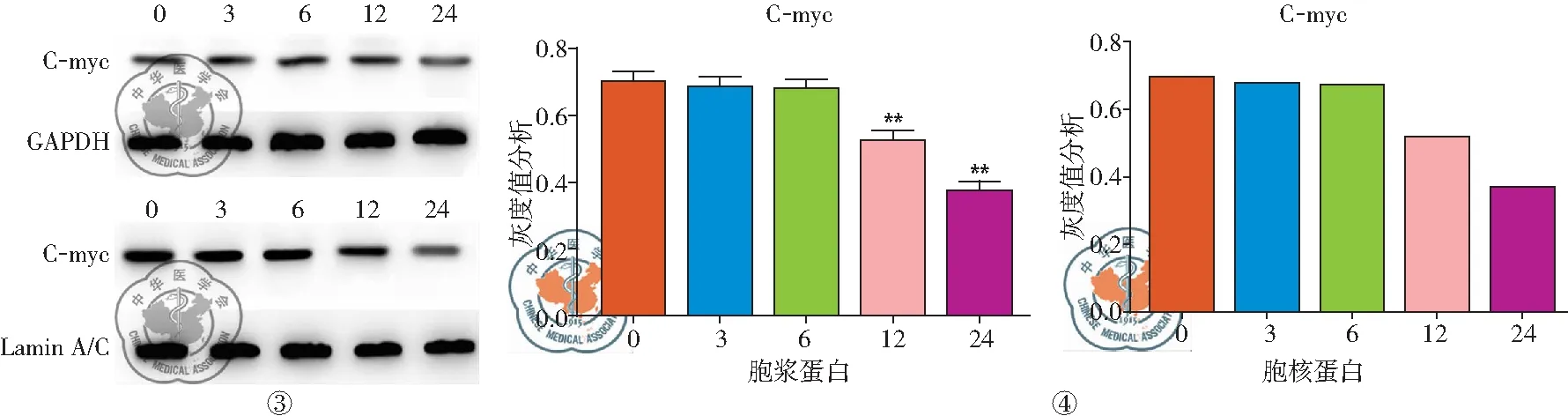
图3 Res作用不同时间蛋白的表达变化(μg/ml) 图4 Res作用不同时间蛋白的表达灰度分析 (μg/ml)

图5 NAC预处理后对蛋白表达的影响 图6 NAC预处理后对蛋白表达的影响
4. 顺铂与Res联合作用对蛋白表达的影响: Western blot条带及灰度分析结果显示,顺铂对胞浆胞核中的C-myc蛋白表达均有调节作用,与CK相比,差异有统计学意义,P<0.01;顺铂与Res联用后对胞浆中的C-myc蛋白表达调节作用更加显著,呈协同效应,与Res相比,差异有统计学意义,P<0.01。但与Res相比,顺铂联合给药后,胞核中C-myc的表达虽进一步下降,但差异无统计学意义,P>0.05。P值:胞浆蛋白:Res(P=0.00)、顺铂(P=0.00)、顺铂+Res(P=0.00)、Res与顺铂+Res组间比较(P=0.00);胞核蛋白:Res(P=0.01568)、顺铂(P=0.00905)、顺铂+Res(P=0.00)、Res 与顺铂+Res,组间比较(P=0.0659),见图7、8。
二、Real-time PCR结果
1. 不同浓度Res给药时C-myc的表达变化: 与CK组相比,Res给药后C-myc表达下降,并在30 μg/ml时发生明显变化,差异均有统计学意义,P<0.01,说明Res对C-myc基因的调节与药物浓度有关。P值:20 μg/ml(P=0.19172)、30 μg/ml、40 μg/ml(P=0.00),见图9 。
2. Res给药不同时间C-myc表达水平的变化: 随着给药时间延长,C-myc表达开始下降,在24 h时达到最低点,与CK组相比,差异有统计学意义,P<0.01,说明Res对C-myc基因的调节与药物作用时间有关。P值:3 h(P=0.72209)、6 h(P=0.24021)、12 h(P=0.00544)、24 h(P=0.00),见图10。
3. NAC 预处理后C-myc表达的变化: Real-Time PCR检测结果提示,Res给药可引起C-myc表达水平下降,NAC预处理后再给予Res,可发现NAC预处理对Res引起的C-myc表达下降能起到拮抗作用,差异有统计学意义,P<0.01。P值:与CK比较Res(P=0.00)、NAC+Res(P=0.00)、组间比较(P=0.00),见图11。
4. 顺铂联合用药时C-myc表达变化: 顺铂和Res均可使C-myc表达水平下调,差异有统计学意义,P<0.01;两者联合使用,可使其表达下调更为显著,差异有统计学意义,P<0.01,说明两者联用可起到协同效果。P值:与CK比较Res(P=0.00)、顺铂(P=0.00)、顺铂+Res(P=0.00)、Res 与顺铂+Res比较(P=0.00),见图12。

图7 顺铂联合用药时蛋白表达变化 图8 顺铂联合用药时蛋白表达变化

图9 不同浓度Res对C-myc表达水平的影响(μg/ml) 图10 Res给药不同时间C-myc表达水平变化(h) 图11 NAC预处理后C-myc表达变化 图12 顺铂联合用药时C-myc的表达变化
讨 论
小细胞肺癌占肺癌种类的15%~20%,然而80%的小细胞肺癌诊断时已是广泛期[12]。由于小细胞肺癌恶性程度高,倍增时间短,转移早而广泛,虽然对化疗、放疗敏感,初治缓解率高,但极易发生继发性耐药,容易复发,截止目前,小细胞肺癌的治疗方法仍以放化疗为主。一旦化疗耐药,小细胞肺癌患者的生存时间显著缩短。小细胞肺癌的治疗效果在过去的几十年中没有明显改善,对于小细胞肺癌靶向治疗及免疫治疗的相关研究较为滞后。虽然已有一些针对小细胞肺癌靶向治疗的临床实验,但目前尚未有明确疗效的报道,部分患者使用免疫调节剂,但疗效欠佳[13]。早在1997年,Jang等[14]即发现,白藜芦醇的抗癌活性贯穿于癌症的整个发生、发展过程中,可减少自由基形成、抑制环氧合酶、过氧化氢酶、抑制癌细胞增殖、诱导癌细胞分化和凋亡等。前期的研究结果同样证实白藜芦醇对非小细胞肺癌H838和H520细胞和小细胞肺癌H446细胞的增殖均有抑制作用,并提示其作用机制与诱导细胞调亡有关[11,15]。myc癌基因蛋白属于一个所谓的“超级转录因子”家族,它可能调控着整个基因组至少15%的转录[16]。其主要下游效应包括核糖体生物发生、蛋白翻译、细胞周期进展和代谢,有着广泛的生物功能,如细胞增殖、分化、生存和免疫监视等[17]。正常情况下,myc家族成员的表达受到严格调控,但在人类癌症中其功能经常失调[18]。小细胞肺癌基因组存在较高的基因突变率,如myc,TP53,TP73,KRAS,RB1等,但目前的研究还未能发现有明确针对小细胞肺癌的靶向药物[19-20]。一项体内外试验认为,SCLC基因中存在myc扩增或高表达时,可能对Aurora激酶抑制剂 Barasertib有反应[21]。因此研究小细胞肺癌与myc基因的关系,筛选可能有效的治疗小细胞肺癌的药物具有基础研究及临床研究价值。
本文通过Western blot和Real time-PCR两种方法分别对小细胞肺癌细胞系H446细胞的C-myc基因表达进行了检测,采取不同浓度、不同作用时间,以及使用NAC和顺铂进行干预对照的方式,论证白藜芦醇对小细胞肺癌细胞系H446细胞的C-myc基因表达是否有调控作用。试验结果表明,H446细胞中C-myc基因蛋白的表达升高,说明C-myc基因与小细胞肺癌的发生、发展关系密切,与研究报道的C-myc在肺癌组织中过度表达,在小细胞肺癌中表达率增高的研究结论相符[9]。而给予白藜芦醇后可降低H446细胞胞核蛋白和胞浆蛋白中C-myc基因的表达水平,其表达水平变化与Res的浓度和作用时间有关,呈现浓度依赖和时间依赖的特点。给予NAC预处理后,可拮抗Res给药引起的C-myc基因的表达水平下降程度,而联用顺铂后,则起到明显的协同作用。
myc癌基因家族包括3个成员,C-myc,mycn和mycl,分别编码C-myc、N-myc和L-myc[16]。目前对L-myc的作用仍不太清楚,但研究发现,N-myc表达是在组织中是受限的,认为N-myc可以替代小鼠中C-myc的作用[22-23]。而C-myc蛋白分子中有诱导凋亡活性的结构域,可双向激活介导细胞增殖的基因和诱导凋亡的基因[10]。研究发现myc水平适度增加可以刺激细胞和机体的生长,但过度激活时则诱导细胞自主凋亡,抗凋亡的Bcl家族成员在淋巴瘤和实体瘤中均可介导myc驱动的细胞凋亡,小鼠淋巴瘤模型证实p53可参与介导myc诱导的凋亡[24]。研究发现,肿瘤在同时表达Bcl-2和C-myc,N-myc时,侵袭作用更加明显[25-31]。以上研究均说明myc基因与肿瘤的发生发展密切相关,且myc基因与调亡相关蛋白关系密切。前期研究证实了白藜芦醇可诱导小细胞肺癌H446细胞的调亡,其作用机制与调亡调节蛋白有关[11,27]。本文发现白藜芦醇可降低C-myc基因的表达水平,并有时间和浓度依赖的特点。而与顺铂联合,可增强顺铂对C-myc基因表达水平的影响,说明白藜芦醇可通过调控C-myc基因的表达对H446细胞的增殖起到抑制作用,而其作用机制是否与调亡有关,尚待进一步研究证实。
本文缺陷在于仅观察了C-myc基因的表达变化,而未对L-myc和N-myc进行同步观察,以更加深层次了解myc基因在小细胞肺癌发生、发展中的作用。此外,本文仅为细胞水平研究,尚待动物实验对本实验结果进行进一步验证。
