绿豆蛋白提取工艺的响应面法优化
2020-05-06柳芬芳李迎秋
柳芬芳 李迎秋


关键词:绿豆蛋白;响应面法;碱提酸沉法
摘要:以绿豆为原料,采用碱提酸沉法提取绿豆蛋白,通过单因素试验研究绿豆粉与蒸馏水质量比、提取温度、提取时间和pH值对绿豆蛋白提取率的影响,并通过响应面法优化绿豆蛋白的提取工艺.结果表明:绿豆蛋白的最佳提取工艺条件为绿豆粉与蒸馏水质量比1GA6FA15,提取温度40 ℃,提取时间20 min,pH值9.0,该条件下绿豆蛋白的最大提取率可达88.80%.
Abstract:With mung bean as raw material,alkaline-extraction method was used to obtain mung bean was made by proteins.The effect of mung bean flour and distilled water mass ratio, extraction temperature, extraction time and pH value on the mung bean protein extraction rate were studied by single factor experiment.Optimization of protein extraction from mung bean was made by using response surface methodology.The results showed that the optimum extraction conditions for mung bean protein were the ratio between mung bean flour and distilled water mass 1GA6FA15 , extraction temperature 40 ℃, extraction time 20 min and pH value 9.0.Under these conditions, the maximal extraction rate of mung bean protein was 88.80%.
0 引言
绿豆,又称青小豆,是重要的豆科植物,世界各地广泛种植.绿豆有黄色、青色、褐色3种颜色,其种皮分为有光泽和无光泽两种类型.根据绿豆种皮的色泽,又可以划分为明绿豆、杂绿豆、灰绿豆、黄绿豆4种类型[1].绿豆的食用价值很高,营养物质丰富,价格低廉,几千年来,一直是中国百姓餐桌上的常见食品[2].绿豆含有多种营养成分,包括蛋白质、膳食纤维、维生素、矿物质、碳水化合物和氨基酸,其中,绿豆蛋白的氨基酸谱显示其可以满足人体对氨基酸的需求[3].绿豆含有20%以上的蛋白质和60%以上的碳水化合物,其中绿豆蛋白作为植物来源的蛋白质,是豆类所含成分中仅次于淀粉的第二大成分[4-5].据报道,绿豆蛋白是一种重要的生物活性蛋白[3].然而在亚洲,目前从绿豆中提取的产物主要是淀粉而非蛋白质.在绿豆加工中,蛋白质作为副产物被丢弃,造成资源的浪费.随着粮食安全问题日益凸显,以及动物源性蛋白质成本上涨带来的压力,人们对天然植物源性蛋白质的关注度不断增强,开发绿豆蛋白以缓解我国植物源性蛋白紧缺的现状,丰富我国植物源性蛋白资源,具有重要意义.
提取植物蛋白最常用的一种方法是碱提酸沉法[6-7],此外還有酶解法、超滤法等[8-14].酶解法提取植物蛋白的催化效率高,但由于其成本高,对剂量要求高,因此不适用于工业化生产.超滤法具有操作简单、成本较低的优点,但其更适用于植物蛋白的纯化而非提取.碱提酸沉法的优点是蛋白质溶出率较高,操作简单,成本低,但也有缺点,即碱液浓度过大时,易发生美拉德反应,使蛋白质溶液颜色加深,从而影响其营养特性[15].尽管如此,与酶解法、超滤法相比,碱提酸沉法仍是更适用于植物蛋白提取工业化生产的方法.L.U.Thompson[16]第一次根据蛋白质可在等电点时沉淀的特性,使用碱提酸沉法将绿豆中的蛋白提取出来.随后,R.N.Adsuale[17]对提取的绿豆分离蛋白作了营养方面的综述.刘咏等[18]对以水作为提取剂提取绿豆粉中蛋白质的最佳提取工艺条件进行了优化.响应面法是一种应用广泛的试验优化方法,可以快速高效地确定存在多影响因子系统的最佳条件,已在多种优化实践中得到应用[19].
然而,利用响应面法优化绿豆蛋白的提取工艺却鲜有报道.
鉴于此,本文拟通过碱提酸沉法提取绿豆蛋白,采用单因素试验和响应面优化以获得绿豆蛋白的最佳提取工艺,以期充分开发植物源性蛋白,促进绿豆蛋白资源的利用,进而为绿豆蛋白提取的工业化生产提供参考.
1 材料与方法
1.1 实验材料
绿豆,购于山东省家家悦超市;NaOH,分析纯,天津市鼎盛鑫化工有限公司产;磷酸,HCl,95%乙醇,
均为分析纯,
国药集团化学试剂有限公司产;考马斯亮蓝,美国Sigma公司产.
1.2 仪器与设备
AL 204型
分析电子天平,梅特勒-托利多仪器(上海)有限公司产;DK-98-IIA型数显恒温水浴锅,金坛市金南仪器厂产;HX-100型高速粉碎机,浙江省永康市溪岸五金药具厂产;SC-242D型立式冷藏展示柜,青岛海尔股份有限公司产;TG16-WS型台式高速离心机,湖南湘仪实验室仪器开发有限公司产;手动单道可调式移液器,北京大龙医疗设备有限公司产;GZX-9140MBE型数显鼓风干燥箱,上海博迅实业有限公司医疗设备厂产;Kjeltec 2300型全自动凯氏定氮仪,广州赛为思仪器设备有限公司产;PB-10标准型pH计,赛多利斯科学仪器(北京)有限公司产;Scientz-18N型真空冷冻干燥机,宁波新芝生物科技股份有限公司产;721型紫外可见分光光度计,上海舜宇恒平科学仪器有限公司产.
1.3 实验方法
1.3.1 绿豆蛋白的提取 绿豆经过除杂后,用水清洗干净,放入鼓风干燥箱内烘干,用高速粉碎机将绿豆磨成粉,过60目筛;用电子天平称取1.000 g绿豆粉,按照一定的质量比加入蒸馏水,搅拌,使之混合均匀,并用 1.0 mol/L NaOH和1.0 mol/L HCl调节溶液的pH值;将混合均匀的绿豆粉溶液放在特定温度的恒温水浴锅中保温一段时间,冷却至室温后,以 4000 r/min 的转速离心10 min,过滤;取过滤后的上清液,用 1.0 mol/L HCl调节其pH值至 4.0,以4000 r/min的转速离心10 min,弃去上清液,将沉淀反复水洗至中性,加少量蒸馏水复溶,经过冷冻干燥后,即得绿豆蛋白,储存于 4 ℃ 冰箱中备用.
1.3.2 绿豆蛋白提取率的测定 绿豆蛋白提取率的计算公式为绿豆蛋白提取率=提取液中蛋白质含量绿豆中总蛋白含量×100%式中,提取液中的蛋白质含量采用考马斯亮蓝法[20]进行测定,绿豆中的总蛋白含量采用凯氏定氮法[21]测定,蛋白质的换算系数为6.25.
1.3.3 单因素试验 在前期实验的基础上,选择4种对绿豆蛋白提取率有影响的因素,即绿豆粉与蒸馏水质量比 (1GA6FA5,1GA6FA10,1GA6FA15,1GA6FA20,1GA6FA25) 、pH值 (8.0,8.5,9.0,9.5,10.0) 、提取时间 (10 min,20 min,30 min,40 min,50 min) 和提取温度 (20 ℃,30 ℃,40 ℃,50 ℃,60 ℃),进行单因素试验,分别测定各相关单因素对绿豆蛋白提取率的影响.
1.3.4 响应面优化试验 在单因素试验的基础上,选择绿豆粉与蒸馏水质量比(X1)、提取温度(X2)、提取时间(X3)和pH值(X4)4个因素为响应面优化试验中的关键因素,以绿豆蛋白质提取率(Y)为响应值,进行绿豆蛋白提取工艺条件的优化.响应面自变量因素编码和水平见表1.
1.4 数据处理和分析
每个样品重复进行3次试验,所得数据均采用Microsoft Excel 2010软件处理并绘图,采用Design Expert 8.0.6.1软件对响应面试验数据进行分析.
2 结果与分析
2.1 单因素试验结果分析
2.1.1 绿豆粉与蒸馏水质量比对绿豆蛋白提取率的影响 在pH值为9.0,提取温度为 40 ℃,提取时间为20 min的条件下,绿豆粉与蒸馏水质量比对绿豆蛋白提取率的影响如图1所示.由图1可知,随着绿豆粉与蒸馏水质量比的减小,绿豆蛋白的提取率呈先增大后减小的趋势.当绿豆粉与蒸馏水质量比较大时,绿豆蛋白提取率增加的幅度较大,随着绿豆粉与蒸馏水质量比的继续减小,绿豆蛋白的提取率增幅较小.这可能是因为随着绿豆粉与蒸馏水质量比的减小,溶质体系分布得更加均匀,有利于蛋白质的充分溶解[22].当绿豆粉与蒸馏水质量比达到 1GA6FA15 时,绿豆蛋白的提取率开始呈现减小的趋势,产生这种现象可能是因为随着加水量的增大,提取液中蛋白质浓度的降低以及其他小颗粒物质的溶解[23],使得绿豆蛋白的提取率减小.由此可知,当绿豆粉与蒸馏水质量比为1GA6FA15时,绿豆蛋白提取率可达到最大值(为 88.88%),可将该质量比作为响应面试验设计的中心值.
2.1.2 pH值对绿豆蛋白提取率的影响 在温度为40 ℃,绿豆粉与蒸馏水质量比为1GA6FA15,提取时间为20 min的条件下,pH值对绿豆蛋白提取率的影响如圖2所示.由图2可知,随着pH值的增大,绿豆蛋白的提取率呈先增大后减小的趋势.当pH值低于9.0时,绿豆蛋白的提取率随着pH值的增大而增大,这主要是因为在碱性环境下,蛋白质分子间的静电斥力比较大[24],有利于蛋白质与水分子相互作用,蛋白质溶解度增加,导致蛋白质的提取率也增大.当pH值达到9.0后,若进一步增大pH值,绿豆蛋白的提取率趋于平缓减小的状态,这主要是因为pH值过大会改变蛋白质表面的电荷分布状态,从而增加蛋白质的水溶性,即增加了水溶性蛋白含量.在高pH值条件下,绿豆蛋白的颜色也会进一步加深,这是因为发生了美拉德反应,而美拉德反应产生的黑褐色物质类黑精还会导致蛋白质的变性和营养功能的丧失[25].综合上述情况考虑,选取pH 值为 9.0作为响应面试验设计的中心值.
2.1.3 提取时间对绿豆蛋白提取率的影响 在温度为40 ℃,绿豆粉与蒸馏水质量比为1GA6FA15,pH值为9.0的条件下,提取时间对绿豆蛋白提取率的影响如图3所示.由图3可知,当提取时间从10 min增加到20 min时,绿豆蛋白的提取率增幅很大,并且在20 min时,绿豆蛋白的提取率达到最大值(为88.80%).随着提取时间的进一步延长,绿豆蛋白的提取率出现减小的趋势,并逐渐趋于稳定.刚开始提取时,绿豆蛋白的提取率较低,这可能是因为起初蛋白质与水混合不充分,导致只有较少的一部分蛋白质分子与水分子发生相互作用;随着提取时间的延长,蛋白质分子结构逐渐伸展、无序,导致更多的亲水基团暴露出来[26],蛋白质的溶解度增大,从而提高了提取率.绿豆蛋白的提取率达到最大值后,若继续延长提取时间,提取率开始减小,这是由于长时间的碱性环境导致蛋白质发生变性继而生成沉淀[27],以致绿豆蛋白的提取率减小.综合上述情况考虑,选取提取时间20 min作为响应面试验设计的中心值.
2.1.4 提取温度对绿豆蛋白提取率的影响 在绿豆粉与蒸馏水质量比为1GA6FA15,pH值为9.0,提取时间为20 min的条件下,提取温度对绿豆蛋白提取率的影响如图4所示.由图4可知,当提取温度从20 ℃提高到40 ℃时,绿豆蛋白的提取率明显增大;当提取温度为40 ℃时,绿豆蛋白的提取率达到最大值(为88.88%);当提取温度进一步升高,绿豆蛋白的提取率出现减小的趋势.绿豆蛋白的提取率随着温度的升高而增大,可能是由于温度的升高使水分子和蛋白质分子的相互作用增强,提高了蛋白质的溶解度,从而使蛋白质的提取率增大.但是随着温度的进一步提高,会导致蛋白质的变性和蛋白质颜色的加深[28],从而使绿豆蛋白的提取率减小,造成绿豆蛋白营养物质的损失.综合上述情况考虑,选取提取温度40 ℃为响应面试验设计的中心值.
2.2 响应面优化试验结果分析
绿豆蛋白提取率的响应面试验设计方案和结果见表2.
利用Design Expert 8.0.6.1响应面软件对表2的试验结果进行回归分析,得到绿豆蛋白提取率对绿豆粉与蒸馏水质量比、提取温度、提取时间和pH值四因素的二次多项回归方程,即对绿豆蛋白提取率的回归模型方差的分析见表3.
从表3可知,模型的P<0.000 1,表示采用碱提酸沉法提取绿豆蛋白的回归模型极其显著.与此同时,回归模型的一次项X1(绿豆粉与蒸馏水质量比)是显著的,二次项X12,X22,X32和X42是极显著的;交互项X1X2,X1X3,X2X4,X3X4是极显著的,X2X3是显著的,X1X4是不显著的.从以上分析结果可知,绿豆蛋白提取率的二次多项回归模型显著,各因素对绿豆蛋白提取率的影响是一种复杂的关系,各个因素中提取温度、绿豆粉与蒸馏水质量比是影响绿豆蛋白提取率的重要因素.失拟项P为0.583 3是不显著的,相关系数 R2 =0.985 4,说明模型拟合程度好,该二次多项回归模型可以较好地分析和预测绿豆蛋白的提取率.
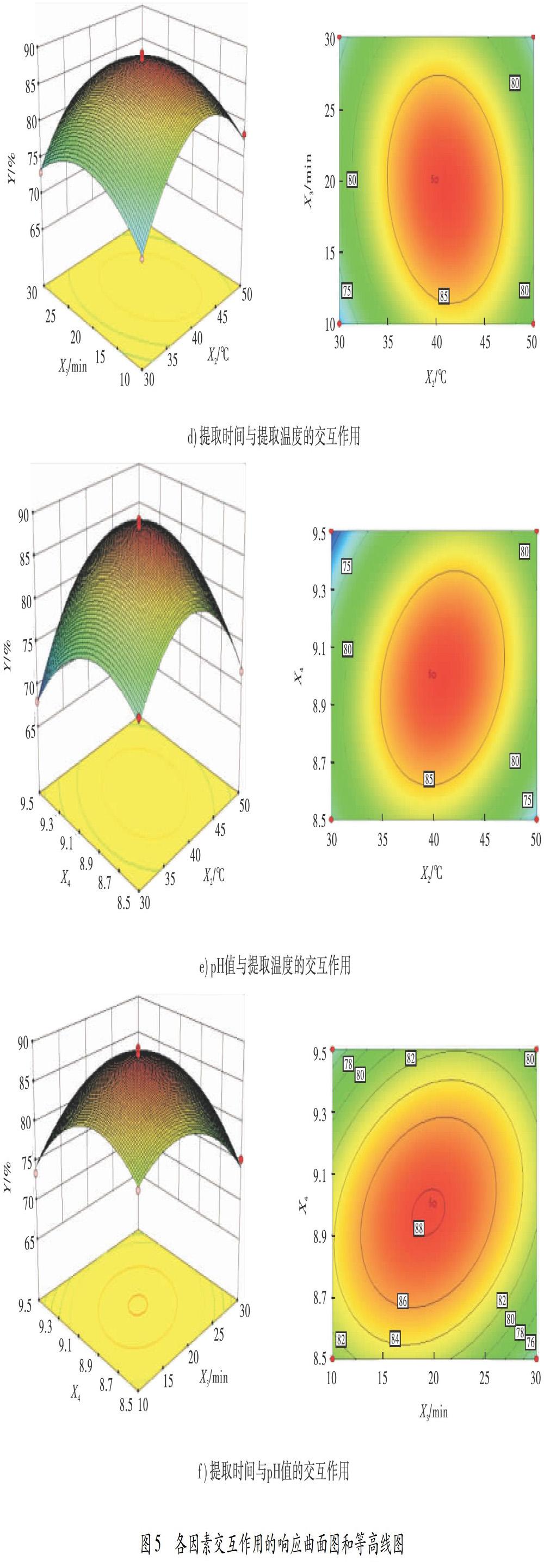
根据绿豆蛋白提取率的回归方程,利用Design Expert 8.0.6.1响应面分析软件绘制各因素交互作用的响应曲面图和等高线图,如图5所示.图5显示的是一种因素水平为0时,另外两因素对绿豆蛋白提取率的交互作用:3D曲面坡度越大,两因素相互作用影响越显著;等高线图的椭圆离心率越大,两因素相互作用效果越大.由图5可看出,各等高线均为椭圆形,其中,图5c)的曲面倾斜程度最大,说明绿豆粉与蒸馏水质量比与提取时间、绿豆粉与蒸馏水质量比与提取温度、提取温度与pH值、提取时间与pH值的交互作用对绿豆蛋白提取率的影响极显著,而提取温度与提取时间交互作用的影响是显著的,绿豆粉与蒸馏水质量比与pH值交互作用的影响不显著.
响应面优化回归模型结果表明,当绿豆粉与蒸馏水质量比为1GA6FA14.5,提取温度为 38.9 ℃,提取时间为19.2 min,pH值为 8.9时,理论上绿豆蛋白提取率的最大值为 87.24%.为了便于试验操作,将优化得到的绿豆蛋白提取工艺条件修正为绿豆粉与蒸馏水质量比 1GA6FA15,提取温度40 ℃,提取时间20 min,pH值9.0.
2.3 响应面优化模型的验证结果分析
为了检验响应面试验所得到的绿豆蛋白提取率模型的正确性和合理性,重新进行了一组验证试验.在绿豆粉与蒸馏水质量比为1GA6FA15,提取温度为40 ℃,提取时间为20 min,pH值为9.0的条件下,绿豆蛋白的提取率为88.80%.由此可知,绿豆蛋白提取率验证试验的结果与模型预测值之间没有很大的差异 (P>0.05),说明了响应面设计得到的模型可以较准确地分析和预测绿豆蛋白的提取率.
3 结论
本文采用碱提酸沉法提取绿豆中的蛋白质,
通过单因素试验研究了绿豆粉与蒸馏水质量比、提取温度、提取时间和pH值对绿豆蛋白提取率的影响,并通过响应面法优化了绿豆蛋白的提取工艺.
结果表明:绿豆蛋白的最佳提取工艺条件为绿豆粉与蒸馏水质量比 1GA6FA15,提取温度40 ℃,提取时间20 min,pH值 9.0,在此条件下绿豆蛋白可获得最大提取率(为 88.80%).该研究为绿豆蛋白提取的工业化生产提供了一定的技术参考,对绿豆蛋白的开发和绿豆活性物质的研究有一定的促进作用.
参考文献:
[1] 程须珍,王素华,田静,等.绿豆优异种质综合评价[J].中国农业科学, 1999,32:36.
[2] XIE J H,DU M X,SHEN M Y,et al.Physico-chemical properties, antioxidant activities and angiotensin-I converting enzyme inhibitory of protein hydrolysates from mung bean (Vigna radiate)[J].Food Chemistry,2019(270):243.
[3] DU M,XIE J,GONG B,et al.Extraction,physicochemical characteristics and functional properties of mung bean protein[J].Food Hydrocolloids, 2018,76:131.
[4] WANG Z,HAN F,SUI X,et al.Effect of ultrasound treatment on the wet heating Maillard reaction between mung bean (Vigna radiate (L.)) protein isolates and glucose and on structural and physico-chemical properties of conjugates[J].Journal of the Science of Food and Agriculture, 2016,96(5):1532.
[5] KHAKET T P,DHANDA S,JODHA D.Purification and biochemical characterization of dipeptidyl peptidase-Ⅱ (DPP7) homologue from germinated Vigna radiata seeds[J].Bioorganic Chemistry,2015,63:132.
[6] 于鵬亮.茶渣中蛋白质和多糖的综合提取及其分离纯化[D].合肥:安徽农业大学,2013.
[7] 史卿.富硒菜籽粕蛋白功能性质及抗氧化活性的研究[D].南昌:南昌大学,2013.
[8] 程水明,赵俊仁,王春,等.木瓜蛋白酶酶解海蜇脑蛋白工艺的优化[J].湖北农业科学,2014,53(7):1649.
[9] CHENG S M, ZHAO J R,LIU J F, et al. Technology for enzymolysis of jellyfish brain protein by bromelain[J].Agricultural Science & Technology, 2013, 14(10): 1486.
[10]张颖,张光艳,王宇翔,等.不同花源蜂蜜蛋白质组分及提取方法的比较[J].食品与发酵工业,2019,45(14):91.
[11]顾文芬,曾凡逵,程锦春.超滤法从马铃薯淀粉加工分离汁水中回收蛋白质的研究[J].现代食品科技,2018,34(3):131.
[12]江连洲,张巧智,李杨,等.大豆水酶法水解液中蛋白质超滤回收及特性研究[J].农业机械学报,2017,48(2):327.
[13]赵斌,杨鑫,洪剑鹏,等.超滤过程中蛋白质的空间分布规律[J].天津工业大学学报,2019,38(3):22.
[14]李国军,姜媛媛,王莹,等.超滤技术在蛋白质分离纯化中应用[J].生物技术世界,2016(3):227.
[15]AVAN U D,MCKENZIE D B,SHAHIDI F.Functional properties of protein isolates from beach pea (Lathyrus maritimus L.)[J].Food Chemistry, 2001, 74(2): 177.
[16]THOMPSON L U.Preparation and evaluation of mung bean protein isolates[J].Journal of Food Science,1977,42:1365.
[17]ADSUALE R N.Chemistry and technology of green grain,CRC critical review[J].Food Science and Nutrition,1986,25(1):73.
[18]刘咏,杨柳.绿豆蛋白质提取工艺的优化[J].食品科学,2008,29(8):272.
[19]陈翔宇,邹怡然,蒋天宁,等.响应面法优化碱溶酸沉法提取黄秋葵蛋白工艺条件研究[J].海南师范大学学报(自然科学版),2019,32(3):288.
[20]王孝平,邢树礼.考马斯亮蓝法测定蛋白含量的研究[J].天津化工,2009,23(3):40.
[21]中国国家标准化委员会.食品中蛋白质的测定:GB 5009.5—2016[S].北京:中国标准出版社,2016.
[22]KIM E O, LEE J Y, CHOI S W.Quantitative changes in phenolic compounds of safflower (Carthamus tinctorius L.) seeds during growth and processing[J].Preventive Nutrition and Food Science, 2006, 11(4): 311.
[23]李永武.綠豆清蛋白的提取及功能特性和理化性质的研究[D].大庆:黑龙江八一农垦大学,2014.
[24]LAWAL O S.Functionality of African locust bean (Parkia biglobossa) protein isolate:Effects of pH,ionic strength and various protein concentrations[J].Food Chemistry,2004,86:345.
[25]SHIH F F,DAIGLE K.Use of enzymes for the separation of protein from rice flour[J].Cereal Chemistry,1997,74(4):437.
[26]CAI W,GU X,TANG J.Extraction,purification,and characterization of the polysaccharides from Opuntia milpa alta[J].Carbohydrate Polymers,2008,71(3):403.
[27]李静娟,易建华,朱振宝.响应面法优化桃仁蛋白提取工艺[J].中国油脂,2010(35):20.
[28]陈建旭,黄生权,敖宏,等.赤灵芝中水溶性蛋白响应面法优化提取[J].现代食品科技,2009,25(6):661.
