再造烟叶浓缩液增香菌的筛选、鉴定与发酵优化
2020-05-06黄申马宁王琼波霍梦杰周利峰冯颖杰杨峰毛多斌
黄申 马宁 王琼波 霍梦杰 周利峰 冯颖杰 杨峰 毛多斌


关键词:再造烟叶浓缩液;增香菌;筛选;鉴定;产蛋白霉菌
摘要:采用稀释涂布平板法,从再造烟叶浓缩液中筛选分离得到一株增香菌株HS-1,对该菌株进行鉴定和发酵培养条件优化,进而对最优培养条件下发酵再造烟叶浓缩液中性香味成分进行分析.结果表明:菌株HS-1为产蛋白霉菌属(Planococcus sp.),其最佳发酵培养条件为发酵温度30 ℃,接种量5%,发酵时间36 h;该培养条件下,经菌株HS-1发酵的再造烟叶浓缩液中,中性香味成分总含量由发酵前的56.845%提高到72.527%,且中性香味成分的种类和含量均有所增加,其中5-甲基糠醛和β-紫罗兰酮为发酵后新增成分,苯甲醇、苯乙醛、2-乙酰基吡咯、苯乙醇、茄酮、β-大马酮、二氢猕猴桃内酯、巨豆三烯酮等成分均有不同程度增加.
Abstract:A flavor-enhancing strain HS-1, was screened and isolated from the reconstituted tobacco concentrate by dilute coating plate method.The strain was identified and the culture conditions for fermentation of the strain were optimized. The neutral aroma components of the reconstituted tobacco concentrate fermented under the optimal culture conditions were analyzed. The results showed that HS-1 was Planococcus sp.,the optimal culture conditions for fermentation were fermentation temperature of 30 ℃, inoculation amount of 5%, and fermentation time of 36 h. Under this culture condition, the total content of neutral aroma components in the reconstituted tobacco concentrate fermented by HS-1 was increased from 56.845% before fermentation to 72.527%, and the types and contents of neutral aroma components had increased. 5-methylfurfural and β-ionone were new ingredients after fermentation, the components such as benzyl alcohol, phenylacetaldehyde, 2-acetylpyrrole, phenethyl alcohol, solanone,β-damascenone, dihydroactinidiolide and megastigmatrienone had increased in varying degrees after fermentation.
0 引言
再造煙叶是以卷烟生产过程中产生的废弃烟草物质(烟末、烟梗、碎烟片等)为原料,采用物理或化学方法重新组合加工制成的片状或丝状再生产品,可用作卷烟填充料[1].目前,再造烟叶通常按8%~10%的质量分数加入到卷烟配方中,起到降焦减害的作用[2-3].虽然,再造烟叶已经成为卷烟产品必不可少的重要原料,但再造烟叶中性香味成分的含量与天然烟叶相比有较大的差距,这是再造烟叶在感官品质上与天然烟叶存在差距的重要原因[4-6].引起中性香味成分含量差异的主要原因有两点:一是再造烟叶原料基础较差;二是经过萃取浓缩、高温烘干等工艺过程后,烟草原料中性香味成分大量流失.为提高再造烟叶的香气量,目前普遍采用的增香技术是添加香精香料,该方法属于外源性增香,能够通过掩盖杂气和协调香气的方式对产品进行修饰和完善,从而进一步彰显产品风格,但是该方法不能改变产品根源性的感官品质不佳的缺陷.因此,为提升再造烟叶的感官品质,有必要开展内源性增香技术的研究[7-9].
产香微生物可以利用其体内分泌的各类酶,将中性香味前体物质转化为中性香味物质,而烟草提取液和浓缩液可以为产香微生物生长提供充足的碳源、氮源和其他营养成分,该方法即为内源性增香技术.因此,筛选能适应再造烟叶浓缩液环境并能增加再造烟叶浓缩液香气量、提升再造烟叶浓缩液香气质的微生物,具有重要的理论和应用价值[10-12].目前,采用微生物发酵来改善再造烟叶香气品质的研究相对较少.鉴于此,本文拟从再造烟叶浓缩液中筛选出能够产香的微生物,并对其最优培养条件和增香效果进行研究,以期为内源性增香技术的发展提供参考.
1 材料与方法
1.1 材料、试剂和仪器
材料:再造烟叶浓缩液KM-13(QTX),QTX-18,ZY-01,ZY-02,X-2,TS-0002,TS-0003,TS-0005,均由河南卷烟工业烟草薄片有限公司产.
试剂:胰蛋白胨(生物级)、酵母提取物(生物级),英国Oxford公司产;NaCl,无水Na2SO4,NaOH,HCl,无水乙醇,CH2Cl2,以上试剂均为分析纯,上海麦克林生化科技有限公司产.
仪器:LDZX-50KBS型立式压力蒸汽灭菌器,上海申安医疗器械厂产;DHP-9162型恒温培养箱,TH2-C型恒温摇床,太仓市科教器材厂产; 6890a/5975c型气相色谱-质谱联用仪,美国安捷伦公司产;R-1001VN型旋转蒸发仪,郑州长城科工贸有限公司产;ZDHW型调温电热套,北京中兴伟业仪器有限公司产;J6-MI型冷冻离心机,美国Beckman公司产;SW-CJ-1F型超净工作台,苏州安泰空气技术有限公司产;DLSB-1020型低温冷却液循环泵,郑州国瑞仪器有限公司产;BSA323S型电子天平,赛多利科学仪器有限公司产;MS205DU型分析天平,瑞士梅特勒-托利多公司产.
1.2 培养基
察式液体培养基:K2HPO4 1 g/L,MgSO4·7H2O 0.5 g/L,KCl 0.5 g/L,NaNO3 3 g/L,FeSO4·7H2O 0.01 g/L,蔗糖 30 g/L,121 ℃,20 min高压灭菌,4 ℃保存.
察式固体培养基:在每L察式液体培养基中加入20 g琼脂粉,即得.
LB液体培养基:胰蛋白胨 10 g/L,NaCl 20 g/L,酵母粉 5 g/L,121 ℃,20 min高压灭菌,4 ℃ 保存.
LB固体培养基:在每L LB液体培养基中加入20 g琼脂粉,即得.
1.3 实验方法
1.3.1 菌源的富集
取0.5 mL不同来源的再造烟叶浓缩液样品,接种到装有30 mL LB液体培养基的三角瓶中,于30 ℃,150 r/min条件下培养12 h,得到菌源A.取0.5 mL不同来源的再造烟叶浓缩液样品,接种到装有30 mL察氏液体培养基的三角瓶中,于28 ℃,150 r/min条件下培养2 d,得到菌源B[13].
1.3.2 菌种的筛选
分别移取0.5 mL菌源A和0.5 mL菌源B,接种到30 mL质量分数为50%的再造烟叶浓缩液(灭菌)中,于30 ℃,150 r/min条件下培养3 d.然后分别移取1 mL 样品,按照10-2,10-4,10-6浓度梯度进行稀释,再分别移取100 μL稀释菌液到LB固体培养基和察氏固体培养基上进行平板涂布,每个浓度梯度平行涂布3个平板.待操作完成后,将平板倒置于培养箱中,于 30 ℃ 温度下培养2~3 d,观察菌株是否生长.从长有菌株的平板中挑选出形态较好的单菌落,于平板中反复划线进行分离纯化,只有目标菌生长即可确认为纯培养.单菌落活化后进化液体培养,将菌种置于甘油管内,放于-80 ℃冰箱保存.
1.3.3 菌种的驯化
将筛选后保存的菌种活化后,在LB液体培养基或察氏液体培养基中过夜培养,按1%的接种量接种到质量分数为75%的再造烟叶浓缩液(灭菌)中,于30 ℃,150 r/min条件下培养 3 d;按上述条件转接一次后,再按1%的接种量接种到质量分数为100%的再造烟叶浓缩液(灭菌)中,于30 ℃,150 r/min条件下培养3 d;按上述条件再转接一次后,驯化完成.接着,利用稀释涂布平板法获得单菌落,利用LB液体培养基或察氏液体培养基培养后,将菌种置于甘油管中,放于-80 ℃冰箱中保存.
1.3.4 增香菌的确认
将驯化后保存的菌种活化后,按1%的接种量接种到LB液体培养基中,将摇瓶置于30 ℃,150 r/min的摇床中培养12 h,获得种子液,再按5%的接种量转接到装有30 mL 质量分数为100%的再造烟叶浓缩液的三角瓶中,将其置于30 ℃,150 r/min的摇床中培养24 h.同时,将等体积的无菌水作为对照添加到装有30 mL质量分数为100%的再造烟叶浓缩液中,在相同的培养条件下培养24 h.发酵完成后进行中性香味成分分析,使香味成分含量增加的菌种即为增香菌.
1.3.5 菌株鉴定
1.3.5.1 形态观察和革兰氏染色
在显微镜下观察菌株形态,参照文献[16]的方法进行菌株的革兰氏染色.
1.3.5.2 16S rDNA序列扩增、测序和系统发育分析
用细菌基因组DNA快速抽提试剂盒提取目标菌株基因组DNA.PCR反应引物为细菌16S rDNA通用引物,上游引物为5′-AGTTTGATCMTGGCTCAG-3′,下游引物为5′-GGTTACCTTGTTACGACTT-3′,引物由上海生物工程有限公司合成.PCR反应体系为:Taq酶(5 U/μL)0.2 μL,上游引物(10 μmol/L)0.5 μL,下游引物(10 μmol/L)0.5 μL,10×Buffer(10 μmol/L)2.5 μL,DNA模板(50 ng/μL)0.5 μL,dNTP(10 μmol/L)1 μL,ddH2O(灭菌蒸馏水)19.8 μL.测序由上海生物工程有限公司完成.利用BLAST软件将得到的基因序列在NCBI GeneBank中进行同源性检测,
利用 MEGA 5.1软件构建16S rDNA基因序列系统进化树,进行系统发育分析.
1.3.6 再造烟叶浓缩液中性香味成分的提取和分析
1.3.6.1 中性香味成分的提取
移取再造烟叶浓缩液25 mL放入1000 mL的圓底蒸馏烧瓶中,加入500 mL蒸馏水和100 g无水Na2SO4后,进行加热;向浓缩瓶中加入80 mL的CH2Cl2,在60 ℃恒温水浴中加热2.5 h.萃取后的溶液分别用质量分数为5%的稀HCl和质量分数为5%的稀NaOH洗涤3次,得到中性香味成分提取液,加入适量的无水Na2SO4,干燥过夜.于60 ℃恒温水浴条件下浓缩至1 mL,进行GC-MS分析[14-15].
1.3.6.2 中性香味成分的分析
GC-MS分析条件如下.
色谱条件:Agilent HP-5MS 色谱柱(30 m×250 μm×0.25 μm);进样口温度280 ℃;载气为高纯He(99.999%),流速为1.0 mL/min;升温程序为初始温度50 ℃,保持 4 min,然后以2 ℃/min的速率升温至240 ℃,结束;不分流;进样量1.0 μL;采用全扫模式.
质谱条件:传输线温度280 ℃;离子源温度280 ℃;四极杆温度150 ℃;电离方式为电子轰击(EI),电子能量70 eV;溶剂延迟时间8 min;全扫质量范围(m/z)为35~550 u.
1.3.7 再造烟叶浓缩液增香菌发酵条件的优化
1.3.7.1 单因素试验
取多个100 mL的再造烟叶浓缩液TS-0005,分别储存于250 mL的三角瓶中,加入一定量的增香菌,利用同时蒸馏萃取法,分别考察发酵温度、接种量、发酵时间3个因素对再造烟叶浓缩液中性香味成分含量的影响.考察发酵温度的影响时,将发酵温度设为26 ℃,28 ℃,30 ℃,32 ℃,34 ℃共5个梯度,接种量5%,发酵时间 24 h;考察接种量的影响时,将接种量设为1%,3%,5%,7%,9%共 5个梯度,发酵温度30 ℃,发酵时间24 h;考察发酵时间的影响时,将发酵时间设为12 h,24 h,36 h,48 h,60 h共5个梯度,发酵温度 30 ℃,接种量7%.
1.3.7.2 正交试验
结合单因素试验结果,选取合理的水平,根据参考文献[17-18]中的方法进行正交试验.
1.3.8 感官评价
将未经发酵处理(对照组)和经发酵处理(实验组)的再造烟叶浓缩液按照39%的涂布率涂布于再造烟叶片基上,于90 ℃条件下烘10 min,回潮至含12.5%水分,切丝卷烟,作为样品,由河南卷烟工业烟草薄片有限公司组织11名评吸专家进行评吸.
39%涂布率所需再造烟叶浓缩液的计算方法为先称取再造烟叶片基,由再造烟叶片基的质量推算出再造烟叶浓缩液的质量,公式如下.
再造烟叶浓缩液质量=再造烟叶片基质量×0.88×1.64+0.5
回潮加水质量=再造烟叶浓缩液质量×1.6
2 结果与讨论
2.1 增香菌的筛选与确认结果
从初烤后不同牌号的再造烟叶浓缩液中筛选到1株能增加再造烟叶浓缩液香气的增香菌菌株HS-1.经GC-MS检测分析后发现,该菌株使苯甲醇、苯乙醛、苯乙醇、β-二氢大马酮、β-大马酮的含量相比发酵前均有不同程度的增加.
2.2 增香菌株HS-1的鉴定结果
2.2.1 菌株HS-1的形态学特征
菌株HS-1的菌落形态如图1所示.由图1可知,菌株HS-1的菌落表面有光泽,边缘整齐.经革兰氏染色后,在显微镜(×100)下观察菌株HS-1的微观形态,结果如图2所示.由图2可知,菌体分布均匀,呈丝状,菌体大小为2 μm左右.
2.2.2 菌株HS-1的进化树分析
对菌株HS-1基因组DNA进行PCR扩增,得到1425 bp的核酸序列.在NCBI Genebank数据库中进行BLAST同源性分析,发现菌株HS-1扩增出的1425 bp核酸序列与Planococcus sp.的同源性为100%.
菌株HS-1与其相似菌株的16S rDNA区域序列系统进化树如图3所示.由图3可知,菌株HS-1与产蛋白霉菌(Planomicrobium sp.)聚为一类.结合形态学特征和进化树分析结果,初步鉴定菌株HS-1为产蛋白霉菌属.
2.3 增香菌株HS-1发酵条件的优化结果
2.3.1 单因素试验结果
2.3.1.1 发酵温度对再造烟叶浓缩液中性香味成分含量的影响
发酵温度对再造烟叶浓缩液中性香味成分含量的影响如图4所示.由图4可知,随发酵温度的升高,中性香味成分含量呈先增加后减少的趋势.这可能是因为随着发酵温度的上升,菌落生长代谢和繁殖的酶失去活性,以至于发酵周期缩短.因此,确定正交试验中发酵温度水平范围为28 ℃,30 ℃,32 ℃,34 ℃.
2.3.1.2 菌株HS-1接种量对再造烟叶浓缩液中性香味成分含量的影响
菌株HS-1接种量对再造烟叶浓缩液中性香味成分含量的影响如图5所示.由图5可知,随增香菌接种量的升高,中性香味成分含量呈先增加后减少的趋势.这可能是因为增香菌接种量超过一定值后达到饱和状态,中性香味成分含量不会因增香菌接种量增加再次明显增加.因此,确定正交试验中增香菌接种量水平范围为3%,5%,7%,9%.
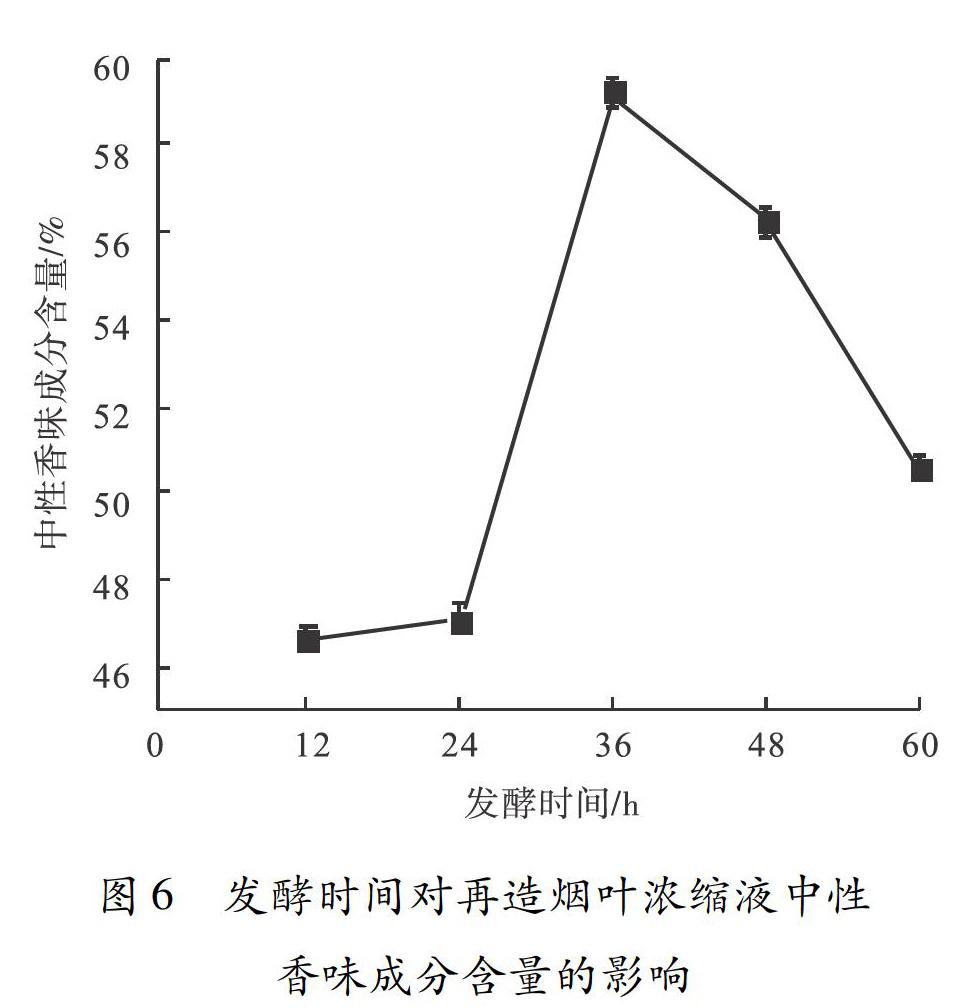
2.3.1.3 发酵时间对再造烟叶浓缩液中性香味成分含量的影响
发酵时间对再造烟叶浓缩液中性香味成分含量的影响如图6所示.由图6
2.3.2 正交试验结果
在单因素试验的基础上,选取发酵温度(A)、接种量(B)、发酵时间(C)为设计因素,以再造烟叶浓缩液的中性香味成分含量为指标进行L16(43)正交试验.正交试验因素水平见表1,正交试验设计与结果见表2,各因素方差分析见表3.
由表2可知,各因素对发酵后再造烟叶浓缩液中性香味成分含量影响大小的顺序为B>C>A,即接種量对中性香味成分含量的影响最大,发酵时间次之,发酵温度的影响最小.
再造烟叶浓缩液发酵的最佳条件是A2B2C3,即发酵温度为30 ℃,接种量为5%,发酵时间为36 h.
由表3可知,接种量对再造烟叶浓缩液中性香味成分含量影响显著,发酵温度、发酵时间对其影响均不显著.
2.3.3 验证试验结果与分析
为了验证正交试验结果的准确性,在最佳发酵条件下做了3次验证试验,对再造烟叶浓缩液在最佳条件下发酵前后的中性香味成分进行GC-MS分析,结果如表4所示.由表4可知,经菌株HS-1发酵后,再造烟叶浓缩液中性香味成分总含量为72.527%,明显高于正交试验中中性香味成分的总含量,其中,5-甲基糠醛和β-紫罗兰酮为发酵后所产生的化合物;苯甲醇、苯乙醛、2-乙酰基吡咯、苯乙醇、茄酮、β-大马酮、二氢猕猴桃内酯、巨豆三烯酮等成分均有不同程度增加,其中苯甲醇、苯乙醛、苯乙醇、β-二氢大马酮、β-大马酮的含量分别是发酵前的3.6倍、2倍、2.2倍、1.8倍和1.6倍.因此,在发酵温度为30 ℃,接种量为5%,发酵时间为36 h的条件下,对再造烟叶浓缩液进行发酵处理以提高中性香味成分的含量是可行的.
2.4 感官评吸结果
烟支感官舒适度各指标评吸结果见表5.由表5可知,将经增香菌适当发酵处理后的再造烟叶浓缩液涂布于再造烟叶片基上,可提高卷烟的香气质和香气量.
3 结论
本文从再造烟叶浓缩液中筛选到一株增香提高到72.527%.再造烟叶浓缩液经菌株HS-1发酵处理后,中性香味成分的种类和含量均有不同程度的增加,其中5-甲基糠醛和β-紫罗兰酮为发酵后新增成分,苯甲醇、苯乙醛、2-乙酰基吡咯、苯乙醇、茄酮、β-大马酮、二氢猕猴桃内酯、巨豆三烯酮等成分均有不同程度的增加.评吸结果表明,将经增香菌HS-1发酵处理后的再造烟叶浓缩液涂布于再造烟叶片基上,可提高卷烟的香气质和香气量.该研究获得的增香菌HS-1能够有效地改善再造烟叶的香气品质,其在再造烟叶增香领域具有较大的应用潜力.
参考文献:
[1] 吴宇航,李思东.造纸法烟草薄片的研究进展[J].广东化工,2012,39(5):90.
[2] 戴路,陶丰,袁凯龙,等.造纸法再造烟叶的研究进展[J].中国造纸学报,2013,28(1):65.
[3] 李丹,刘熙.生物技术应用于造纸法再造烟叶生产的研究进展[J].现代食品科技,2013,29(6):1463.
[4] 闫克玉.烟草化学[M].郑州:郑州大学出版社,2002.
[5] 韩文佳,赵传山.造纸法烟草薄片发展现状[J].黑龙江造纸,2007(4):47.
[6] 程昌合,吴继忠,廖付,等.浓缩液醇化处理对烟草薄片致香成分及感官质量的影响[J].安徽农学通报,2011,17(1):142.
[7] WANG W S,WANG Y,YANG L J ,et al.Studies on thermal behavior of reconstituted tobacco sheet[J].Thermochimica Acta,2005,437(1/2):7.
[8] LIU H G,HE H L,CHENG C H,et al.Diversity analysis of the bacterial community in tobacco waste extract during reconstituted tobacco process[J].Applied Microbiology and Biotechnology,2015,99(1):469.
[9] 周瑾,李雪梅,许传坤,等.利用微生物发酵改良烤烟碎片品质的研究[J].烟草科技,2002(6):3.
[10]郑勤安.造纸法再造烟叶生产过程中微生物增质剂的应用研究[J].浙江工业大学学报,2004,32(4):442.
[11]何汉平,贺世梁,蔡冰,等.造紙法烟草薄片萃取浓缩液酶法降解与增香[C]∥中国烟草学会.中国烟草学会工业专业委员会烟草化学学术研讨会论文集.海口:[出版者不详],2005:56.
[12]张晨,许赣荣,严新龙.利用酿酒酵母改进烟草萃取液的香气特性[J].食品工业科技,2012,33(20):137.
[13]贾蓓蕾,魏涛,黄申,等.α-胡萝卜素降解产香菌株的分离、鉴定及发酵条件优化[J].食品与发酵工业,2015,41(1):34.
[14]吴丽君,段佳,李春子,等.同时蒸馏萃取-气相色谱/质谱法分析烟草中挥发性成分[J].分析科学学报,2012,28(6):807.
[15]李炎强,冼可法.同时蒸馏萃取法与水蒸气蒸馏法分离分析烟草挥发性、半挥发性中性成分的比较[J].烟草科技,2000(2):18.
[16]许甜甜.苯酚降解菌的分离鉴定及苯酚降解的相关研究[D].上海:上海师范大学,2012.
[17]赖炜扬,林凯,鹿洪亮,等.再造烟叶正交优化提取及其化学成分和致香成分分析[J].厦门大学学报(自然科学版),2016,55(1):144.
[18]ZHU X L,SU Q D,CAI J B ,et al.Optimization of microwave-assisted solvent extraction for volatile organic acids in tobacco and its comparison with conventional extraction methods[J].Analytica Chimica Acta,2006,579(1):88.
