利福平缓解糖皮质激素诱导ONFH的早期软骨细胞凋亡的实验研究
2020-05-06谢冰勇陈紫璇刘扶摇
谢冰勇 陈紫璇 刘扶摇
[摘要] 目的 探讨糖皮质激素(Glucocorticoids,GC)对软骨细胞的影响及利福平对其的保护作用。 方法 从SD大鼠的膝关节分离关节软骨细胞进行细胞培养并用不同浓度的地塞米松(Dexamethasone,Dex)进行治疗,按照随机对照原则分为三组:NS(Con)组、Dex组和Dex+Rif组,测量软骨细胞中的活性氧(Reactive oxygen species,ROS)水平和甲状旁腺激素(Parathyroid hormone,PTH)/甲状旁腺激素相关肽受体(Parathyroid hormone-related peptide receptor,PTH1R)的表达。进一步通过Western blot检测研究软骨细胞中凋亡相关蛋白的表达水平。 结果 GC处理后,软骨下区出现空洞软骨异常,破骨细胞活性增强,同时通过GC处理后ROS水平和PTH1R表达增加。在Dex+Rif组中,利福平保护了免受Dex诱导的软骨细胞凋亡。 结论 ROS产生和PTH1R表达减少可使利福平减轻Dex处理软骨细胞的凋亡,软骨细胞的大量凋亡可能是早期ONFH的特征性标志。
[关键词] 利福平;糖皮质激素;股骨头坏死;软骨细胞
[Abstract] Objective To investigate impacts of glucocorticoids(GC) on chondrocytes and protection effects of rifampicin. Methods Chondrocytes were isolated from the knee joint of SD rats for cell culture and were administered by dexamethasone(Dex) at different concentrations. According to the principle of random control, the cells were randomly divided into three groups: The NS(Con) group, the Dex group and the Dex+Rif group. The level of reactive oxygen species(ROS) and expressions of parathyroid hormone(PTH)/ type 1 PTH-related peptide receptor (PTH1R) in chondrocytes were determined. Expressions of apoptosis-related proteins in chondrocytes were determined by western blot. Results After the treatment of GC, abnormally eroded cavities were formed in subchondral bone, accompanied by elevated osteoclast activity, as well as increased levels of ROS and PTH1R in chondrocytes. Rif protected chondrocytes against Dex-induced cell apoptosis in the Dex+Rif group. Conclusion Rif repressed Dex-induced chondrocyte apoptosis via ROS generation and PTH1R down-regulation. A high amount of chondrocyte apoptosis could be a typical picture of early osteonecrosis of the femoral head(ONFH).
[Key words] Rifampicin; Glucocorticoids; Osteonecrosis of the femoral head; Chondrocytes
股骨頭坏死(Osteonecrosis of the femeral head,ONFH)经常导致股骨头的进行性塌陷变形[1],而GC给药导致的激素性ONFH是非创伤性中最常见的危险因素,多发生于35~55岁的青壮年,男性多于女性[2]。软骨细胞的凋亡和坏死等异常情况通常被认为是ONFH的特征性标志之一。目前,ONFH的发病机制仍不清楚,是国内外骨坏死研究的热点[3]。在许多研究中已经报道了关于GC诱导软骨细胞的凋亡和坏死等异常情况对ONFH的影响[14]。Liu LH等[4]通过在GC诱导的ONFH中,发现在症状出现之前,可以诊断软骨坏死,尤其是通过磁共振成像(MRI),但在早期阶段仍没有令人满意的治疗ONFH的方法。如果早期阶段的变化得到明确说明,治疗方法及效果将会更好。由于GC诱导的生长迟缓与软骨细胞的凋亡增加有关[5],本研究在ROS水平和PTH/PTH1R与细胞凋亡有关的基础上,假设GC诱导的细胞凋亡与ROS水平升高和PTH1R表达有关,通过体外研究软骨细胞,现报道如下。
1 资料与方法
1.1 试剂和材料
SD大鼠18只、不同浓度Dex(10-7~10-4 M)利福平、10%胎牛血清(FBS)、抗生素DMEM/F12;培养基5×103细胞/孔、CCK-8(Dojindo Laboratory,Kumamoto,Japan)、PI/Hoechst混合物(Beyotime生物技术研究所,中国江苏)、10 μmol/L DCFH-DA、兔抗鼠Caspase-3抗体、PTH1R抗体、羊抗兔荧光抗体、DAPI;SDS-PAGE(10%聚丙烯酰胺凝胶)。
1.2 关节软骨细胞培养和处理
18只雄性SD大鼠(3月龄,200~250 g)随机分成3组,NS(Con)组6只,Dex组6只,Dex+Rif组6只。通过培养SD大鼠股骨头软骨细胞,取股骨头软骨。该程序经徐州医科大学动物实验伦理委员会[SYXK(jiangsu)2016-0028]批准。根据夏韶襁等[6]所用的方法从大鼠的膝关节分离关节软骨细胞进行细胞培养和治疗。将软骨细胞在补充有10%FBS和抗生素DMEM/F12的培养基中培养。在该研究中,原代细胞维持在单层培养中,当细胞达到汇合后,将不同浓度的Dex加入含有或不含利福平的培养基中,每个实验至少重复3次。
1.3 细胞活力测定
将ROS水平以5×103细胞/孔的密度接种细胞并使其粘附过夜,第二天加入Dex,范围10-7~10-4 M。通过CCK-8在24 h、48 h和72 h测量活细胞量。根据说明书要求,将PI/Hoechst混合物添加到培养板中用于细胞凋亡检测。使用DCFH-DA探针测定细胞内ROS水平。将细胞置于含有或不含有利福平(0.5 μg/mL)的Dex中暴露72 h。暴露后,向培养物中加入10 μmol/L DCFH-DA,然后在黑暗中孵育30 min。用488 nm的激发波长和525 nm的发射波长测量荧光强度。
将细胞接种在盖玻片上并在Dex组和Dex+Rif组的Dex中培养72 h并进行免疫荧光分析,然后固定细胞并封闭表位,将兔抗鼠Caspase-3或PTH1R抗体加入细胞中并在4℃温育过夜。然后,加入羊抗兔荧光抗体和DAPI,并在室温下温育1 h。通过显微镜(ZEISS,AXIO)观察样品。
1.4 提取细胞中蛋白质样品蛋白质印迹分析
通过SDS-PAGE(10%聚丙烯酰胺凝胶)分级分离50~100 μg蛋白质样品和western blot[7]使用以下一抗:Caspase-3(1:1000)、Bcl-2(1:1000)、P62(1:1000)、Beclin-1(1:1000)、LC3(1:1000)、PTH1R(1:100)和β-肌动蛋白(1:1000)。
1.5 统计学方法
采用SPSS22.0统计学软件进行分析,全部数据以均数±标准差(x±s)表示,采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 GC诱导慢性细胞凋亡、ROS水平及PTH1R表达的变化
研究caspase-3和Bcl-2的表达以评估GC诱导的细胞凋亡。这与软骨细胞的体细胞腔一致,同时在这些细胞周围检测到caspase-3的表达,而Bcl-2的表达在Dex+Rif组中最低,几乎不能检测到(封三图3)。另外,数据显示,Dex增加了ROS活性水平,利福平逆转了这种效应,而在PTH1R的表达中发现了类似的效果(封三图4)。
2.2 Dex处理对软骨细胞的抑制作用和细胞凋亡诱导作用
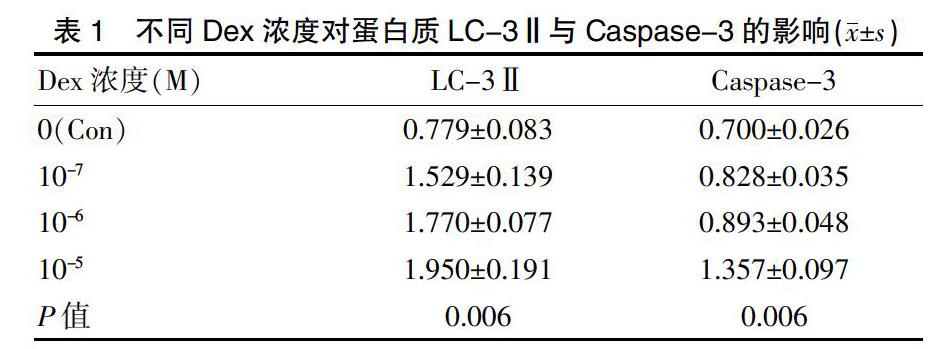
测试一系列Dex浓度以确定软骨细胞的活力。在48 h处理后,细胞的存活率在浓度10-4 M的Dex时显著降低。但是在浓度10-5 M的Dex处理下,在72 h后观察到显著的活力降低,并观察到细胞形态变化(封三图5-A)。此外,在一系列Dex浓度下研究了细胞凋亡和自噬标志。蛋白质印迹分析表明,将蛋白质LC-3Ⅱ在85.7%的水平(封三图5-C)和Caspase-3在70.6%的水平(封三图5-D),相对于β-Actin条带密度进行标准化后,发现浓度在0 M到10-5 M Dex时caspase-3、LC3-Ⅱ和Beclin-1蛋白水平以剂量依赖性方式显著增加(P=0.006),其中LC-3Ⅱ增加约2.2倍,Caspase-3增加约1.8倍(表1),但Bcl-2的表达相反(封三图5-B)。
2.3 利福平逆转GC诱导的软骨细胞凋亡、PTH1R表达的变化
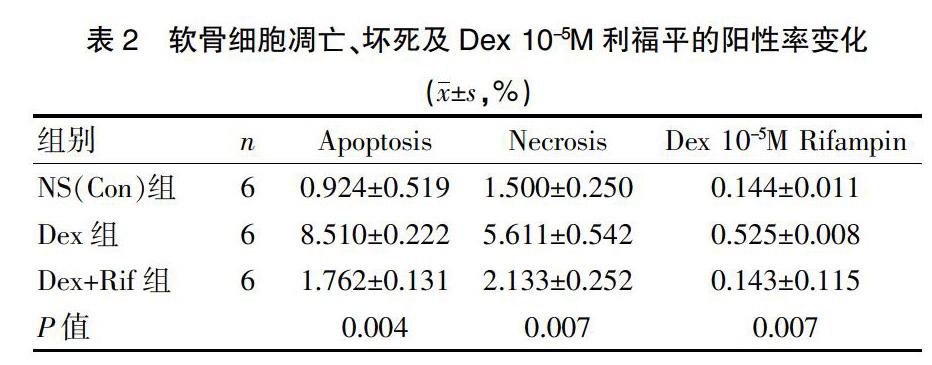
通过研究利福平对Dex诱导的软骨细胞凋亡的影响,将NS(Con)组、Dex组与Dex+Rif组一起培养3 d。如封三图6-A所示,NS(Con)组和Dex+Rif组软骨细胞凋亡率和坏死率均低于Dex组软骨细胞(P=0.007),通过利福平培养时这些比率显著下降(P=0.004),进一步说明利福平逆转了GC诱导的软骨细胞凋亡。同时,caspase-3的表达和蛋白质印迹分析进一步证实了这种效果(封三图6-B)。在细胞凋亡和坏死的进程中(封三图6-C),NS(Con)组的软骨细胞凋亡率为0.89%,坏死率为1.75%;Dex+Rif组的软骨细胞凋亡率为1.74%,坏死率为2.10%;而Dex组的软骨细胞凋亡率高到8.32%,坏死率高达5.00%,其是Dex+Rif组软骨细胞凋亡率的4.78倍,壞死率也达2.4%。同时,在10-5 M Dex的处理下(封三图6-D),Dex组阳性软骨细胞率均达到NS(Con)组和Dex+ Rif组的5倍之多(表2)。可见利福平有效地干预并降低了糖皮质激素Dex诱导的ONFH。另外,通过研究PTH1R对软骨细胞表达的影响发现,72 h后,在Dex组中,Dex增加了PTH1R的表达,而在Dex+Rif组中利福平明显降低软骨细胞中PTH1R的表达。蛋白印迹数据分析进一步证实了这种作用(封三图7)。
3 讨论
据报道,Dex处理可增加成骨及软骨细胞的凋亡[5]。而除骨细胞、成骨细胞和骨髓细胞外,GC诱导的ONFH也倾向于发生软骨细胞凋亡[8],类似的现象在本研究的股骨头软骨细胞中得到证实。本研究通过GC治疗SD大鼠的股骨头坏死,没有明显检测到空的骨细胞腔,但发现软骨下区域的软骨空缺和生长板的破坏比正常明显,这不仅可以解释为骨转换正常,这些变化更可能是由于生长板的修复过程造成的。Iwaniak P等[9]发现,GC处理后发生生长迟缓的特征在于软骨细胞的增殖减少及加速胶原纤维的成熟。同时,本研究也发现PTH1R的表达与caspase-3的表达一致。Dex+Rif组中尤其是软骨细胞周围的caspase-3表达增加,而Bcl-2的表达则明显降低。此外,PTH/PTH1R之间的相互作用平衡对于软骨细胞分化的速度至关重要。支持PTH/PTH1R在延迟生长板发育中的作用,可能是通过激活cAMP依赖性信号级联反应[10]。另外,Maycas M等[11]报道通过不依赖PTH和依赖性机制的PTH1R激活,使得在软骨细胞中的机械刺激存活作用中具有重要作用,其受到了PTH治疗的同源下调控制,但不受无关的激动剂如胰岛素样控制生长因子(IGF)-I[12]控制。Dex还在成骨细胞样细胞和间充质干细胞中上调PTH1R[13],这与Dex诱导的ROS应激和caspase-3活化与软骨细胞中PTH1R的上调一致。基于以上数据,可以假设GC诱导的软骨空腔隙破坏以及Bcl-2下调和软骨细胞的凋亡,可以通过增加PTH1R的表达来介导。另外,评估ROS水平,发现GC诱导的ROS应激可能启动细胞凋亡。
另外,Dex10-7~10-4 M的浓度下进行测试发现细胞毒性对软骨细胞的影响非常高,特别是在10-5 M Dex和10-4 M Dex。评估ROS水平,发现GC诱导的ROS应激可能启动细胞凋亡,这与在Dex+Rif组中,利福平逆转Dex诱导的软骨细胞凋亡和ROS水平及PTH1R表达的增加类似,可见利福平显示出对GC诱导的凋亡的拮抗作用(封三图3),同时也观察到ROS水平降低。另外,在细胞自噬过程中,薛恩兴[14]通过实验表明,GC激活软骨细胞中的自噬,并同时诱导软骨细胞的衰老。细胞可能在代谢应激期间保持活力,自噬被认为是软骨细胞的自我保护机制[15]。本研究在软骨细胞中也发现了类似的结果。
最后,本研究也发现GC处理后软骨细胞凋亡与ROS水平和PTH1R的表达相关,而GC诱导增强的破骨细胞活性通常位于这些凋亡的软骨细胞周围。同时,GC可诱导ROS水平升高,PTH1R表达和软骨细胞凋亡发生以及周围破骨细胞活性增强。然而,随着PTH1R的上调和自我修复能力的增加,骨形成性增加,推测会发生软骨内骨化的恢复,特别是来自周围的软骨细胞或生长板。因此,随着细胞凋亡和骨溶解的增长,坏死区域最终发展形成。相反,硬化区的形成可能是由于PTH1R的上调和周围环境的自我修复能力。目前,国内关于利福平缓解糖皮质激素诱导ONFH的早期软骨细胞凋亡的报道较少,本研究具有一定的创新性。
总之,GC处理SD大鼠后发现软骨细胞异常凋亡,利福平减少了Dex诱导的细胞凋亡、ROS产生和PTH1R表达。鉴于缺血诱导和GC诱导的ONFH之间存在密切关系,因此,软骨细胞的大量凋亡可能被认为是ONFH早期的特征性标志,PTH1R的表达可能在骨坏死的发展中起重要作用。
[参考文献]
[1] 朱述英. 激素性股骨头坏死的发病机制研究现状[J]. 中国卫生产业,2016,13(31):186-188.
[2] 姜胜攀,谭一清,雷文峰,等. 基于磁共振成像股骨头坏死骨髓水肿的流行病学相关性研究[J]. 实用医学影像杂志,2016,17(3):212-214.
[3] 马剑雄,何伟伟,赵杰,等. 股骨头坏死发病机制研究的最新进展[J]. 中国组织工程研究,2017,21(27):4397-4402.
[4] Liu LH,Zhang QY,Sun W,et al. Corticosteroid-induced osteonecrosis of the femoral head:Detection,diagnosis,and treatment in earlier stages[J]. Chin Med J(Engl),2017, 130(21):2601-2607.
[5] 伍龙果,蔡劲薇,潘吉铭,等. 地塞米松通过线粒体途径诱导成骨细胞凋亡的研究[J]. 中国骨质疏松杂志,2019,25(3):380-384,403.
[6] 夏韶襁,王俊文,程文俊,等. 藁本内酯对白细胞介素-1β诱导大鼠软骨细胞凋亡的保护作用及其机制[J]. 中华实验外科杂志,2019,36(9):1630-1633.
[7] Zhu L,Chen J,Zhang J,et al. Parathyroid hormone(PTH)induces autophagy to protect osteocyte cell survival from dexamethasone damage[J]. Med Sci Monit,2017,23:4034-4040.
[8] Wang XY,Hua BX,Jiang C,et al. Serum biomarkers related to glucocorticoid-induced osteonecrosis of the femoral head:A prospective nested case-control study[J]. J Orthop Res,2019,37(11):2348-2357.
[9] Iwaniak P,Dobrowolski P,Tomaszewska E,et al. The influence of dexamethasone administered prenatally on cartilage of newborn spiny mouse(Acomys cahirinus)offspring[J]. Journal of Developmental Origins of Health and Disease.,2016,7(3):298-305.
[10] Ho PWM,Chan AS,Pavlos NJ,et al. Brief exposure to full length parathyroid hormone-related protein(PTHrP)causes persistent generation of cyclic AMP through an endocytosis-dependent mechanism[J]. Biochem Pharmacol,2019,169:113627.
[11] Maycas M,Ardura JA,de Castro LF,et al. Role of the parathyroid hormone type 1 receptor(PTH1R)as a mech-anosensor in osteocyte survival[J]. J Bone Miner Res,2015,30(7):1231-1244.
[12] Esen E,Lee SY,Wice BM,et al. PTH promotes bone anabolism by stimulating aerobic glycolysis via IGF signaling[J]. J Bone Miner Res,2015,30(11):1959-1968.
[13] Wu F,Jiao J,Liu F,et al. Hypermethylation of Frizzled1 is associated with Wnt/β-catenin signaling inactivation in mesenchymal stem cells of patients with steroid-associated osteonecrosis[J]. Exp Mol Med,2019,51(2):23.
[14] 薛恩興. 地塞米松激活自噬对软骨细胞衰老影响的研究[D]. 广东:南方医科大学,2016.
[15] López de Figueroa P,Lotz MK,Blanco FJ,et al. Autophagy activation and protection from mitochondrial dysfunction in human chondrocytes[J]. Arthritis Rheumatol,2015,67(4):966-976.
(收稿日期:2019-11-15)
