啮齿类动物插管技术用于药动学采血的研究进展
2020-05-06杜飞飞王凤清贾伟伟徐方马越鸣
杜飞飞,王凤清,贾伟伟,徐方,马越鸣
(1. 上海中医药大学中药学院,上海 201203; 2. 中国科学院上海药物研究所,上海 201203)
近几十年来,跨越国界的科学合作和服务呈现不断增长的趋势,给全球范围的研究合作方提出要求,即以动物福利为核心,在全球范围内整合协调实验动物的使用标准和规范,被业界广泛接受的“3R原则”便是其中的核心内容。“3R原则”由Russell和Burch于1959年提出,即替代(replacement)、减少(reduction)和优化(refinement),简言之即通过使用无知觉物质替代有知觉动物、尽量减少实验动物数量及尽量减低非人道方法的使用频率或危害程度,旨在鼓励和提倡从多角度多层面保护实验动物的福利[1-2]。世界动物卫生组织(OIE)、国际医学科学组织(CIOMS)和国际实验动物科学理事会(ICLAS)均发布了国际指导原则[3-4],将“3R原则”作为核心标准和准则。美国食品药品监督管理局(FDA)和欧盟强力推荐在有AAALAC认证的实验室开展动物实验,该认证采用了包括“OIE标准”在内的4个全球评估标准[5-7]作为参考来源。
我国于1988年经国务院批准由国家科学技术委员会发布了《实验动物管理条例》[8],以加强实验动物的管理工作,并于2001年的修订中加入了有关动物福利的内容。2006年由科技部颁布的《关于善待实验动物的指导性意见》[9]则是我国首个针对研究用动物的国家法规,进一步细化了善待实验动物的规定。2018年2月由国家正式颁布并于9月1日实施的《实验动物福利伦理审查指南》(GB/T 35892-2018)则是我国实验动物福利伦理科技和管理领域的里程碑事件。该指南由实验动物福利伦理专业委员会起草,是中国首部实验动物福利伦理审查国家标准,在国际上获得了积极的反响和赞誉[10-11]。
药物代谢动力学研究中包含必不可少的动物实验,在啮齿类动物(如大鼠和小鼠)上采血则是其中常见的实验操作。如何在动物实验中贯彻动物福利及“3R原则”是本专业发展到一定阶段和水平需要思考和关注的问题。本文对国内外药动学研究中将啮齿类动物插管手术用于采血的技术进展进行综述,希望对国内药动学研究领域的实验动物福利保护有所助力。
1 药代动力学研究中传统的采血方法
药代动力学研究是药物发现过程中的一个重要组成部分。考虑到啮齿类动物体重较小而不需要花费大量的药物且较容易采集多个生物样本,通常选择大鼠或小鼠等啮齿类动物作为临床前药动学研究的主要实验对象[12]。
采集动物血样是药动学研究中最常见的操作之一,关于进行大小鼠采血的方法已有较多报道,包括从眼眶后静脉窦、侧尾静脉、舌下静脉、隐静脉及颌下静脉[13]。长期以来最常用的是眼眶后静脉窦穿刺采血,经验丰富的实验人员可以单次采集较大量的血液(0.2 ~ 0.5 mL)。然而该方法也引起较大争议,除了可能造成动物眼部组织损伤外,非麻醉状态下采血引起的动物疼痛、挣扎及应激也不利于实验动物福利[14-15],因此部分监管机构已经禁止了该方法,除非该采血过程是动物处于麻醉状态下的临终前步骤[16]。侧尾静脉切开是另一种在过去被频繁使用的方法,优点是不需要麻醉且手术刀沿着血管侧切造成的创伤小,但这种方法也有较多缺点,如采血量较少(0.1 ~ 0.15 mL)、在深色小鼠上较难操作、经常需要对尾部进行预热以确保血管扩张获得足够的血量以及采集单个血点耗时较长,同样非麻醉下操作会给动物带来疼痛及应激。舌下静脉采血的优势是采血量大而组织损伤较少,但操作相对复杂,需要约束动物、更多的练习和多人配合工作,并且有报道采血部位会出现红肿[17]。隐静脉穿刺较为耗时,无法满足在短时间内取血的要求。颌下静脉采血虽然耗时少取血量较大,但需要约束动物自由并且造成较多组织损伤[13]。
以上采血方式在涉及动物福利方面都有缺陷,会造成实验动物的“紧张”,即刺激引起实验动物出现生理、心理状态和行为的变化。实验过程中的温度变化、笼具移动、过度噪音以及约束自由都可能是潜在的刺激源[17],如采血时捉持动物造成的紧张会改变胃排空时间、加快心率以及改变代谢,均会影响药代动力学研究结果的准确性。实验动物面对刺激时产生反应的个体差异更是药动学研究中的一个不可控因素[12]。
2 运用于药动学采血的插管技术
自上世纪八十年代起,针对大小鼠不同部位血管的插管手术技术相继被开发,最为常见的插管部位包括颈动静脉、股动静脉及腹主动脉等。这些手术模型具备一个显著优点,就是在进行采血过程中,实验动物保持清醒并可以自由活动,从而使它们受到的干扰或刺激降到最小[18-21],如Yoburn等[22]发现大鼠股动脉插管可以增加插管的通畅度,相比其他部位插管手术,动物恢复到术前体重的速度最快。许多研究者都公开了插管手术的具体方法和流程[23-26],有使用留置型插管以便多次连续的血样采集[18-21,23,27-29],也有研究者将血管插管引出并固定在实验动物体外,实验动物在采集血样过程中无需麻醉、可自由活动且没有创伤,显然满足可重复采血且较少限制自由的要求[18,30]。研究表明,与徒手捉持大鼠(30 s)和限制自由的绑定大鼠(5 min)相比,自由活动大鼠(颈静脉插管)血浆内肾上腺素、去甲肾上腺素和多巴胺的基础浓度更低[31]。大鼠血浆中皮质酮水平同样会在其被限制自由时升高,而经历颈静脉插管手术后逐渐恢复稳定[32]。
Jespersen等[33]用视频及插图的形式展示了大鼠股动脉及股静脉插管的过程。研究者将插管尾端连接到可旋转系统上,术后单笼饲养大鼠可以减少动物间相互干扰,提高动物模型的稳定性。为了保持插管的通畅,需要使用100 U/mL肝素化生理盐水作为封管液并对其进行日常保养。研究者认为通过精细的无菌手术过程、合适的手术插管材料和精心保养,是极有可能在较长时间(几周)里保持大鼠健康状态,长时间的采集血样也就更有保证。Feng等[34]以视频方式发表了大鼠颈动脉和颈静脉插管手术流程,可用于监测血压、输液和给药及连续采集血样。Tsai等[35]则设计了一种高效且成本低廉的大鼠颈静脉插管装置,术后大鼠可多只饲养,与单笼饲养大鼠相比,具有更好的活力和更多的日均体重增长。Ghali发表了用于大鼠股动脉及股静脉插管的微创手术过程[36]。
Bardelmeijer等[37]开发并验证了一种能在自由活动小鼠上连续采集血样的方法。研究者将插管前端经颈静脉直达右心房,尾端经皮下穿刺牵引至小鼠颈后部穿出,用丝线缝合固定在皮肤上,插管体外部分用带有金属弹簧的PVC套管保护。单个时间点可采集250 μL血样并且小鼠受到的外部干扰很小。对6只颈静脉插管小鼠静脉注射10 mg/kg抗肿瘤药物多西他赛后,将测得的血浆浓度-时间曲线与同样剂量的50只非插管小鼠经心脏穿刺取血后所测的结果进行比较,两者无显著差异,证明该方法在多西他赛的药动学研究中可以有效替代传统采血方法,大幅减少小鼠数量。
国内研究者不断学习国外先进技术,摸索和建立符合自身条件的动物实验技术和方法。包伦等[38]建立了在大鼠股动脉和股静脉插管的模型,并应用于促红细胞生成素和白细胞介素6的药动学研究,结果证明注射简单准确,采血方便可控,大鼠自由清醒。研究者详细介绍了手术的流程、大鼠术后的维护以及保证实验顺利的重要因素,值得国内同行学习借鉴。王晶晶等[39]为解决药代动力学实验中反复静脉给药和取血的操作问题,建立大鼠颈静脉插管方法。此法简便易行、对动物损伤小且大大提高实验人员的取血效率。代恒等[40]利用临床常见的硬膜外麻醉导管和输液器部件制作简便实用的大鼠颈动脉插管,通过改进皮下留置导管和改变抓取大鼠的用力方式,有效避免操作不当导致的插管模型失败。史宏博等[41]借鉴前人的经验,在不同种系小鼠上成功建立经显微外科手术进行股动脉和股静脉插管的模型,可在小鼠清醒和自由活动状态下进行给药、采血和血压等体征的监测。该文详细介绍了手术流程并附图说明以供同行借鉴。窦全林等[42]则利用自制的动脉插管建立了小鼠颈动脉插管模型,具有操作简便、创伤小、动物存活率高、插管稳定性强和术后不易感染的优点。文科等[43]建立的大鼠股动脉插管手术模型,则通过连接三通阀实现连续采血同时监控血压。宋文煜等[44]发现小鼠右侧颈横静脉与肩胛上静脉汇入点之间为最佳插管前端位置,可大幅度提高小鼠术后存活率和导管通畅率。
3 药动学采血技术的应用
研究者将建立并优化的插管技术,运用到各自药代研究中,在保护动物福利的同时获取更准确合理的实验结果。
(1)Baumann和Huestis的研究团队[45-46]开展MDMA(常见滥用药,俗称摇头丸,对人类具有神经毒性)在大鼠体内的药动学研究。大鼠经皮下注射不同剂量 MDMA,颈静脉插管采集血样中MDMA及其代谢物MDA的浓度与剂量呈非线性急剧增加,存在蓄积的可能,该结果与人体药动学数据相似,可在合适的临床剂量使用时作为参考。
(2)Xie等[47]研究了大鼠单次静脉注射放射性标记的二氢青蒿素(DHA)后的药代动力学、组织分布、消除和质量平衡。大鼠经颈静脉插管后接入自动采血仪。结果显示大鼠脑中[14C]总浓度是血浆中的2倍,表明放射性物质可以轻易穿透血脑屏障。红细胞放射活性分布比血浆中高3 ~ 4倍,表明DHA在治疗血液期疟疾的强大效果可能与此相关。
(3)Minocha等[48]研究Sutherlandia(SLD,一种非洲草药补充剂,南非卫生部推荐用于治疗艾滋病)在颈静脉插管大鼠体内短期和长期的暴露对抗逆转录病毒药物奈韦拉平(NVP)口服生物利用度和药动学研究的影响。短期同服SLD后NVP的药代动力学相关参数无显著差异,而长期同服后NVP的体内暴露则减少50%。体外诱导实验结果显示SLD能导致细胞色素氧化酶CYP3A4的mRNA表达水平和功能活性的升高。NVP与SLD长期合并使用时可能发生的潜在草药与药物相互作用,需要临床研究结果的进一步证实。
(4)Legette等[49]研究啤酒花中膳食类黄酮Xanthohumol(XN,具有抗氧化、抗菌抗炎、保护心血管和调节免疫系统的潜在作用)的药代动力学。颈静脉插管大鼠灌胃给药不同剂量XN,其在大鼠血中暴露与剂量有相关性,可用于预测稳态血浆浓度水平,并帮助确定临床研究用药方案。该研究团队还利用颈静脉插管技术开展了雌马酚(Equol)的代谢研究,雌马酚是大豆异黄酮苷元经小肠细菌作用产生的代谢物,对减轻更年期骨质流失有潜在的治疗效果。结果发现雌马酚在卵巢切除模型大鼠体内以葡萄糖醛酸结合物的形式为主(>90%)[50]。
(5)Gong等[51]在普通大鼠和易激肠合并症模型大鼠上比较口服给药黄连提取物后小檗碱和巴马汀的药动学。检测颈静脉插管采集血样中小檗碱和巴马汀的浓度后发现,二者在模型大鼠体内的暴露明显高于普通大鼠,均出现双峰现象,可能与模型大鼠的肠功能异常有关。
(6)Shaik等[52]开展评价17-hydroxyprogesterone(17-OHPC,预防早产)替代制剂的使用和替代给药途径的可行性。分别对颈静脉插管的雌性大鼠静注、肌注及灌胃自配溶液或肌注市售油剂。结果显示,静注或肌注自配溶液后,17-OHPC的平均半衰期约为11 h,后者生物利用度接近100%,而灌胃后的生物利用度不到3%。肌注市售油剂后17-OHPC体内浓度虽相对较低,但持续时间较长,生物利用度接近100%,这跟油剂在给药部位缓慢但持续的吸收有关。该结果侧面证实了目前有早产史妇女预防早产的唯一治疗选择是每周肌注一次市售油剂。
(7)Lee等[53]通过使用颈静脉插管大鼠验证了化合物IDP-73152(韩国已批准临床用于治疗革兰氏阳性菌引起的感染)的定量检测方法,证明其可满足非临床药代研究的需要。
(8)Linnik等[54]用颈静脉插管大鼠评估有无同位素标记烟酰胺的大鼠药动学差异,结果显示两者在临床剂量范围内无显著差异,为临床使用同位素标记烟酰胺作为MRI试剂提供数据支持。
以上药代研究均采用了大鼠颈静脉插管技术,这也是专业领域内接受度最广的技术方式,但也有研究者采用其他部位插管技术以满足自身科研需要。例如Kielbasa和Fung[55]研究吸入性亚硝酸异丁酯(ISBN,挥发性有机亚硝酸盐,治疗心血管疾病,易于引起药物滥用)在大鼠体内的浓度-药效关系,同时监测血压和心率。大鼠持续1 h吸入浓度范围在20 ~ 1200 ppm的ISBN,股动脉插管采集血中的ISBN浓度在吸入期间达到相对稳态且与吸入浓度成线性相关。吸入结束后,血压和心率很快恢复,没有撤药后的反弹效应。该结果对于了解该挥发性药物的性质、治疗特点甚至减少药物滥用都有所帮助。
近年来,有研究者开始关注插管技术中的细节对实验动物的状态乃至药代研究结果造成的影响。Teilmann等[56]发现小鼠经颈动脉插管手术并接入自动采血仪器后会引起体内IL-6水平的增高,并且会引发心、肝、肾及唾液腺的炎症及器官损害。Gaud等[57]发现logP值大的化合物可能与插管材料存在非特异性吸附,其研究结果暗示静注给药和采血共用同一根大鼠颈静脉插管可能导致药动学研究结果的偏差,并建议可通过双插管解决问题。Luca等[58]证明枸橼酸钠溶液替代肝素钠溶液作为封管溶液时会有挥发现象,从而增加模型失败率。研究者通过使用硝化纤维素防腐涂层增强插管尾端的密闭性,极大提高了模型的稳定性。Chen等[59]比较了心内注射和灌胃给药8种化合物后,分别经大鼠颈动脉插管和尾静脉取血后测得药物浓度-时间曲线下面积(AUC),结果显示非酸性化合物的AUC差别较大,颈动脉插管取血后测得的AUC远高于尾静脉取血,且差异程度与该化合物的分布容积(VD)呈正相关。
4 小结
本人所在实验室经过多年摸索,建立起大鼠股动静脉插管技术平台,并成功运用于多个中药多成分药代课题的研究[60-65],结合本文文献内容及自身使用经验,现将大小鼠不同插管部位的特点进行简要比较和总结。
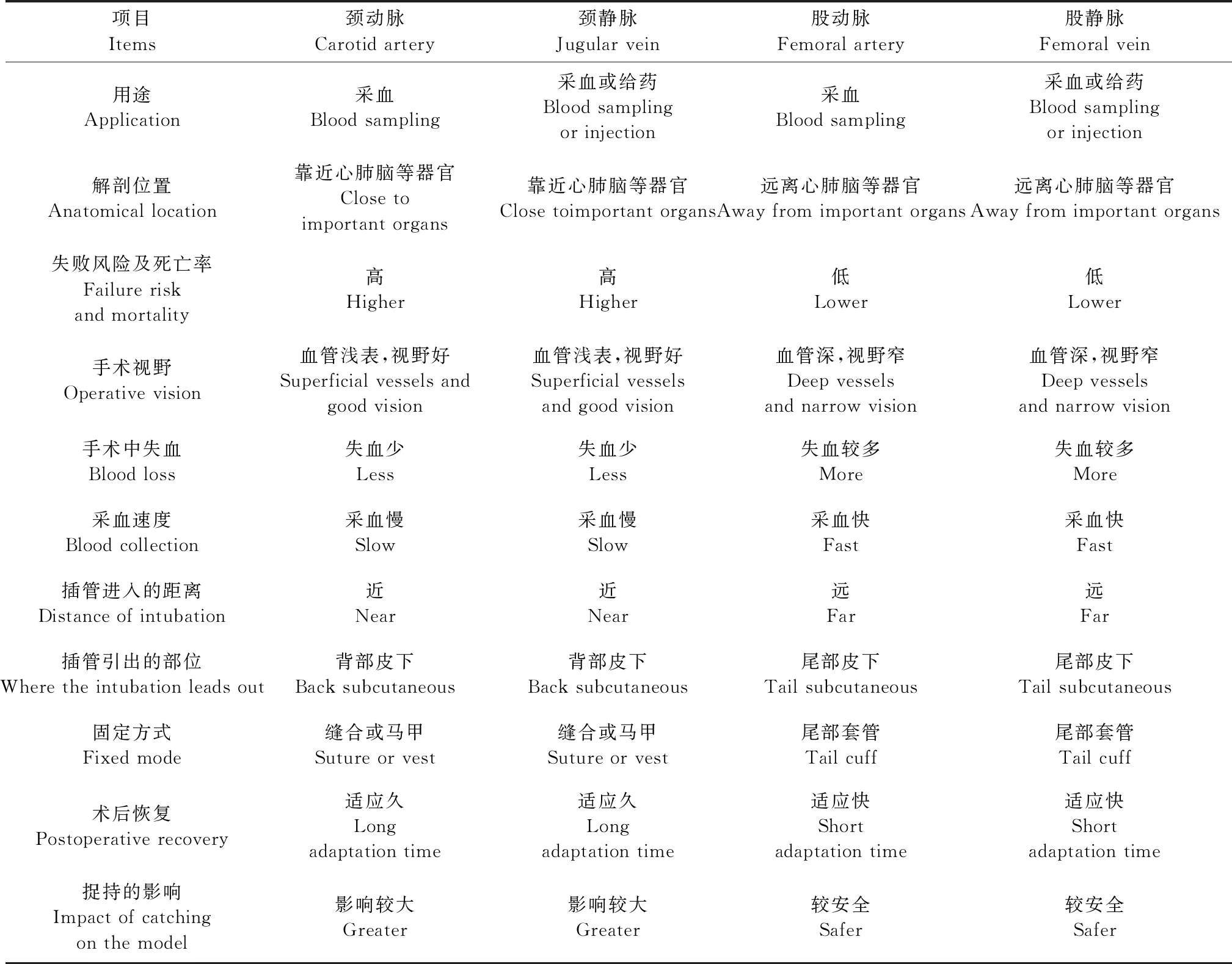
表1 不同插管部位的比较Table 1 Comparison of different intubation sites
由上表可知,两类插管方法的最主要区别是插管部位不同,从而形成各自不同的特点。股动静脉插管手术部位在腹股沟附近,远离心、肺和脑等重要组织器官,且血管相对较粗,采血速度也较快,初学者培训后较易上手及熟练掌握。但该处血管位置较深,分离组织多,手术视野较窄,穿刺时出血量较大,失血相对较多。导管前端推进体内较远距离可获得稳定的采血速度和血量。插管尾端可顺势经尾部皮下穿刺引出体外,再经特殊套管固定于尾部,大鼠适应时间短,恢复到术前状态较快。实验中捉持大鼠对插管部位的影响小,模型稳定性高。而颈动静脉插管手术部位在颈部两侧,存在影响心肺和脑部器官的风险,手术失败后实验动物的死亡率相对较高,且血管相对较细,采血速度适中。该处血管较浅表,无需分离太多组织即可暴露手术视野,穿刺时出血量不大。插管前端无需推进太远即可进入心脏以获得稳定的采血速度和血量。插管尾端经皮下至背部引出并缝合至皮肤或由“马甲”装置固定于背部,但大鼠需提前适应佩戴该装置,且术后恢复时间较长。实验中捉持大鼠,尤其是灌胃等操作可能对插管部位的造成影响,模型稳定性不如前者。
综合以上,两类插管手术各有其特点和使用范围,如能结合研究药物的药效作用部位、药理作用机制、给药方式特征以及实验技术人员的特长,选择最适合研究项目的插管技术和方法,也许会对药代课题研究进展起到更积极的推动作用。
