地鳖肽对CCl4诱导的慢性肝损伤小鼠的抗氧化保护作用的研究
2020-05-06刘丹曹硕刘阳刘杰王朕张永红沈红
刘丹,曹硕,刘阳,刘杰,王朕,张永红,2*,沈红,2*
(1. 北京农学院动物科学技术学院 动物类国家级实验教学示范中心,北京 102206;2. 北京农学院 兽医学(中医药)北京市重点实验室,北京 102206)
肝是机体重要代谢器官,对机体内去氧化、肝糖储存、分泌蛋白等起重要作用,其还担负机体解毒、消化等重要的生理功能[1-2]。肝损伤多是由体内产生自由基过多,过氧化导致,临床表现为食欲减退、体重减轻、腹胀等[3]。肝疾病是严重危害机体健康的疾病之一,其最常见致病因素如病毒、细菌、药物、酒精、缺血、肝部分切除等,造成肝细胞的一系列病变,及慢性肝损伤[4-5]。四氯化碳(CCl4)对动物肝具有强烈的毒性,引起肝组织脂质过氧化和炎症反应,导致肝细胞损伤和坏死,甚至肝纤维化,CCl4常用于建立动物慢性肝损伤模型[6]。中医药古籍记载地鳖(EupolyphagasinensisWalker,ESW)具有活血化瘀、通经活络、接骨续筋等功效[7]。现代技术分析地鳖有多种有效成分,主要有蛋白质、维生素、矿物元素、多糖、生物碱等[8]。研究表明,地鳖有效提取成分之一地鳖肽具有明显清除自由基,抗氧化和抗衰老等作用[9]。研究表明,采用酶解蛋白获得多肽及生物技术提取小分子肽清除自由基能力强[10]。本研究基于前期研究成果地鳖肽抗氧化作用,拟通过四氯化碳诱导小鼠建立慢性肝损伤模型,探讨地鳖肽对肝损伤小鼠的抗氧化保护作用及其机制,为其开发作为抗氧化剂提供试验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
6 ~ 8周龄健康昆明小鼠,体重20 ~ 22 g,清洁级,购于中国军事医学科学院实验动物中心【SCXK(京)2016-0002】。饲养和无菌手术均在北京农学院实验动物示范中心屏障动物实验设施进行【SYXK (京)2015-0004】,并按实验动物使用的3R原则给予人道的关怀。小鼠饲养期间自由饮水,饲喂由中国军事医学科学院实验动物中心提供的普通维持饲料,温度和湿度恒定,饲养符合实验动物要求。
1.1.2 试剂与仪器
谷草转氨酶(AST)、谷丙转氨酶(ALT)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)和丙二醛(MDA)试剂盒均购自南京建成生物有限公司,HiFi-MMLV cDNA Kit购自康为试剂生物科技有限公司,小鼠TNF-α、IL-6和iNOS ELISA试剂盒购自Elabscier公司,四氯化碳(CCl4)、地鳖肽ESW peptides由本实验室制备;所有引物由生工生物工程(上海)股份有限公司合成。
UV-3紫外可见分光光度(上海美普达有限公司),低温高速离心机(Eppendorf公司),超低温冰箱(日本SANYOO公司),NanoDrop2000核酸蛋白分析仪(Thermo Fisher Scientific),S1000 Theral Cycler梯度PCR仪(Bio-Rad),CFX Connect 荧光定量PCR检测系统。
1.2 方法
1.2.1 动物分组与处理
取小鼠随机分为正常组(Control group,C)、模型组(Model group,M)、阳性药组(Positive group,P)、地鳖肽(50 mg/kg、100 mg/kg、200 mg/kg)组。除正常组外其余所有小鼠腹腔注射0.1%CCl4花生油溶液10 mL/kg,每周2次连续6周;地鳖肽组小鼠分别灌服不同剂量地鳖肽,阳性药组小鼠灌服水飞蓟素100 mg/kg,模型组和正常组小鼠灌服生理盐水10 mL/kg,每天1次连续6周。
1.2.2 一般指标观察及脏器指数
肉眼观察小鼠的一般情况,每周称重并记录。末次给药24 h后,眼球采血,制备血清备用。颈椎脱臼处死小鼠,剖腹取肝脾称重,按公式计算脏器指数=脏器质量(mg)/体重(g)。
1.2.3 小鼠肝组织结构的观察
取小鼠肝右叶、用4%多聚甲醛溶液浸泡固定、制作肝组织切片、HE染色,光学显微镜下观察肝组织结构变化,拍照。
1.2.4 肝功能酶和指标抗氧化酶活性和MDA含量炎症因子蛋白水平检测
取待测血清,按照试剂盒说明测定肝功能酶(ALT、AST)活性;称取小鼠肝左叶0.2 g,生理盐水清洗,匀浆制备10%肝匀浆,按照试剂盒说明书操作测定抗氧化酶(SOD、CAT、GSH-PX)活性和MDA含量,炎症因子(IL-6、TNF-α、iNOS)含量。
1.2.5 肝组织炎症凋亡及纤维化因子基因表达的检测
采用TRIzon提取小鼠肝组织总RNA,逆转录合成cDNA,荧光定量PCR仪实时定量扩增,以GAPDH为内参,根据IL-6、TNF-α、iNOS、Bax、Bcl-2、Caspase-3、α-SMA、TGF-β1引物,Tm值进行分析,SDS软件分析数据,比较Ct值分析结果。
1.3 统计学分析
2 结果
2.1 小鼠一般情况及肝组织形态结构变化分析
整个试验过程中正常组小鼠生长状况良好;模型组小鼠随着CCl4灌服出现精神萎靡、食量减少、大便稀溏等现象;阳性药组和地鳖肽组小鼠状态较模型组明显有所改善,毛色有光泽。肉眼观察肝组织,结果正常组小鼠肝颜色呈红褐色,表面光滑,质地柔软;模型组小鼠肝颜色发黯,质地松软;阳性药物组和地鳖肽组与模型组比较小鼠肝损伤均有所减轻,高剂量地鳖肽组小鼠肝外观接近对照组(图1)。
显微镜观察正常组小鼠肝小叶结构正常,肝细胞排列整齐,中央静脉血管壁清晰可见;模型组小鼠肝组织肝细胞索排列紊乱、肿胀变性,中央静脉管腔内有淤血,炎性细胞浸润,纤维增生;地鳖肽组随着地鳖肽剂量增加小鼠肝细胞变性和坏死程度减轻,中高剂量组改善较为明显(图2)。模型组小鼠的肝脾指数均显著高于正常组,地鳖肽组和阳性药组小鼠肝脾指数均显著低于模型组(图3)。

注:C,正常组;M,模型组;P,阳性药物组。与正常对照组相比,**P< 0.01;与模型组相比,△P< 0.05,△△P< 0.01。(下图同)图3 地鳖肽对慢性肝损伤小鼠脏器指数的影响Note. C,Control group. M, Model group. P, Positive group. Compared with the control group,**P < 0.01. Compared with the model group,△P< 0.05,△△P< 0.01.(The same in the following figures)Figure 3 Effect of ESW peptides on organ index in mice with chronic liver injury
2.2 地鳖肽对CCl4慢性肝损伤小鼠肝功能的影响
模型组小鼠肝功能指标(ALT、AST)酶活力明显高于正常组,地鳖肽组和阳性药组ALT和AST酶活力较模型组显著下降(图4);模型组小鼠肝组织抗氧化酶(SOD、CAT、GSH-Px)活力比正常组显著降低,而过氧化物(MDA)含量显著升高,阳性药组和地鳖肽组抗氧化酶(SOD、CAT、GS H-Px)活力均显著高于模型组,地鳖肽组MDA 含量均显著降低(图5)。
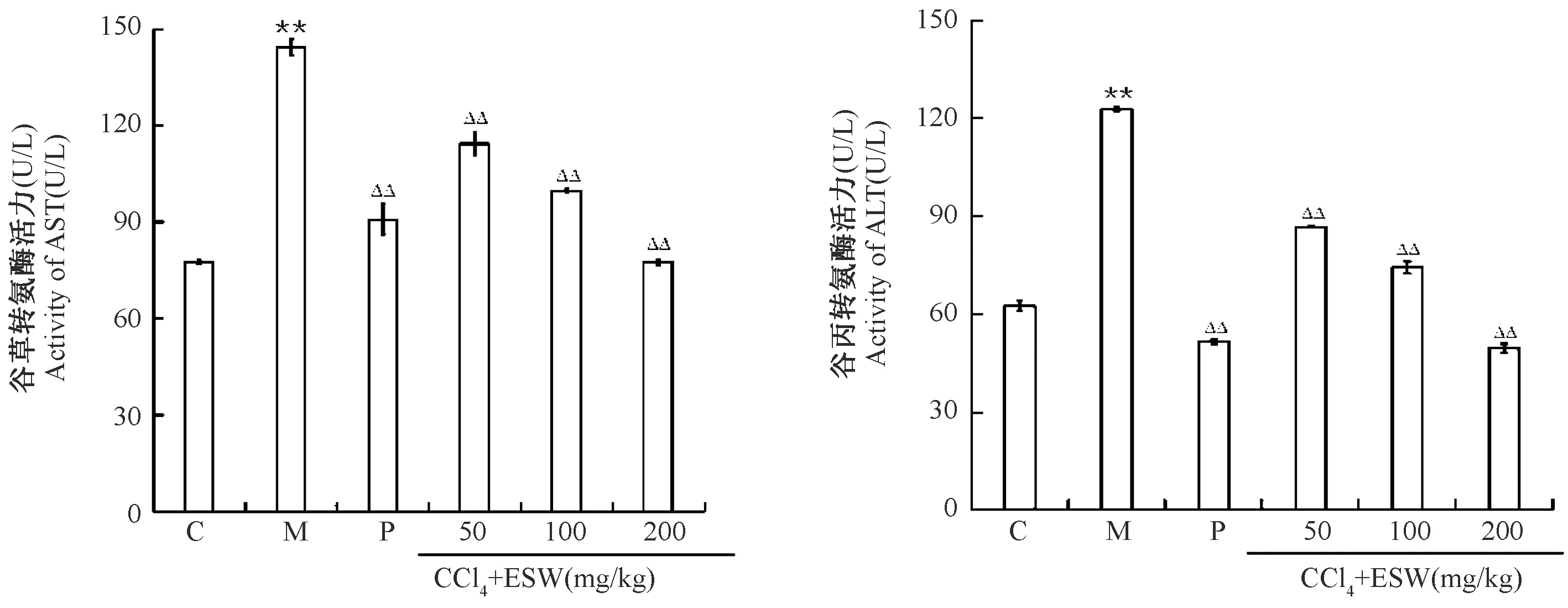
图4 地鳖肽对慢性肝损伤小鼠肝功能的影响Figure 4 Effects of ESW peptides on the liver function in mice with chronic liver injury

图5 地鳖肽对慢性肝损伤小鼠肝组织中抗氧化酶活力和MDA含量的影响Figure 5 Effects of ESW peptides on the activities of antioxidant enzymes and MDA content in liver tissue of mice with chronic liver injury
2.3 地鳖肽对慢性肝损伤小鼠肝组织中炎症因子蛋白及基因表达的影响
分析肝损伤小鼠肝组织中炎症细胞水平,结果模型组小鼠肝组织中炎症因子(TNF-α、IL-6、iNOS)蛋白表达量均显著高于正常组,地鳖肽组炎症因子蛋白水平均显著降低且低于模型组,接近阳性药组,表达水平与地鳖肽给药剂量呈正相关(图6)。采用荧光定量PCR分析小鼠肝组织中炎症因子基因表达,结果模型组炎症因子(IL-6、TNF-α、iNOS)基因表达量高于正常组,地鳖肽组和水飞蓟素药物组较模型组下降,中高剂量组下降极显著接近阳性药组(图7)。
2.4 地鳖肽对慢性肝损伤小鼠肝组织中凋亡及纤维化因子基因表达的影响
与正常组相比,模型组促凋亡因子(Bax、Caspase-3)mRNA水平均高显著升高,阳性药组和地鳖肽组均显著低于模型组降低,且与地鳖肽剂量呈正相关;与模型组相比较,阳性药组和地鳖肽组抑制凋亡因子Bcl-2表达量显著升高而促凋亡因子(Bax、Caspase-3)基因表达显著降低(图8)。与正常组相比,模型组纤维化因子(α-SMA、TGF-β1)mRNA表达均明显上调,阳性药组和地鳖肽组纤维化因子均显著低于模型组(图9)。

图6 地鳖肽对慢性肝损伤小鼠肝组织中炎症因子蛋白水平的影响Figure 6 Effects of ESW peptides on the levels of inflammatory factors in the liver tissues of mice with chronic liver injury
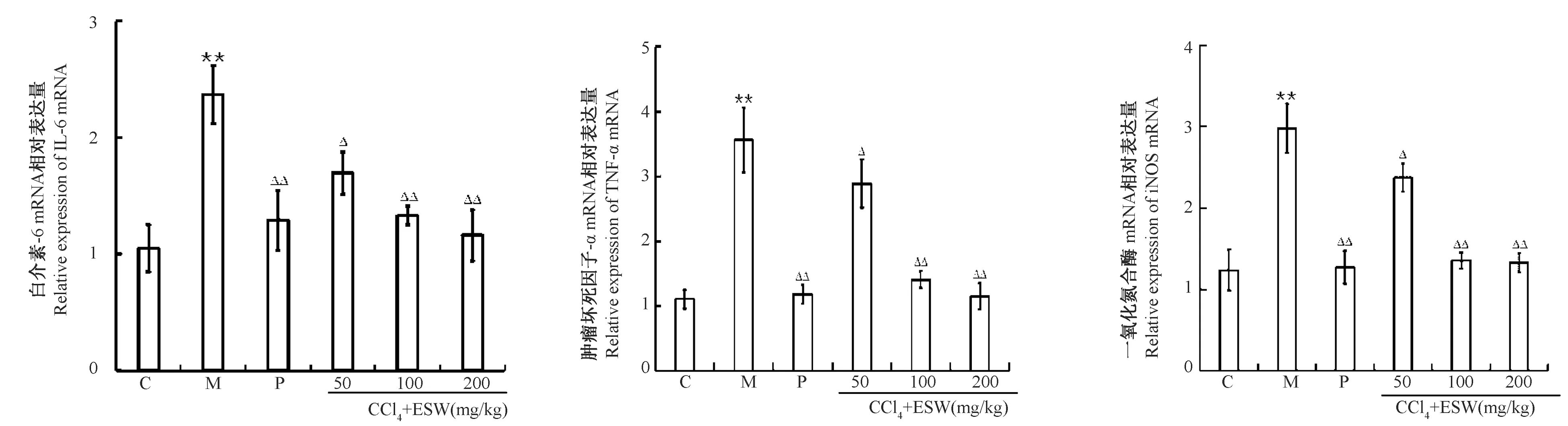
图7 地鳖肽对慢性肝损伤小鼠肝组织中炎症因子基因表达的影响Figure 7 Effects of ESW peptides on gene expressions of inflammatory factors in the liver tissues of mice with chronic liver injury

图8 地鳖肽对慢性肝损伤小鼠的肝组织中凋亡因子基因表达的影响Figure 8 Effects of ESW peptides on the gene expression of apoptotic factor in the liver tissues of mice with chronic liver injury
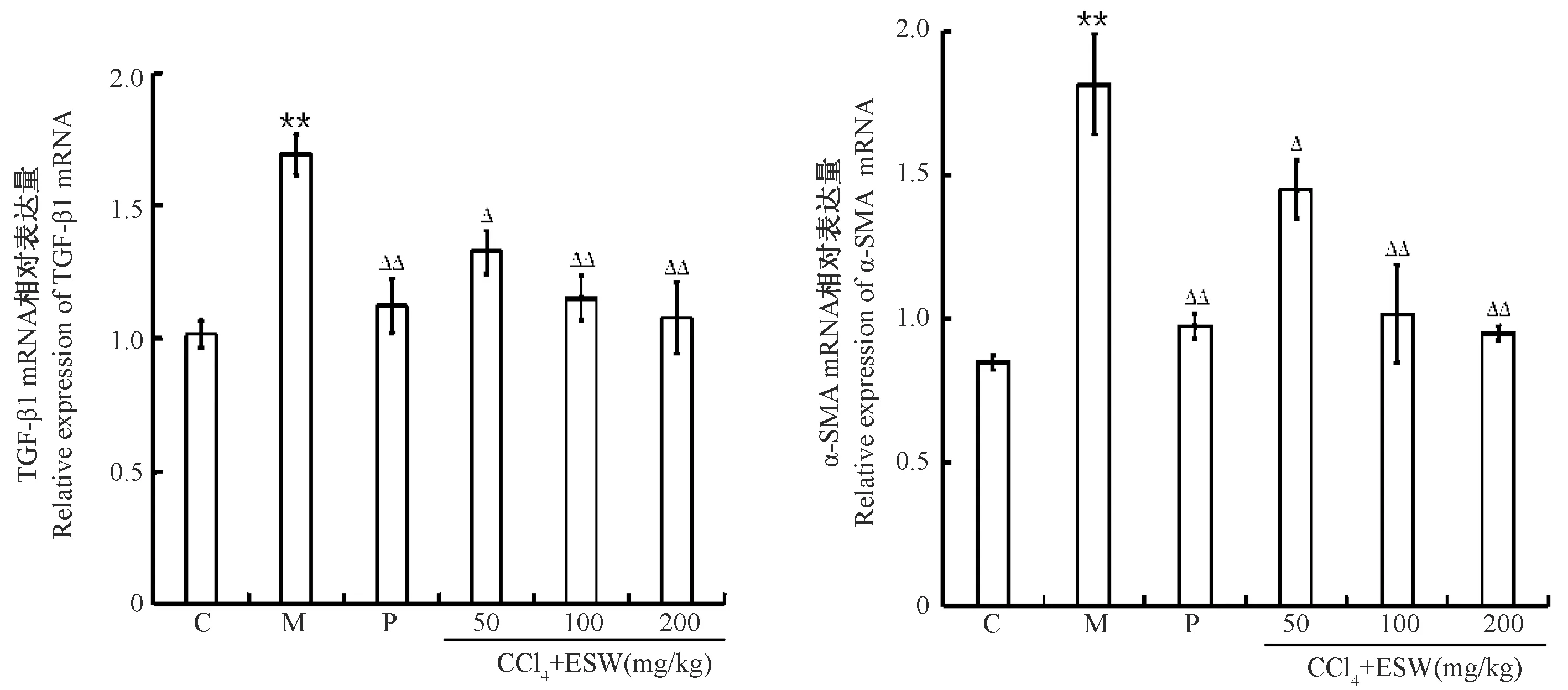
图9 地鳖肽对慢性肝损伤小鼠肝组织中纤维化因子基因表达的影响Figure 9 Effects of ESW peptides the gene expression of fibrosis factor in the liver tissues of mice with chronic liver injury
3 讨论
四氯化碳(CCl4)为肝毒性化学物,临床上人长期反复接触CCl4会有头晕、乏力、失眠、记忆力减退、食欲不振、恶心、腹泻和腹痛等,出现肝肿大和肝功能异常,严重发展成门脉性肝硬化,连续给予CCl4可使肝细胞变性、坏死、产生炎症反应,水飞蓟素为目前公认的抗肝损伤有效药物,动物实验常将该药作为肝损伤保护的阳性对照用药[11-12]。本研究显微镜观察肝组织结构,结果CCl4致小鼠肝组织肝细胞索排列紊乱、肿胀变性,中央静脉管腔内有淤血,炎性细胞浸润及纤维增生,随着地鳖肽剂量增加小鼠肝细胞变性和坏死程度减轻,结果与前人报道一致。CCl4进入机体后激活肝药酶P-450,促进机体生产过量自由基,引起脂质过氧化反应,使细胞膜结构功能遭到破坏,导致肝细胞中ALT、AST释放,使血中ALT、AST升高[13]。刘竹青等[14]用D-半乳糖建立致衰老小鼠模型,测定黄粉虫酶解物体内抗氧化能力,结果黄粉虫酶解物可显著提高小鼠血浆、肝中 CAT、GSH-Px、T-SOD活力,降低 MDA含量。刘雪姣[15]研究玉米低聚肽对四氯化碳所致小鼠急性肝损伤保护作用,结果玉米低聚肽能降低AST、ALT活力和MDA含量,在一定程度上提高SOD和GSH-Px活力等,达到预防四氯化碳所致小鼠急性肝损伤,且明显改善小鼠肝功能状况。李谚语等[16]研究保肝汤对四氯化碳(CCl4)致慢性化学性肝损伤的保护作用,结果保肝汤高、中、低剂量组ALT、AST水平降低,保肝汤中、低剂量组MDA含量显著降低。CCl4的毒性作用会造成肝组织局灶性的坏死,损伤肝细胞、肝窦内皮细胞,使其释放α-SMA、TGF-β1、TNF-α、IL-6等细胞因子引发炎性反应[17]。郭心怡[18]采用芍药苷干预四氯化碳诱导肝损伤,结果芍药苷明显降低四氯化碳诱导的炎性因子TNF-α、IL-6表达,肝组织α-SMA、TGF-β1蛋白和mRNA表达水平均显著下降。Wang等[19]研究球姜酮通过抑制氧化应激和炎症反应来保护小鼠四氯化碳(CCl4)诱导的小鼠急性肝损伤,结果球姜酮可以恢复SOD和GSH-Px的活性,减少MDA的产生,并减少促炎细胞因子IL-6和TNF-α的释放量。袁静等[20]探讨山丹黄参多糖对四氯化碳(CCl4)小鼠肝损伤的保护作用,结果药物组血浆ALT、AST、活性明显降低,肝组织SOD活力显著升高,MDA含量明显下降,Caspase-3及Bax蛋白阳性表达明显减少。本研究结果地鳖肽明显降低CCl4致慢性肝损伤小鼠血清中肝功能指标(ALT、AST),显著提高肝组织中抗氧化酶(SOD、CAT、GSH-Px)活性,明显抑制脂质过氧化反应产物(MDA)生成,降低肝细胞炎症因子(IL-6、TNF-α、iNOS)、促凋亡因子(Bax、Caspase-3)、纤维化因子(α-SMA、TGF-β1)产生,以上试验结果与有关研究报道基本一致。
综上所述,地鳖肽对CCl4导致的小鼠慢性肝损伤有一定的抗氧化保护作用,其保护作用机理可能是通过提高肝抗氧化酶活力,抑制脂质过氧化,降低炎症因子及凋亡因子生成,维持肝细胞结构完整性有关。
