外泌体介导miR-519c-5p增强脂多糖诱导的血管内皮细胞凋亡作用
2020-05-06黄发吕嘉贤许静红姚纪友童荔胡晓光朱艳平曹璐蔡常洁
黄发 吕嘉贤 许静红 姚纪友 童荔 胡晓光 朱艳平曹璐 蔡常洁
1中山大学附属第一医院(广州510080);2广东省器官捐献与移植免疫重点实验室,广东省器官移植科技合作基地(广州510080);3广州市第一人民医院(广州510000)
脓毒症是由感染导致的宿主反应失调的威胁生命器官功能障碍[1]。即使在重症监护室中得到及时的救治,脓毒症休克引起的病死率仍可达30%~44.3%[2]。目前,越来越多证据显示,脓毒症患者即使存活,后期仍会出现其他新发的临床症状,远期的致残效果[3]和逐渐恶化的慢性疾病[4]。
目前对于脓毒症的诊断,主要依靠临床表现,但特异性较低,相对滞后[1]。外泌体是一种发源于细胞内吞系统中的晚期内体,可由各种类型的细胞分泌,并形成多形性囊泡样小体,直径大多介于40 ~150 nm 之间[5-6]。研究发现外泌体中包含大量的蛋白质和RNA,后者包括mRNA、miRNA 和非编码RNA。这种纳米级被膜结构能够参与细胞间的物质交换和信息交流,在多种生理和病理过程中发挥重要作用[7-8]。同时,外泌体除了能稳定的存在血浆中,还能相对稳定地存在于各种液体中,包括唾液、母乳、脑脊液、腹水等,可以实现快速、无创检测[9]。通过实时动态监控外泌体的变化,能够及时有效地辅助确诊脓毒症患者特定的病原体以及判断目前治疗方案是否有效[5]。
目前关于外泌体miRNA 在脓毒症中的表达情况、作用及其机制的研究仍处于起步阶段[10-12]。在本研究的前期,本研究通过脓毒症患者血浆芯片法发现脓毒症患者血浆中miR-519c-5p 表达上调[13]。为进一步研究外泌体中miR-519c-5p 的升高对脓毒症的作用影响及其机制,本实验通过上调外泌体中miR-519c-5p 表达,验证了外泌体介导的miR-519c-5p 是能促进脂多糖诱导的血管内皮细胞凋亡,从而在一定程度上预测脓毒症的病情进展。
1 材料与方法
1.1 材料
1.1.1 主要仪器超速离心机(Beckman Coulter Optima-XE 100,美国),纳米颗粒跟踪分析仪(Malvern,Nanosight NS 3000,英国),透射电镜(Hitachi,日本),二氧化碳细胞培养箱(Thermo Scientific Forma,美国),荧光显微镜(Leica DMI8,德国),光学显微镜(Leica,德国),激光共聚焦显微镜(Zeiss LSM 710,德国),超纯水系统(Merck Millipore,德国),450 型自动酶标仪系统(SunriseTM,瑞士),流式细胞仪(CytoFLEX,美国)。
1.1.2 主要试剂脂多糖(Sigma,美国),Cell Counting Kit-8(Dojindo,日本),Annexin V-FITC/PI凋亡检测试剂盒(Solarbio,中国),蛋白抗体(Abcam,英国),has-miR-519c-5p 及u6 q RT-PCR 引物、阴性对照(negativecontrol,NC)、MicrONTMCy3-hasmiR-519c-5p 模拟物(mimic)及其NC 为锐博公司产品,miRNeasy Mini Kit(QIAGEN,中国),SYBR Premix Ex TaqTMⅡ(TaKaRa),cDNA 试剂盒(Thermo Scientific,美国),TRIzolTMRegent(Thermo Scientific,美国),Dr.GenTLETMPrecipitation Carrier(Takara#9094,日本),PKH 67(Sigma,美国),DAPI(鼎国,中国)。
1.2 细胞培养人脐带静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)购 于 美 国ScienCell 研究室。HUVECs 细胞株培养液为ECM基础培养基+5%胎牛血清(4 ℃,超速120 000 ×g离心18 h 去除胎牛血清中外泌体)+1%青链霉素+1%生长因子,5%CO2,37 ℃培养箱中培养。每2 ~3 d 传代1 次。倒置显微镜观察细胞生长情况。种板时取对数生长期的HUVECs 细胞,0.25%胰酶制成单个细胞悬液,细胞浓度为1 × 105/mL,根据实验需求铺于6 孔板(每孔2 mL)或96 孔板(每孔100 μL),培养24 h 待其贴壁后饥饿处理再行后续实验。
1.3 实验细胞分组细胞接种于6 孔板或96 孔板24 h 后经饥饿处理后,分为空白组:HUVECs +blank-exosomes 组;对照组:HUVECs+ LPS +blankexosomes组,HUVECs+miR-519c-5p-exosomes组;实验组:HUVECs+ LPS + miR-519c-5p-exosomes 组。对于需要LPS 刺激的细胞:加入终浓度为10 μg/mL的LPS或者等量的PBS共同孵育6 h终止后换液[14],对于需要外泌体刺激的细胞:加入2 μg 经BCA 测定浓度的外泌体或者等量体积的PBS 与细胞浓度为1×105/mL 共同孵育12 h[15]。
1.4 外泌体
1.4.1 外泌体收集取培养48 ~72 h 的HUVECs,收集培养瓶中的培养基,收集完毕后将培养瓶中的HUVECs 继续培养基培养,传代。将收集好的的培养基放入离心管中,4 ℃2 000 ×g离心30 min以去除培养基中的细胞和细胞碎片等。将离心好的不含细胞和碎片的培养基移入超速离心管,并放入超速离心机中,注意不要碰到原离心管底部的离心沉淀物,以4 ℃,高速16 800 ×g离心30 min以去除微小颗粒,将予以离心好的培养基予以0.22 μm 滤膜过滤。过滤完后放置移入新的超速离心管,放入超速离心机中,以4 ℃,超速100 000 ~120 000×g离心70 min,去除上清,注意不要把底部沉淀吸走。超速离心管中加入适量PBS 充分混匀溶解沉淀后重复4 ℃,超速100 000 ~120 000×g离心70 min,最后予以50~100 μL PBS 吹打离心管底部的外泌体,使其充分溶解溶解沉淀的外泌体。4 ℃保存备用。长期保存时置于-80 ℃[16]。
1.4.2 外泌体形态鉴定取出在-80 ℃冰箱保存的外泌体,放置于冰水混合物中解冻。取浓度为0.5 mg/mL的外泌体10 μL滴加于铜网上沉淀1 min,滤纸吸去浮液。然后醋酸双氧铀负染1 min,滤纸吸掉多余液体。常温干燥15 min,上机,80~120 kV 成像。
1.4.3 外泌体粒径鉴定使用Nanosight NS3000 测量样品粒径前,先予以超纯水缓慢推注,清洗检测管路及测试板,并将管路及测试板中的气泡予以去除。将浓度为0.5 mg/mL 的外泌体样品1∶1 000稀释于标准PBS 中成1~2 mL,使用1 mL 注射器取1 mL 稀释后的样品缓慢注入检测管路中,让样品匀速通过检测管路。在软件可见比较均匀的颗粒通过时,即可以实施检测。NTA 软件即开始纪录每一个颗粒的布朗运动,并对于每个颗粒自动定位,跟踪其中心运动的轨迹,计算平均唯一,绘制出颗粒散射光强-粒径-数量分布的三维图,NTA 软件可计算出颗粒粒径的数量分布信息。
1.4.4 Western Blot取出在-80 ℃冰箱保存的外泌体,并采用BCA 法测量外泌体浓度,取20 μg 外泌体样品+等体积SDS samplebuffer,煮沸5 min。根据待测蛋白分子量的大小(CD63 预测分子量大小26 kDa,TSG101 预测分子量大小44 kDa)选择合适浓度的聚丙烯酰胺凝胶电泳,PVDF 膜电转,封闭完孵育一抗4 ℃过夜,根据说明书推荐配制一抗浓度:CD63(1∶1 000)、TSG101(1∶1 000);PBST洗膜后孵育二抗1 h,再洗膜。ECL 化学发光液显色后于化学发光成像仪器中曝光。
1.4.5 外泌体转染超速离心后所得外泌体沉淀,予以50~100 μL PBS 重悬后,BCA 法测量外泌体蛋白浓度,将200 pmol miR-519c-5pmimic 或者mimicNC 与20 μg 外泌体在无菌PBS 中混合,然后加入CaCl2(终浓度0.1 mol/L)。使用无菌PBS 将最终体积调节至300 μL。将混合物再置于冰上5 min。最后再次4 ℃,超速120 000×g离心70 min 分离外泌体[17]。
1.4.6 细胞摄取外泌体实验超速离心后所得的外泌体沉淀,重悬于0.5 mL Diluent C 中,同时将4 μL PKH 67 添加至0.5 mL Diluent C 中,两者混匀,常温避光孵育4 min。随后添加2 mL 0.5%BSA 以终止过度染色,将标记的外泌体再次超速离心1 h 以清楚残余燃料,随后外泌体沉淀重悬于200 μL PBS 中。将标记好后的外泌体添加到受体细胞中(共聚焦培养皿,20 μg/mL),37 ℃孵育8 h。吸去细胞上清夜,用PBS 洗1 次,加入固定液,避光孵育10 min,吸去固定液,用PBS 洗2 次,每次2 min,手摇或者摇床震荡。加入1 mL DAPI(染细胞核),避光孵育5 min。吸去DAPI,用PBS 洗3次,每次2 min,手摇或者摇床震荡。最后在共聚焦皿中加入1 mL PBS,避光保存,立即予以上共聚焦显微镜观察细胞摄取外泌体荧光显色情况。
1.5 实时荧光定量PCR 法使用Trizol 提取细胞与外泌体总RNA,在提取外泌体总RNA 时,需加入Takara#9094 助沉剂,后按照说明书进行实时荧光定量PCR 法,后续PCR 条件为95 ℃30 s;40 个PCR循环(95 ℃5 s;60 ℃30 s),反应总体积20 μL。以u6 作为内参。引物序列如下示:
miR-519c-5p(Forward Primer(5′-3′)GTCACCGGGTGTAAATCAG)、(Reverse Primer(5′-3′)GGTCCAGTTTTTTTTTTTTTTTCAAG);u6(Forward Primer(5′-3′)CTCGCTTCGGCAGCACA)、(Reverse Primer(5′-3′)AACGCTTCACGAATTTGCGT)。
1.6 CCK-8 法检测各实验组HUVECs 的活力96 孔板中每孔加入CCK-8 10 μL,孵育1 h 后在酶标仪450 nm 波长下检测各孔吸光度,以OD值反映细胞增殖情况。
1.7 Annexin V-FITC/PI 双染检测各实验组HUVECs的凋亡率使用0.25%不含EDTA 的胰酶消化6 孔板内的HUVECs,室温下1 000 r/min 离心5 min,弃上清液。将细胞沉淀重悬在1 mL bindingbuffer 中,37 ℃孵育10 min,室温下1 000 r/min 离心5 min,去上清。将细胞重悬在100 μL bindingbuffer 中,按照说明书加入适量染色剂Annexin V/PI,室温避光孵育15 min 后加入400 μL bindingbuffer,于1 h 内上机检测。
1.8 统计学方法实验数据分析均采用SPSS 21.0 统计软件处理。两组数据间比较,数据呈正态分布且方差其的数据采用t检验;呈正态分布但方差不齐的数据采用校正t检验。多组件比较数据呈正态分布且方差齐,采用完全随机设计的方差分析,组间比较分析采用Dunnettt 检验。其中P<0.05 为差异具有统计学意义。
2 结果
2.1 外泌体粒径分布在(158.9 ± 36.4)nm 左右并表达CD63、TSG101收集细胞培养基,利用超速离心法提取外泌体,透射电镜鉴定所得外泌体形态(图1A)。透射电镜鉴定外泌体形态上均呈现双层膜茶托样结构。Nanosight NS3000 结果表明收集得外泌体粒径分布集中于(158.9±36.4)nm 左右(图1B),颗粒浓度在107/mL,具体产量随细胞状态,培养时间及纯化分析方式不同有较大波动。同时,Western Blot 显示收集得外泌体均表达常见外泌体标记蛋白CD63、TSG101(图1C)。

图1 外泌体鉴定Fig.1 The identification of exosomes
2.2 转染组外泌体miR-519c-5p 以及摄取外泌体的内皮细胞的miR-519c-5p 表达量升高qRTPCR 结果(图2)显示:空白组的外泌体几乎不表达miR-519c-5p,而转染miR-519c-5p mimic 的外泌体组能稳定高表达miR-519c-5p(P<0.001);同时,稳定高表达miR-519c-5p 的外泌体与各组HUVECs共培养后,同样均高表达miR-519c-5p(P<0.001)。
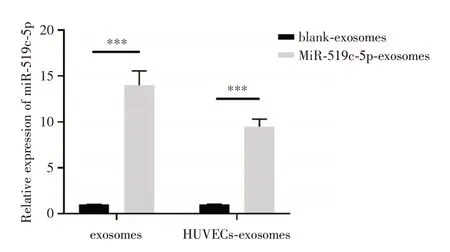
图2 转染后的外泌体和与转染后的外泌体共培养的细胞过表达miR-519c-5pFig.2 MiR-519c-5p was overexpressed in transfected exosomes and in the cells co-cultured with the transfected exosomes
2.3 HUVECs 摄取过表达miR-519c-5p 的外泌体激光共聚焦结果显示(图3)HUVECs 中既有绿色荧光标记的外泌体,又有红色荧光标记的miR-519c-5p,两者重叠的时候为黄色,这直观的表明外泌体可将miR-519c-5p 运送至HUVECs 中。
2.4 过表达miR-519c-5p 的外泌体能够抑制HUVECs 增殖空白组培养12 h 后平均OD值为(1.388±0.03);对照组在培养12 h 后平均OD值为(0.843±0.04);实验组在培养12 h 后平均OD值为(0.458 ± 0.01);可见实验组OD值最低(0.458vs.0.843,P=0.048;0.458vs.1.388,P<0.001),对照组OD值同时亦低于空白组(0.843vs.1.388,P=0.048),见图4。
2.5 过表达miR-519c-5p 外泌体增加HUVECs 凋亡空白组平均凋亡率(0.647 ± 0.04)%,对照组HUVECs + LPS + blank-exosomes 平均凋亡率为(3.517 ± 0.61)%,对照组HUVECs + miR-519c-5pexosomes的平均凋亡率为(3.33±0.135)%,对照组间平均凋亡率差异无统计学意义(3.517%vs.3.33%,P= 0.104),两组对照组平均凋亡率为(3.423 ±0.75)%,实验组平均凋亡率为(7.197 ± 0.16)%。实验组HUVECs 平均凋亡率比空白组、对照组的高(7.197%vs.0.647%,P<0.001;7.197%vs.3.423%,P= 0.001),空白组HUVECs 凋亡率比对照组的低(0.647%vs.3.423%,P=0.001),实验组的HUVECs的平均凋亡率最高,见图5。
3 讨论
脓毒症一直是重症医学领域的重点和难点。如果脓毒症患者不能得到及时和有效的救治,将会引起多器官的功能损伤,短期时间内发展成多器官功能衰竭,最后死亡。 有研究表明,脓毒症的根本原因是机体对外部损伤的过度反应障碍,这是脓毒症导致远处器官损伤的根本原因[18]。因此,揭示脓毒症的形成机制,做到尽早预警脓毒是非常重要的。目前为止,脓毒症治疗指南已经更新至第三版,但仍未寻找到能直接监测由脓毒症引起的组织损伤或者能预测随后发生的脏器功能衰竭分子生物学标志物[1,19-20]。目前的脓毒症标志物,如乳酸和降钙素原也许能够明确是否出现组织灌注不足或者发生脏器功能衰竭,但并不能很好地运用于抗生素的调整使用[21]。早期的研究表明脓毒症当中miRNA 具有促进炎症或免疫反应的作用[22],像miR-26a-5p、miR-339-5p 能够抑制核内κB 因子的表达[23-24],miR-185-5p 能调节免疫细胞的增殖和分化[25]。miRNA 在常态下极易分解,但在人体血浆中,miRNA 经常通过以下途径来保持其稳定:(1)与高密度脂蛋白结合;(2)与argonaute 蛋白结合;(3)装载入保护性囊泡如外泌体[26]。在近十年的研究中,发现外泌体在肿瘤发生发展中起着介导细胞与细胞间交流信息的重要作用,并且对于肿瘤微环境的形成以及肿瘤细胞的免疫逃逸起着重要的帮凶作用[27]。外泌体的释放代表一种即时的细胞通讯机制,可以实现3 个主要功能:(1)将表达模式转移至其他细胞;(2)在液相内分散膜结合介体;(3)以及细胞表明快速重排[5]。外泌体可立即以旁分泌方式修饰邻近的细胞表型,但也可以通过将膜成分和(或)表达方式转移至循环的其他区域。目前有文献表明,外泌体监测能有效的帮助鉴定和表征给脓毒症患者特定的病理生理学,以及评估患者可用的各种治疗方案的功效。同时,外泌体也是理想的载药系统,通过外泌体介导的药物能够有效的传送至靶点启动治疗效果[28]。

图3 激光共聚焦镜下血管内皮细胞Fig.3 HUVECs in laser confocus microscope
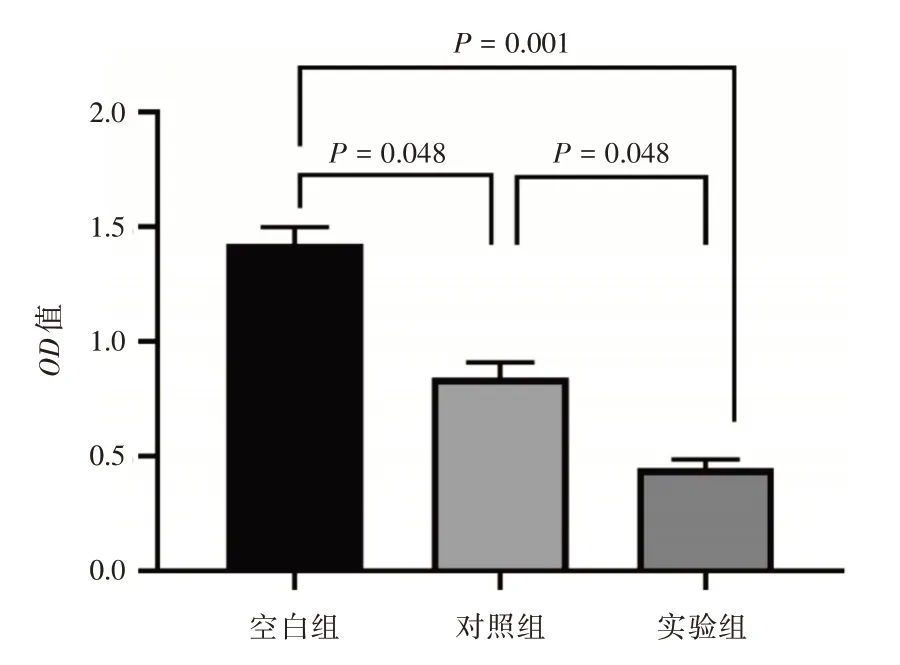
图4 不同分组的HUVECs 增值活性检测结果Fig.4 Proliferative activity in different groups of HUVECs
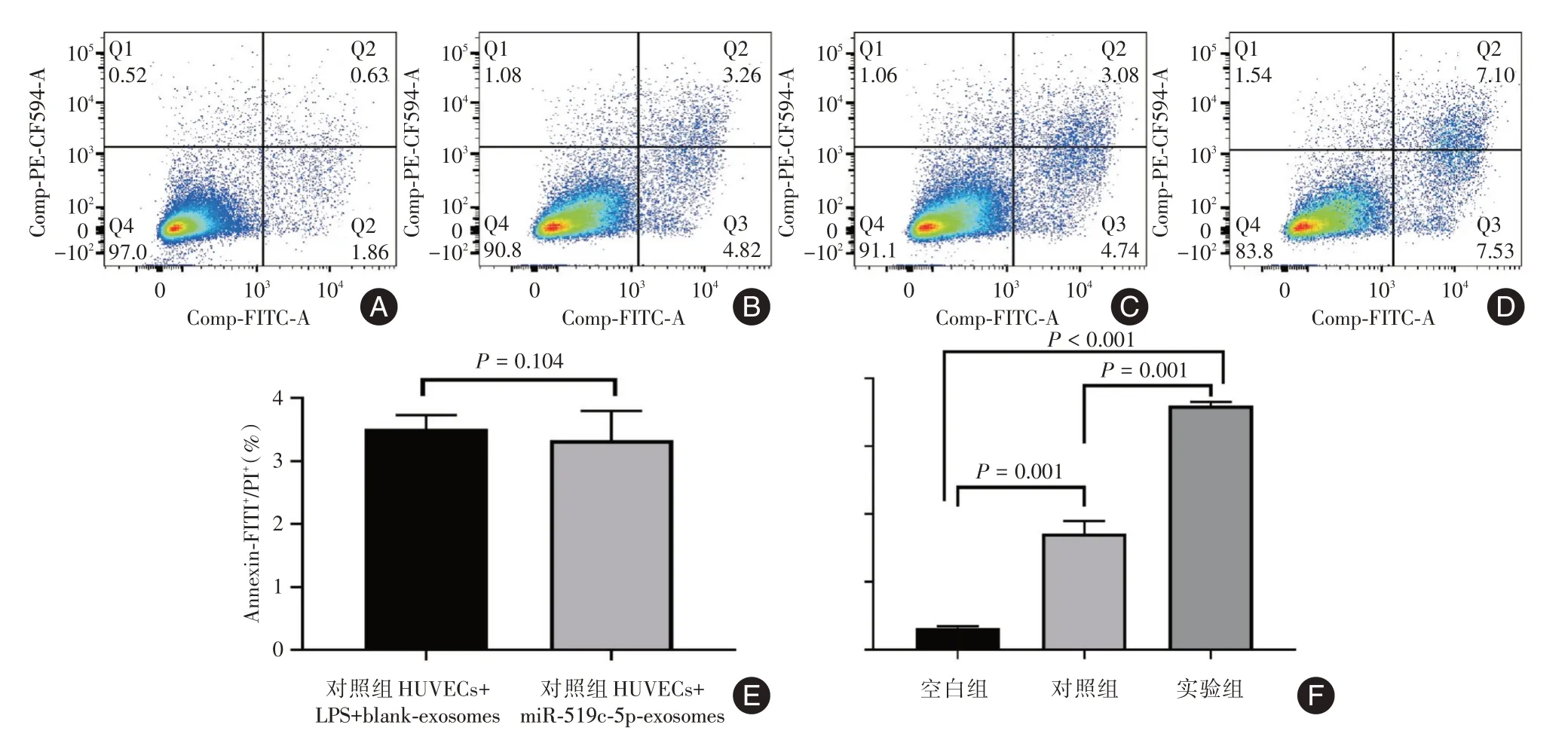
图5 不同分组HUVECs 凋亡检测流式结果以及结果定量分析图Fig.5 Flow cytometry resultsand quantitative analysis of apoptosis detection in different groups
本研究中,通过LPS 诱导HUVECs 构建脓毒症细胞模型,将通过转染miR-519c-5pmimic 得到过表达miR-519c-5p 的外泌体与之共培养,共培养后的HUVECs 的通过CCK8 法与流式细胞术检测其增殖能力与凋亡情况。结果显示过表达的miR-519c-5p 外泌体能够促进LPS 诱导的HUVECs 增殖能力下降,凋亡增多。目前对于外泌体高表达miR-519c-5p 能促进脂多糖诱导的HUVECs 凋亡的机制并不清楚,并且对于miR-519c-5p 在脓毒症中发挥的作用也不清楚。目前研究表明miR-519c 家族可能与RNA 结合蛋白HuR 有关[29]。miR-519 靶向结合HuR mRNA 并抑制其翻译,显示了一种转录后调节因子(miRNA)对另一种转录后调节因子(RNA 结合蛋白)的调节作用。与大多数miRNA与目标mRNA 的3′-UTR 相互作用不同,miR-519 似乎主要通过与HuRmRNA 的编码区(CR)结合起作用。RNA 结合蛋白(RBPs)是哺乳动物细胞中基因表达的关键调节剂。它们影响基因表达的关键,包括mRNA 剪接、5′加帽、3′聚腺苷酸化、核转运、细胞质运输、储存、翻译和周转[30]。而HuR 是影响细胞对应激物、增殖信号、抗凋亡、免疫触发和发育线索的细胞响应的最突出的特异性RBPs[31]。HuR 的靶标还包括编码促进增值和血管生存的蛋白质mRNA,以及增强细胞逃避衰老,凋亡和免疫系统的蛋白质[32]。miR-519 能抑制HuR 表达,降低HuR 翻译,同时通过减少HuR 蛋白水平间接降低HuR 靶向mRNA,而这些mRNA 大多编码增值蛋白,如细胞周期蛋白,生长因子(IGF-1R VEGF、EGF、TGF-β等),促有丝分裂和转录因子(c-fos、cmyc、c-jun、p53 等)的表达[33],从而使细胞凋亡增加。miR-519c-5p 在外泌体中的高表达在对细胞的确切机制以及对脓毒症状态下的细胞凋亡调控机制和进展仍有待于进一步的研究。
综上所述,外泌体介导的miR-519c-5p 也许通过调节RNA 结合蛋白HuR 从而影响细胞的增殖与凋亡。前期的研究发现[13],血浆中miR-519c-5p升高的脓毒症与脓毒症休克患者病死率增高存在正相关,可以通过收集患者的液体比如唾液,腹腔积液,进行外泌体分离提纯,并检测miR 表达谱,如miR-519c-5p,最终辅助评估患者病情,指导临床治疗,攻克脓毒症诊治难关。
