玉米盐碱响应基因ZmERF1和ZmERF2的分子特性分析
2020-05-06程殿君郭耀祖吴庚锦边境徐晶宇李佐同贺琳
程殿君,郭耀祖,吴庚锦,边境,徐晶宇,李佐同,贺琳
(黑龙江八一农垦大学,大庆 163319)
盐渍土壤是陆地上分布较广泛的一种土壤类型,全世界盐渍土面积约109 hm2,亚洲约为3.99×108hm2,我国盐渍土面积约为3.5×107hm2。受气候变化,人口增多及使用不当等诸多不利因素的影响,许多耕地正在面临发生次生盐碱化的危险。黑龙江省盐碱地主要分布在松嫩平原西部的低洼地区,约占松嫩平原总土地面积的14%,是世界上三大苏达盐碱地集中分布区之一,其中黑龙江省大庆及齐齐哈尔地区盐碱土地近66.7×105hm2,主要致害成分为NaCl、Na2SO4、Na2CO3和NaHCO3。已知低浓度的盐碱胁迫处理对种子萌发的影响很小或不影响,但浓度过高会对作物种子的萌发起到抑制作用,盐碱胁迫使作物种子细胞膜透性增强,随盐碱胁迫的增加,作物遭受胁迫的程度更明显且影响植物的后期生长[1]。由于灌溉不当和大量施用化肥等原因,次生盐碱化土壤面积还在继续扩大,从而导致可耕地面积逐年下降,耕地土壤的不断盐渍化严重威胁着粮食生产安全。近年来,玉米已经成为黑龙江省种植面积最大的粮食作物,玉米的高产稳产关系到我省的粮食安全和经济建设。玉米是盐中度敏感的作物,耐盐性差,在中度盐渍土(含盐量0.3%~0.5%)种植玉米一般减产20%,严重者可达46.7%。因此,玉米在黑龙江省的生产频繁地受到盐碱逆境的威胁,研究玉米应答盐碱逆境是非常有必要的。
在植物抗胁迫信号转导网络中,转录因子在功能基因的表达调控中起关键作用。近年来,相继分离出大量不同类型的植物转录因子,其中参与抗逆反应的有bZIP类转录因子、MYB类转录因子、AP2/EREBP转录因子、WRKY类转录因子以及NAC类转录因子等。AP2/EREBP转录因子是其中一个重要家族,每个成员至少都含有一个高度保守的58或59个氨基酸组成的DNA结合域[2]。根据DNA结合区的数目可将 AP2/EREBP 分为 AP2、DREB、ERF、RAV和其他类别5个亚家族[3]。
ERF是AP2/EREBP转录因子大家族的一个主要亚家族,其成员众多,拟南芥中有122个,水稻中有139个,而玉米中有186个(见TFDB数据库)。已有的报道显示ERF亚家族成员在调节植物生物和非生物逆境反应中发挥重要作用[4-5]。拟南芥ERF1基因的组成型表达,能使转基因拟南芥有效抵御Botrytis cinerea 和 Plectosphaerella cucum erina 等[6]坏死营养型真菌的侵染。AtERF14的过表达在乙烯诱导中能提高 ERF1、PDF1、Chi等[7]基因的表达,进而提高拟南芥对镰刀菌的抗病性。烟草和番茄中TERF2/LeERF2基因过表达可以提高植株抗冷性[8];刘文奇等[9]经过对转入OPBP1基因的烟草分析发现增强OPBP1的表达能提高烟草的抗盐能力;ERF类转录因子TSRF1的超表达可以提高水稻抗旱性[10]。小麦TaERF1基因在干旱、盐、低温及病菌侵害后迅速表达,TaERF1基因在烟草中过表达后既可以提高植株抗旱能力,又能提高植株耐盐能力[11]。Zhang等[12]研究表明转基因烟草中过量表达GmERF3可以提高植物对高盐和干旱的抗性,干旱条件下转基因植株中游离脯氨酸和可溶性碳水化合物的含量显著高于非转基因株系。麻疯树中编码ERF类转录因子JcERF基因在拟南芥中过表达,可以提高植物对高盐和低温的适应性[13]。拟南芥ERF74的过表达株系显示了提高的旱、热、强光和铝耐受性[14]。拟南芥AtERF019的过表达可以提高植物的抗旱性[15]。
深入的研究显示ERF蛋白主要通过识别DRE/CRT和GCC-box元件调控下游基因表达进而参与植物抗逆反应。DRE顺式元件(drought reponse element)是指核心序列为TACCGACAT的一段启动子序列,存在于许多低温应答或干旱诱导的基因中[16]。利用电泳迁移率变动试验(EMSA)、顺式作用元件突变分析以及体内瞬间表达分析,证明拟南芥的CBF1、DREB1/2和玉米的 DBF1/2能与 DRE/CRT特异性结合[16-17]。GCC-box保守序列为AGCCGCC,主要存在于许多PR(pathogenesis-related)基因的启动子区域中,起着乙烯应答元件的作用[18]。植物的许多抗病相关基因启动子都含有GCC-box,研究表明烟草ERF1/2/3、番茄 Pti4/5/6、拟南芥 AtERF1/2/3/4/5和水稻 OsEBP-89等 ERF转录因子能与 GCC-box结合[18-19]。不过,还有一些 ERF转录因子比较特殊,既能与DRE/CRT特异性结合,又能与GCC-box特异性结合。如烟草中乙烯响应因子TERF1能同时结合乙烯响应元件GCC-box和脱水响应元件DRE,从而使乙烯途径和渗透刺激途径建立起联系[20]。Jeong等[21]从烟草中分离出了Tsi1基因(Tobaccostress-induced gene 1),该基因既能结合GCC-box,也能结合 DRE/CRT元件,与GCC盒结合的强度要比与DRE/CRT元件结合的强度大。另外ERF转录因子还可以与as-1 元件[22]、CT-rich element元件[23]和 CE1 顺式作用元件结合[24]。
虽然ERF转录因子在植物抵御不良环境过程中担当重要角色,然而目前的研究只明确了少数ERF转录因子在抗生物和非生物逆境反应中的功能,关于玉米ERF转录因子响应盐碱胁迫反应的报道尚未见到。实验室利用实时定量PCR鉴定了两条在根部高度响应盐碱胁迫的基因ZmERF1(GRMZM2G-544539)和 ZmERF2(GRMZM2G425798)。利用生物信息学方法对两条ERF的进化关系、蛋白保守结构域、启动子所含元件等进行综合分析,期望研究的结果能够为进一步研究玉米ERF基因的抗逆功能和调控机制提供线索。
1 材料与方法
1.1 ZmERF1和ZmERF2在盐碱胁迫下的表达模式分析
利用100 mM NaHCO3处理三叶一心时期玉米幼苗,于处理不同时间点(0、12、24、72 h)对根系进行取样,液氮速冻,-80℃保存用于提取RNA。利用TRIzol试剂(Invitrogen)提取总的RNA。使用Rever-Tra Ace qPCR RT Master Mix with gDNA Remover(TOYOBO)反转录。
使用Bio-Rad Chromo4 real-time PCR系统进行实时定量PCR。反应混合液含有2×SYBR Green Realtime PCR Master Mix(Toyobo)12.5 μL,上下游引物 0.5 μM,cDNA 模板 2 μL(相当于 100 ng的RNA),总体积为 25 μL。反应条件为:94 ℃,30 s;45循环:94 ℃,12 s;58 ℃,30 s;72 ℃,30 s。最后 80 ℃,1 s。玉米 Actin1(GRMZM2G126010)作为内参标准化数据。相对表达水平利用2-△△CT方法计算[25]。ERF在0 h根中的表达水平设为1,其他的处理相应进行计算。每一个样品进行三次独立的生物学重复,每次进行3次技术重复。所有的引物显示在表1中。

表1 实时定量PCR引物序列Table1 The primer sequences in real time RT-PCR
1.2 ZmERF1和ZmERF2系统进化树、保守序列预测及基因结构分析
利 用 phytozome 数 据 库(https://phytozome.jgi.doe.gov)下载ZmERF1和ZmERF2的蛋白序列,筛选与二者同源的来自不同物种的75条ERF蛋白,如表2所示,包括拟南芥52条ERF,水稻8条,玉米4条ERF,番茄6条,大豆1条,小麦1条,大麦3条。利用MEGA6.0软件对这些ERF蛋白进行序列比对[26],并用邻位(Neighbor-Joining)算法对77条ERF构建系统进化树,通过Bootstrap测试,重复设置1 000来保证进化树的可靠性。保守序列预测采用在线软件MEME(http://meme-suite.org/)进行预测,设置参数如下:预测数目:20;氨基酸数目:6~50;位点:2~600。
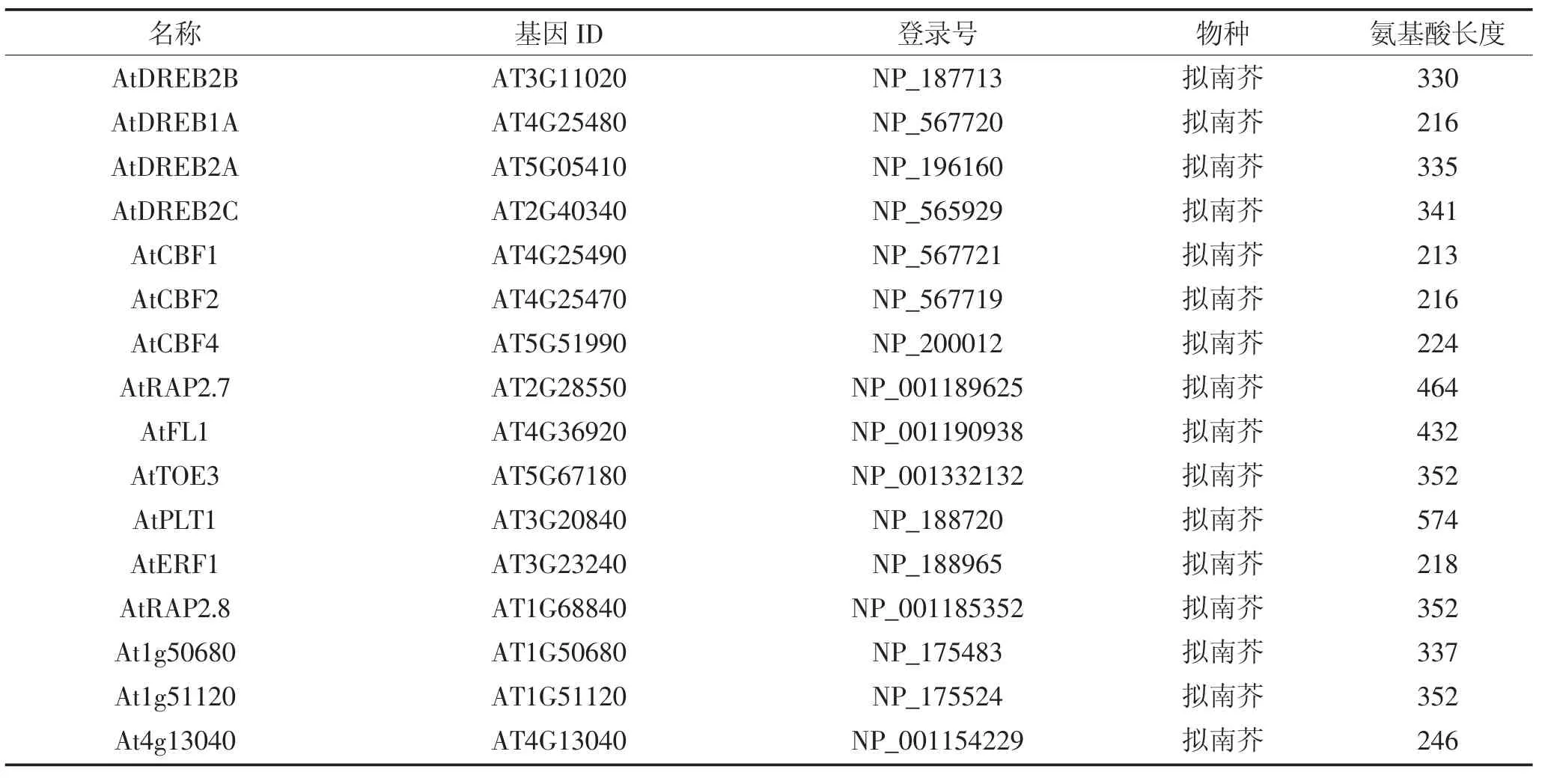
表2 拟南芥、玉米、水稻、番茄、大豆、小麦、大麦基因信息Table 2 Genetic information of Arabidopsis,maize,rice,tomato,soybean,wheat and barley
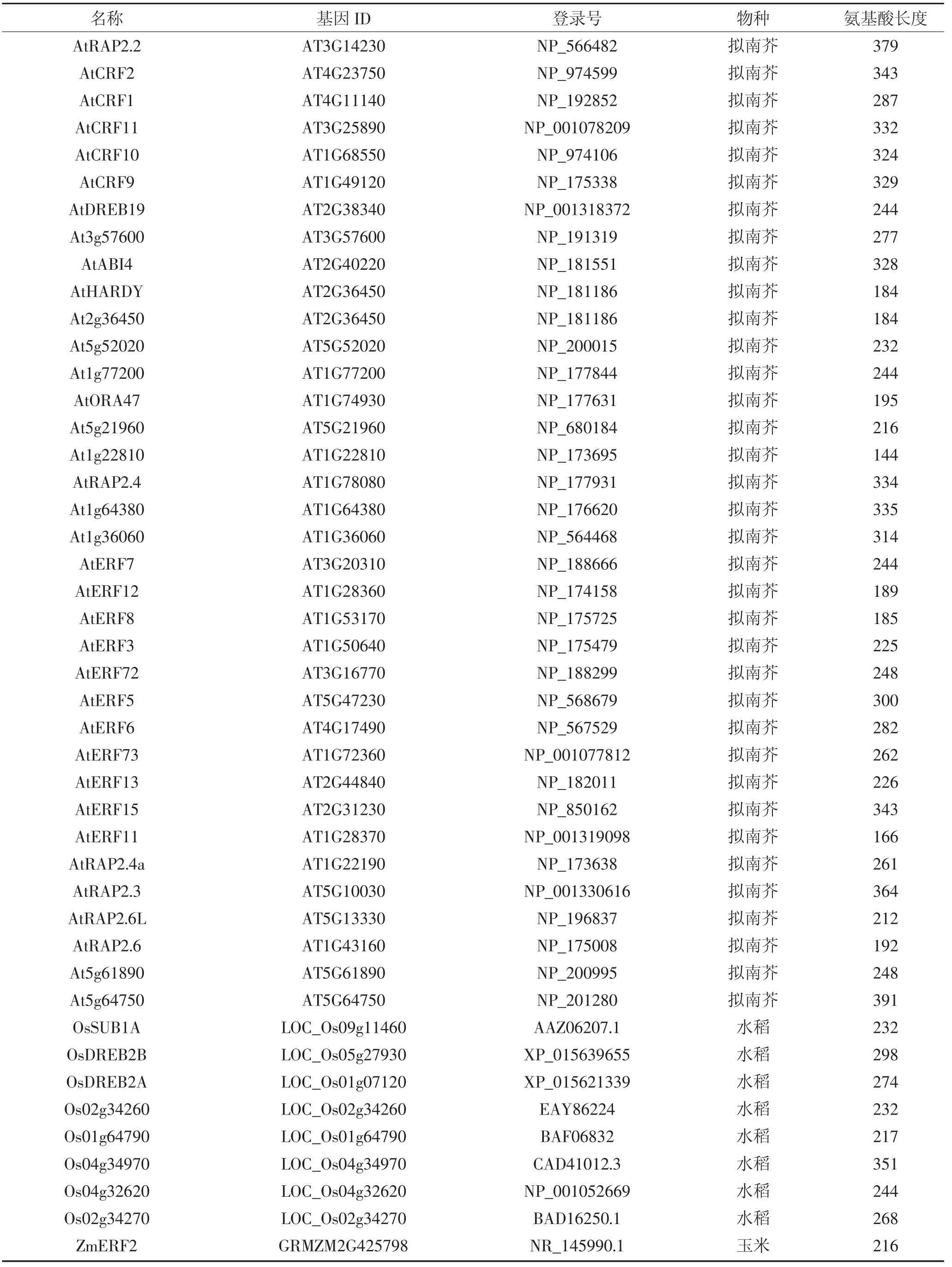
续表2 拟南芥、玉米、水稻、番茄、大豆、小麦、大麦基因信息Continued table 2 Genetic information of Arabidopsis,maize,rice,tomato,soybean,wheat and barley
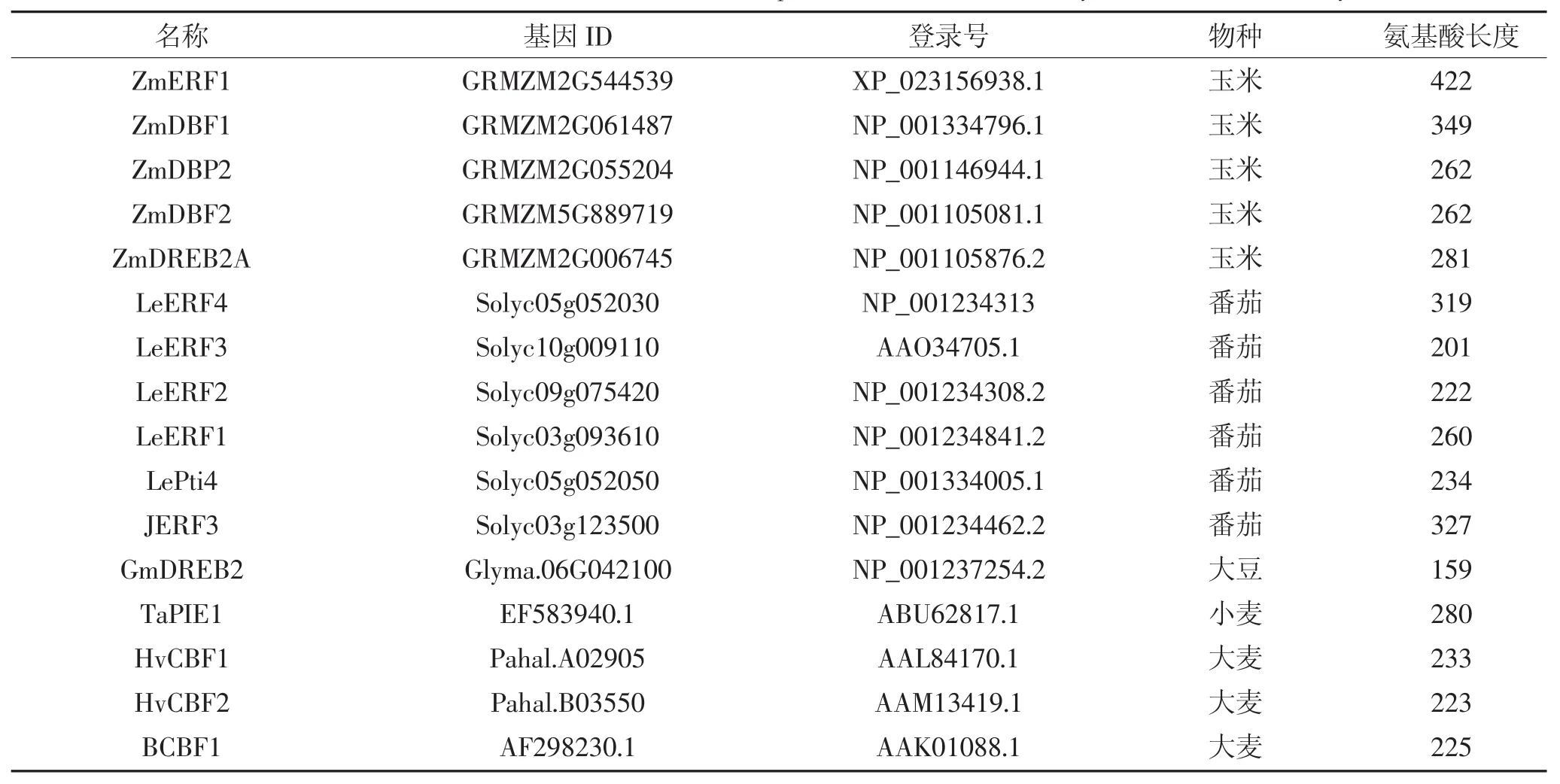
续表2 拟南芥、玉米、水稻、番茄、大豆、小麦、大麦基因信息Continued table 2 Genetic information of Arabidopsis,maize,rice,tomato,soybean,wheat and barley
1.3 ZmERF1和ZmERF2的启动子分析
在 phytozome数据库(https://phytozome.jgi.doe.gov)下载ZmERF1和ZmERF2转录起始位点上游1 500 bp的启动子序列,利用在线数据库plantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)预测ZmERF1和ZmERF2启动子包含的逆境相关顺式作用元件,运用IBS软件绘制启动子分析图。
2 结果与分析
2.1 ZmERF1和ZmERF2基因的表达模式分析
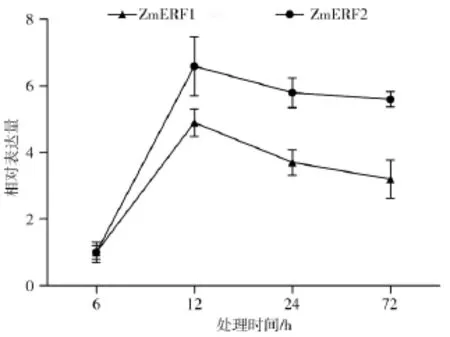
图1 NaHCO3胁迫下 ZmERF1和ZmERF2基因在根中的表达模式分析Fig.1 Gene expression pattern analysis of ZmERF1 and ZmERF2 in root under NaHCO3stress
利用实时定量PCR,我们研究了ZmERF1和ZmERF2这两个基因在盐碱处理条件下在玉米根中的表达模式。如图1所示,在根中,盐碱胁迫后ZmERF1和ZmERF2基因总体表达趋势上升,当盐碱胁迫处理12 h,ZmERF1和ZmERF2的表达量达到最高峰,随后二者表达量逐渐减少,但仍然高于未处理对照(0 h)。以上结果表明ZmERF1和ZmERF2在玉米根中均能被盐碱胁迫诱导,且具有极为相似的表达模式。
2.2 ZmERF1和ZmERF2进化关系和保守结构域分析

图2 ZmERF1和ZmERF2与其他已知NAC蛋白的进化关系分析Fig.2 Phylogenetic relationship analysis of ZmERF1 and ZmERF2 with other known NAC proteins
为了鉴定ZmERF1和ZmERF2的进化关系,选取75条(拟南芥52条,水稻8条,玉米4条,番茄6条,大豆1条,小麦1条,大麦3条)已经明确进化关系的ERF蛋白作为标尺,利用MEGA6.0软件对77条ERF蛋白进行序列比对。结果显示ZmERF1和ZmERF2同属于ERF-B4亚家族(图2)。
从进化关系上看,ZmERF1的直系同源基因为Os01g64790,ZmERF2的直系同源基因为Os04g32620(图2),可见相比于拟南芥ERF,玉米ERF基因与水稻的ERF同源性更强。
为了鉴定ZmERF1和ZmERF2蛋白的保守结构域,利用MEME在线预测了11条ERF-B4亚家族成员蛋白序列中的保守元件(图3)。关于氨基酸序列保守性的详细信息以及20个保守元件的序列组成见表3。

图3 ZmERF1和ZmERF2保守结构域分析Fig.3 Conserved domauns analysis of ZmERF1 and ZmERF2

表3 ERF蛋白的特异性保守氨基酸基序Table 3 Specific conserved amino acids motifs in ERF proteins
ZmERF1 仅含有 Motif 1,Motif 2,Motif 3,且这三个元件在其他ERF中均有分布,其中Motif 1和Motif 2一起构成了ERF家族基因高度保守的DNA结合域,用于与靶基因启动子中的GCC-box等元件结合。Motif 1,Motif 2,Motif 3在拟南芥、水稻和玉米的ERF中均有分布,表明这三个结构域在物种间具有高度保守性。
ZmERF2结构域较ZmERF1复杂,除含有Motif 1,Motif 2,Motif 3等保守结构域外还含有Motif 5,Motif 7~13和Motif 18等9个可变结构域。这些可变结构域中的一些与拟南芥间存在保守性,如Motif 5,Motif 9,Motif 10,Motif 11,Motif 12,Motif 18。Motif 9 和Motif 18在ERF蛋白上的存在位置较为灵活,可以位于ERF保守DNA结合域前,也可以位于其后。另一些可变域则与水稻存在保守性如Motif 5,Motif 7,Motif 8,Motif 10,Motif 13,这 5 个保守元件在水稻和玉米的ERF蛋白中存在位置相对一致,均位于ERF保守DNA结合域之后,表明C端为ERF蛋白的可变区域,可能与ERF的转录激活或抑制功能相关。
2.3 ZmERF1和ZmERF2启动子分析
为了进一步证实ERF在逆境下的角色,利用PlantCARE数据库分析ZmERF1和ZmERF2的启动子区域(转录起始位点上游1 500 bp),鉴定假定的顺式作用元件(图4)。ZmERF1启动子中含有五种类型的元件,包括1个GCC-box(ERF binding element,ERF结合元件),1个 MBS(Drought responsive element,旱响应元件),2 个 W-box(WRKY binding element,WRKY 结合元件),2 个 ARE (Anaerobic responsive element,厌氧响应元件)和 6 个 ABRE(Abscisic acid responsive element,脱落酸响应元件)。ABRE元件在ZmERF1启动子中的高频出现表明该元件在玉米应答逆境过程中发挥着重要作用。ZmERF2启动子中含有三种类型的元件,包括3个ARE(Anaerobic responsive element,厌氧响应元件),1 个 MBS(Drought responsive element,旱响应元件)和1 个 LTR(Low temperature responsive element,低温响应元件)。

图4 ZmERF1和ZmERF2基因启动子序列分析Fig.4 Promoters analysis of ZmERF1 and ZmERF2
3 结论与讨论
植物抵御逆境是一个极其复杂的调控过程,包括ERF在内的许多转录因子同时参与其中。然而,不同转录因子之间存在着怎样的分工合作关系尚不清楚。已有的报道显示一些ERF转录因子调控下游靶标基因表达需要其他转录因子的协调互作。如烟草ORC1正向调控烟碱合成途径基因的表达,过量表达ORC1可以提高烟碱合成,但是ORC1调控烟碱合成途径基因表达需要在启动子中同时含有GCC盒和G盒元件(bHLH转录因子识别的顺式作用元件),bHLH转录因子可以增强ORC1的转录活性,而阻断bHLH转录因子活性后则降低ORC1的转录活性[27]。因此,ORC1需要ERF与bHLH的协同作用以达到对靶标基因表达调控的最大转录活性。香蕉转录抑制因子MaDof23通过与MaERF9转录激活因子互作协同调控果实成熟基因的表达[28]。水稻MYC蛋白OsBP-5可以和ERF蛋白OsEBP-89互作进而调控Wx基因的表达[29]。可见,ERFs调控下游基因表达,不是完全独立行使功能的,往往是需要与其他转录因子协同作用,控制调控的效率。然而,目前关于能与ERF互作的转录因子的报道很有限,盐碱胁迫条件下玉米ERF蛋白与其他转录因子协同调控下游靶基因启动子中元件的研究尚未见报道,因此,有必要发现更多玉米ERF类蛋白的互作转录因子,并明确互作在下游靶基因表达调控中的重要作用,从而加深对转录因子参与的植物盐碱胁迫分子调控网络的认识。研究显示ZmERF1和ZmERF2在根中盐碱胁迫处理条件下表达的总体趋势是上调的且表达模式极为相似,说明这两个基因可以被盐碱胁迫诱导表达,二者很可能处于同一信号调控网络中。然而,逆境条件下二者是否存在互作关系,形成异源二聚体(同家族的不同成员之间的互作)从而调控靶基因的表达有待进一步通过实验证实。
进化树分析显示ZmERF1和ZmERF2基因同属于ERF-B4亚家族成员(图2)。已有的报道表明ERF-B4亚家族成员在调控植物的抗逆反应中发挥重要作用。拟南芥ERF-B4亚家族中的7个基因有3个已被报道与非生物胁迫相关,分别是RAP2.6L(At5g13330)、RAP2.6(At1g43160)和 ABR1(At5g64750)。过表达RAP2.6L的拟南芥显示出提高的盐和旱耐受性[30];过表达RAP2.6的拟南芥株系在种子萌发和幼苗发育早期阶段显示出对外源ABA和非生物胁迫的高度敏感性[31];ABR1能够响应ABA和冷、高盐和旱等逆境条件。鉴于同一亚家族成员通常具有相似的功能,因此有必要在后续的实验中鉴定ZmERF1和ZmERF2在参与调控植物逆境应答过程中的潜在功能。
启动子分析发现ZmERF1启动子中含有GCC-box、MBS、W-box、ARE 和 ABRE 五种逆境响应元件,ZmERF2启动子中含有ARE,MBS和LTR三种逆境响应元件(图4),表明ZmERF1和ZmERF2能够响应各种非生物逆境。此外,同一基因启动子中含有三种或三种以上的逆境响应元件说明ZmERF1和ZmERF2可能在多种逆境下同时发挥着重要作用。
植物体内有两种逆境信号途径,一种是依赖于ABA的,一种是不依赖与ABA的信号途径。相应的,逆境诱导基因的启动子中就有两种主要的顺式作用元件ABRE和DRE/CRT。ABRE被认为是调控依赖ABA途径的[31-32],而DRE/CRT元件是不依赖于ABA的[17]。值得注意的是ABRE元件在ZmERF1启动子中出现6次(图4),这一出现频率表明ZmERF1是ABA响应基因,其参与调控的玉米抗逆反应途径很可能受激素ABA调节,属于依赖于ABA途径的调控。相反,ZmERF2启动子中不含ABRE元件,表明它所参与的抗逆反应不依赖于ABA途径。
转录因子在调控下游靶基因表达的同时,自身也可以作为靶基因,被其上游调控因子激活而获得活性。已有的报道显示GCC-box可以被ERF转录因子识别[14],MBS可以被MYB转录因子识别[33],W-box可以被WRKY转录因子识别[34],ABRE可以被bZIP转录因子识别[35-36],这些转录因子在植物的非生物胁迫抗性方面发挥着重要作用[37-40]。GCC-box,MBS,W-box和ABRE在ZmERF1启动子中的出现表明ZmERF1参与的玉米逆境应答中,AREB,MYB,WRKY或ERF等转录因子可能作为其上游调控因子,结合ZmERF1启动子中相应结合位点从而激活或抑制其表达。此外MBS在ZmERF2启动子中的出现也同样暗示了MYB转录因子可能作为ZmERF2的上游调控因子调控其对逆境的应答。因此,ZmERF1和ZmERF2启动子中的逆境响应顺式作用元件的鉴定有助于我们深入探索其上游调控机制。
4 结论
研究利用实时RT-PCR鉴定了两条盐碱响应玉米ERF转录因子基因ZmERF1和ZmERF2,借助生物信息学方法对这两条ERF基因的进化关系、蛋白保守结构域、启动子元件组成等进行了系统分析。研究的结果将为进一步利用转基因手段培育玉米抗/耐品种提供理论依据。
