木聚糖高温自水解和醇沉分离制备低聚木糖
2020-05-05连之娜王艳娥余世袁
连之娜, 王艳娥, 罗 京, 勇 强, 余世袁
(南京林业大学 林木遗传与生物技术省部共建教育部重点实验室;江苏省林业资源 高效加工利用协同创新中心;化学工程学院,江苏 南京 210037)
木聚糖是由若干个木糖单元聚合而成,习惯上将低聚合度(聚合度2~6)的木聚糖称为低聚木糖(XOS)。XOS是一种功能性低聚糖,在人体消化道内不会被代谢,到达大肠后能显著增加有益菌数量,对改善肠道微生态环境、润肠通便和治疗腹泻等效果明显,近年来在国内外备受关注[1-2]。XOS还具有增强免疫力、促进钙吸收、降低结直肠癌变、抗氧化性和降低血压等多种功效[3],且相比于其它功能性低聚糖,其有效用量最少,耐酸耐热,极具市场竞争力,因而被广泛应用在医药、食品、保健品、饲料等领域[3-4]。工业上的XOS通常为木质纤维原料中的木聚糖酶水解所得,然而在酶水解过程中仅有一部分木聚糖能够被降解为XOS,剩余的难被降解的木聚糖则成为木聚糖酶水解残渣。若能将这部分木聚糖酶水解残渣高值化利用,将会大大提高木聚糖的利用率和产品开发应用价值。高温自水解是一种得率高,无化学试剂添加、绿色环保的XOS生产方法[5-7],但是高温自水解液中的木聚糖聚合度分布范围较广,除了XOS,还含有较高聚合度(聚合度大于6)的高聚木糖[8-9]。不同聚合度的木聚糖对益生菌的对比增殖效果研究报道较少,益生效果并不明确。因此,需要采用一定的分离手段将不同聚合度范围的木聚糖进行分离,并探究其益生效果。乙醇沉淀分离聚糖工艺成熟,操作简便,适合大批量操作,且乙醇少量残存对食品级产品无影响,在聚糖分离中应用较多[10-11]。本研究对木聚糖酶水解残渣进行高温自水解,通过乙醇两步沉淀分离,获得XOS和聚合度较高的3种木聚糖组分,以这3种木聚糖组分作碳源增殖青春双歧杆菌,对比评价其增殖益生效果,以期为进一步扩大木聚糖的利用提供有效的理论依据。
1 实 验
1.1 材料、试剂与仪器
木聚糖酶水解残渣,由某生产低聚木糖的公司提供,是玉米秸秆经碱抽提、酶水解后未被降解的高聚合度木聚糖,即难被酶水解的高聚木糖。木二糖、木三糖、木四糖、木五糖和木六糖标准品,购于Megazyme公司;纤维二糖标准品、无水醋酸钠、50%氢氧化钠和木糖标准品,购于Sigma-Aldrich公司;葡聚糖标准品、糠醛、羟甲基糠醛,均购于Fluca公司;甲酸、乙酸、乳酸、丙酸、丁酸和乙醇(纯度99.7%),均为市售分析纯。
青春双歧杆菌(Bifidobacteriumadolescentis)真空冷冻干燥菌种冻干粉(严格厌氧菌株),由中国普通微生物菌种保藏管理中心(CICC)提供,编号6070。活化及增殖培养基:大豆蛋白胨5 g/L,胰蛋白胨5 g/L,酵母提取物10 g/L,CaCl20.008 g/L,NaCl 0.08 g/L,K2HPO40.04 g/L,KH2PO40.04 g/L,NaHCO30.4 g/L,MgSO40.019 g/L,0.05%L-半胱氨酸盐酸盐作为还原剂加入灭过菌的培养基中。
高压反应釜,大连自控设备厂;高速冷冻离心机,美国Eppendorf公司;Bug Box厌氧培养箱,英国Ruskinn公司;Agilent 1260型高效液相色谱(HPLC)仪,带有示差检测(RID),美国Agilent公司;色谱柱CarboPac PA200(250 mm×3 mm),色谱保护柱CarboPac PA200(50 mm×3 mm),色谱柱Bio-Rad Aminex HPX-87H(300 mm×7.8 mm),色谱保护柱Bio-Rad Cation H Refill Cartridges(30 mm×4.6 mm), Chromeleon 6.80色谱工作站,Dionex ICS-3000离子色谱仪,带有四电位脉冲安培检测器(PAD),美国Thermo Fisher公司; Ultrahydrogel 120 (300 mm×7.8 mm) 色谱柱和Ultrahydrogel 250 (300 mm×7.8 mm)色谱柱,美国Waters公司。
1.2 木聚糖酶水解残渣的高温自水解
将131 g木聚糖酶水解残渣(含木聚糖100 g)与水按1 ∶50(g ∶mL)混合,加入1.0 L高压反应釜,分别在170、180、190和200 ℃条件下保温20、30、40和50 min。反应结束后在高速冷冻离心机中于8 000 r/min下离心10 min,取上清液,即为高温自水解液。
1.3 水解液的乙醇沉淀分离
1.3.1不同体积分数的乙醇 向高温自水解液中加入一定量的乙醇,使乙醇最终体积分数分别达到10%、20%、30%、40%、50%、60%、70%、80%和90%,置于摇床上,于20 ℃下150 r/min混合15 min,再放于摇床上,20 ℃静置15 min,于8 000 r/min、20 ℃下离心10 min,收集上清液。沉淀再次分别使用对应沉淀分离时的乙醇润洗,并重复上述操作,于8 000 r/min、20 ℃下离心10 min,将沉淀置于冻干机中去除残余的乙醇,最后用蒸馏水溶解沉淀并定容至10 mL。
1.3.2两步沉淀分离 向高温自水解液中加入乙醇,使乙醇终体积分数达到60%,置于摇床上,于20 ℃ 下150 r/min混合15 min,再按1.3.1节方法得到沉淀及上清液,所得沉淀用蒸馏水溶解,记为样品S1;向60%乙醇沉淀高温自水解液离心分离所得上清液中继续加入乙醇,使乙醇终体积分数达到90%,置于摇床上,于20 ℃下150 r/min混合15 min,再按1.3.1节方法得到沉淀及上清液,所得沉淀用蒸馏水溶解,记为样品S2,上清液记为样品S3。
1.4 检测分析
1.4.1木聚糖含量的测定 向木聚糖溶液中加入H2SO4,使其质量分数达到4%,置于121 ℃高温灭菌锅中反应1 h,木聚糖降解为木糖[12]。采用带有示差检测(RID)的HPLC仪分析木糖含量,色谱条件:色谱柱Bio-Rad Aminex HPX-87H,色谱保护柱Bio-Rad Cation H Refill Cartridges,流动相0.005 mol/L的H2SO4,流速0.6 mL/min,柱温55 ℃,上样量10 μL,外标法测定。
低聚木糖(XOS,聚合度2~6)采用高效阴离子交换色谱法测定,色谱条件:色谱柱CarboPac PA200(250 mm×3 mm),色谱保护柱CarboPac PA200(50 mm×3 mm),流动相100 mmol/L的NaOH与500 mmol/L 的NaAc配比梯度洗脱[13],流速0.3 mL/min,柱温30 ℃,pH-Ag/AgCl复合参比电极,Chromeleon 6.80色谱工作站。XOS以木二糖、木三糖、木四糖、木五糖和木六糖为外标分别测定其含量,聚合度较高(聚合度大于6)的高聚木糖根据色谱柱CarboPac PA200的分离原理,按照保留时间逐渐延迟,可监测各成分的存在及变化情况。各聚糖质量浓度分别按以下公式计算:
C(木聚糖)=(C2-C1)×0.88
C(XOS)=C(木二糖)+C(木三糖)+C(木四糖)+C(木五糖)+C(木六糖)
C(高聚木糖)=C(木聚糖)-C(XOS)
式中:C1—酶解前木糖的质量浓度,g/L;C2—酶解后木糖的质量浓度,g/L。
1.4.2降解副产物含量的测定 木聚糖高温自水解液中甲酸、乙酸、羟甲基糠醛和糠醛的含量采用带有示差检测(RID)的HPLC仪分析,外标法测定,色谱条件同1.4.1节。
1.4.3低聚木糖聚合度的测定 乙醇沉淀分离后的样品S1、S2和S3组分采用Agilent 1260型HPLC仪,以Ultrahydrogel 120和Ultrahydrogel 250色谱柱串联,采用相对分子质量(Mr)342纤维二糖以及Mr分别为1 000、5 000、12 000、25 000和50 000的葡聚糖为标准样品,测定各分离组分Mr。色谱条件:流动相为去离子水,流速0.6 mL/min,柱温60 ℃,示差检测。低聚木糖的聚合度(Dp)按下式计算:
五是通过微博推广。凭借内容短小、发布快捷的特点,微博成为互联网极具影响力的信息发布平台。微博运营门槛低、信息发布迅速,是乡村旅游推广的有效手段。
Dp=Mr/150
1.5 青春双歧杆菌的体外增殖
向Bug Box厌氧培养箱内通入混合气(10%H2、5%CO2及85%N2)以除去箱体内的氧气,在厌氧条件下活化青春双歧杆菌并进行体外增殖。活化时以10 g/L葡萄糖为碳源,增殖时分别以乙醇沉淀分离得到的S1、S2和S3组分为碳源,初始碳源质量浓度3 g/L木聚糖。将活化36 h的青春双歧杆菌种母液转入增殖培养基中,调节初始pH值7.0,控制培养温度37 ℃,在增殖0、2、4、8、12、24和36 h时取样分析。
1.6 增殖效果分析
1.6.1菌体浓度的测定 吸取青春双歧杆菌活化36 h的种母液,于3 000 r/min条件下离心10 min,所得菌体先用生理盐水洗涤3次,再加入无菌水洗涤2次,最终加入无菌水混匀,配制不同浓度梯度的菌液,用分光光度计在600 nm波长下测定吸光度,同时用红外水分测定仪测定不同浓度菌液烘干后的菌体干质量,根据吸光度和菌体干质量绘制菌体质量浓度与吸光度之间的标准曲线。
定时取样青春双歧杆菌增殖液,于8 000 r/min条件离心10 min,所得菌体用生理盐水洗涤3次,混匀,于600 nm波长下测定吸光度,根据标准曲线计算增殖后青春双歧杆菌的菌体质量浓度。
1.6.2有机酸产量的测定 青春双歧杆菌增殖过程代谢产生的乳酸、乙酸、丙酸和丁酸等有机酸含量采用Agilent 1260型HPLC仪分析,色谱分析条件同1.4.1节。其中,总有机酸的含量即为4种有机酸含量之和。
2 结果与讨论
2.1 高温自水解液的组分分析
所用原料木聚糖酶水解残渣成分为:木聚糖76.61%,葡聚糖10.79%,阿拉伯聚糖3.45%,木质素7.26%,灰分0.61%。经不同高温自水解条件所得自水解液中各糖组分及降解副产物的质量分数如表1所示。
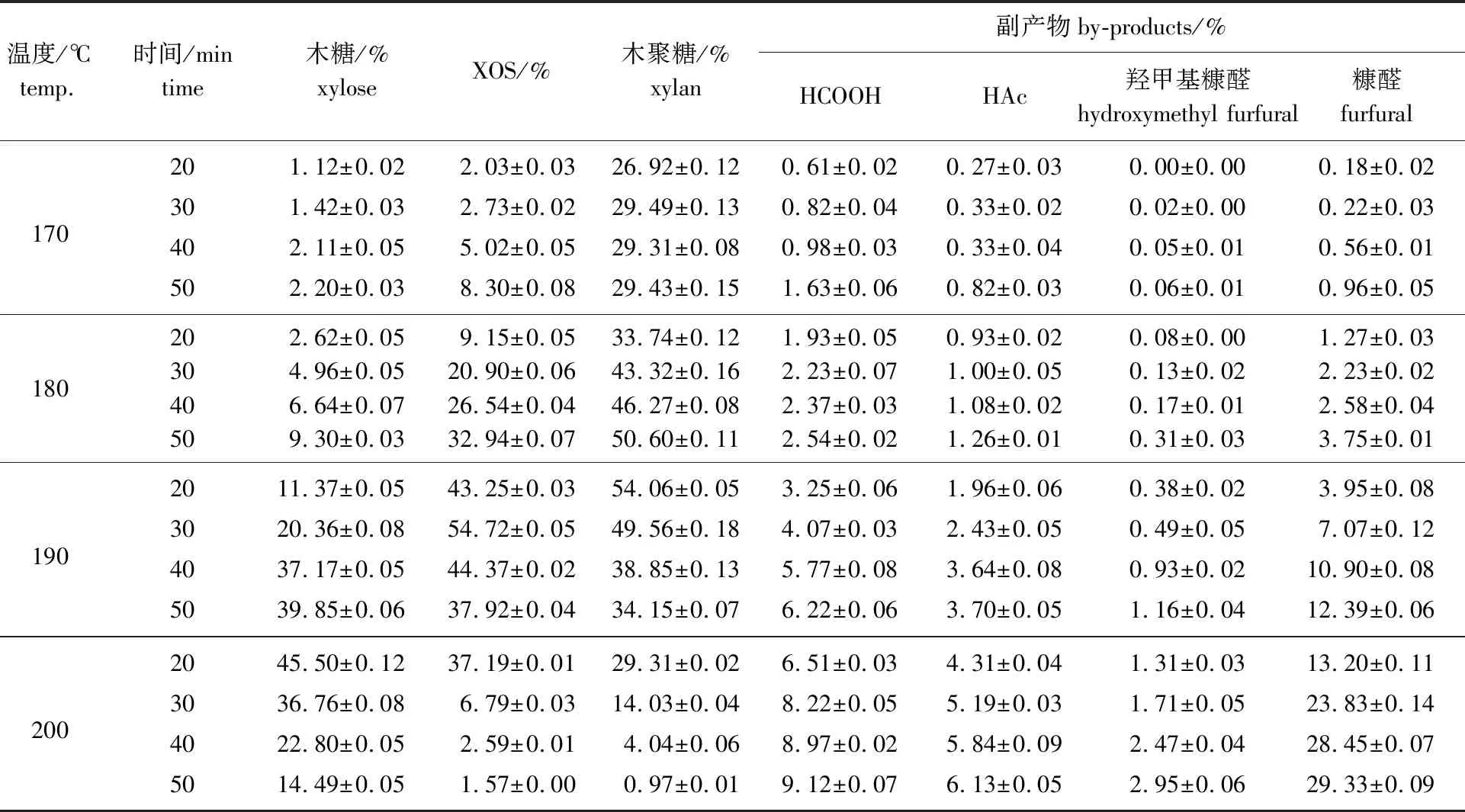
表1 工艺条件对高温自水解液成分的影响Table 1 Effect of process conditions on the composition of autohydrolysate
从表1可以看出,随着高温自水解温度的升高,水解液中XOS和木聚糖含量均呈先上升后下降的趋势,然而降解副产物甲酸、乙酸、羟甲基糠醛和糠醛含量则呈逐渐升高的趋势。温度180 ℃,保温时间40 min条件下,自水解液中XOS质量分数26.54%,木聚糖46.27%,在此条件下所产降解副产物甲酸、乙酸、羟甲基糠醛、糠醛和木糖质量分数分别为2.37%、1.08%、0.17%、2.58%和6.64%。继续升温,当温度为190 ℃,保温时间30 min时,自水解液中XOS质量分数达到最高,为54.72%,但在此条件下所产降解副产物含量却增加很多,表明增加反应温度使得XOS含量增加,同时降解副产物含量也大幅度增加。因此,剧烈的自水解条件将增加降解副产物含量,为后续产品提纯带来困难[8-9]。
木糖虽对双歧杆菌无毒害作用,但却很难被双歧杆菌所利用,木糖含量高影响低聚木糖产品的纯度和品质[14]。选择自水解条件时,希望得到的XOS含量较高,降解副产物(有害物质和木糖)较少,同时温度及相应的水蒸气压力在工业操作中易于实现。因此,温度180 ℃和保温时间40 min为合适的自水解条件,此时高温自水解液中XOS水解得率为26.54%(基于原料中木聚糖计算),XOS占水解液中总木聚糖的57.36%,剩下的42.64%可认为是Dp大于6高聚木糖。由此可见,木聚糖经高温自水解所得水解液中低Dp的木聚糖(即XOS)及高Dp的木聚糖含量都比较高,此结果与Xiao等[12]高温自水解竹子的研究结果类似,因此需采取措施进一步分离。
2.2 乙醇沉淀分离对水解液组成的影响
2.2.1乙醇体积分数 将木聚糖酶水解残渣180 ℃、40 min高温自水解,制得的1 L高温自水解液中含6.03 g XOS和10.52 g木聚糖,通过不同体积分数乙醇沉淀分离,测得沉淀和上清液中XOS及木聚糖质量如图1所示。
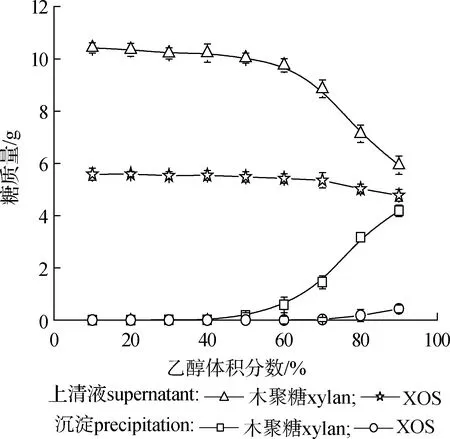
图1 乙醇体积分数对自水解液中糖得率的影响Fig.1 Effects of ethanol volume fraction on saccharides yield in autohydrolysates
采用乙醇沉淀多聚糖过程中,Mr大的聚糖比Mr小的聚糖更难溶解,Song等[15]采用不同浓度的乙醇溶液沉淀分离杉树中多聚糖时也得到相似的结果,原因可能在于Mr大的聚糖所含单位羟基数量比Mr小的聚糖所含单位羟基数量少[16]。为了将Dp范围广的高温自水解液分离为不同Dp范围的木聚糖组分,一步乙醇沉淀很难实现,需采用两步乙醇沉淀的方法。因此,后续实验采用乙醇两步沉淀法对高温自水解液进行分离。
2.2.2乙醇两步沉淀分离 分析样品S1、S2、S3中各糖组分含量及Dp范围,1 L高温自水解液中各成分的质量可见表2。
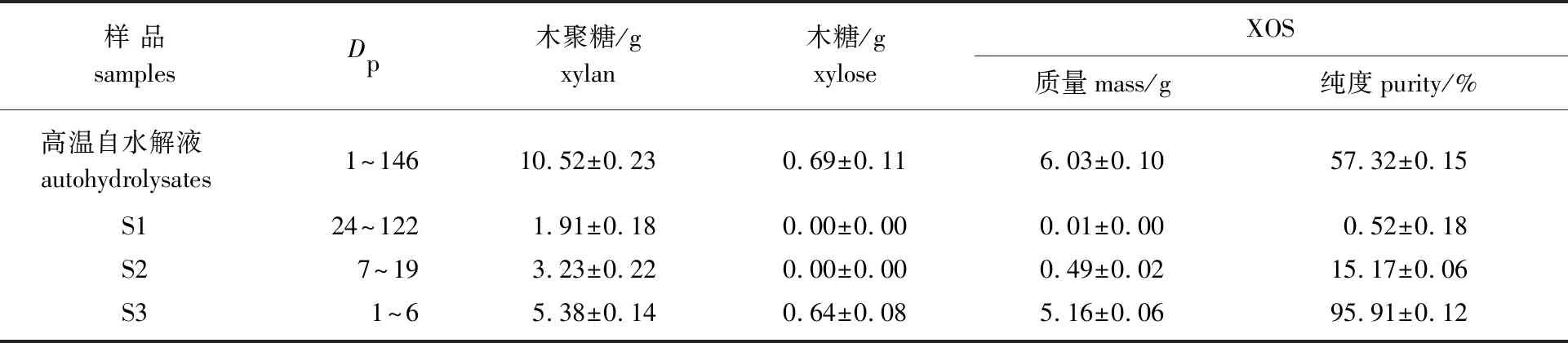
表2 乙醇两步沉淀分离对高温自水解液成分的影响(1 L高温自水解液)Table 2 Effects of two-step ethanol precipitation on the components from autohydrolysates(1 L autohydrdysates)
采用乙醇两步沉淀分离Dp分布范围广的高温自水解液(Dp为1~146),得到Dp范围分别为24~122、7~19和1~6的S1、S2和S3这3种组分,其中木聚糖质量各占高温自水解液中木聚糖质量的18.16%、30.70%和51.14%,S3中XOS得率最高,达87.61%,纯度高达95.91%。可见分离所得S3的Dp低、得率和纯度很高,适于作为产品级低聚木糖。因此,乙醇两步沉淀分离能够很好地实现不同Dp范围木聚糖的分离。Swennen等[17]也采用乙醇两步沉淀方式分离麦粉酶解液获得不同Dp范围的木聚糖。
2.2.3离子色谱分析 高温自水解液及乙醇两步沉淀分离所得样品S1、S2和S3的分析谱图如图2所示。根据CarboPac PA200阴离子色谱柱分离聚糖的特性,低聚木糖先出峰,随着出峰时间逐渐延长,高聚木糖随后逐渐出峰[18-19]。由图2(a)可见,高温自水解液中可检测到XOS组分(即图中X2、X3、X4、X5和X6),图中25.351 min及之后出现的色谱峰可推测为Dp>6的高聚木糖组分。
图2(b)~图2(d)显示,经乙醇两步沉淀分离所得S1、S2和S3样品中各木聚糖组分的分布情况不同。样品S3中糖组分主要为XOS,还有一定量的木糖(X1),出峰时间较迟、Dp>6的木聚糖组分在S3中几乎未检测到;样品S2中糖组分出峰时间主要位于25~31 min,其中27 min附近的色谱峰可认为是中等Dp的木聚糖,XOS在S2中含量非常低,只有少量木五糖和木六糖被检测到;样品S1中组分出峰时间主要位于30 min左右,可认为是高聚木糖组分。由此可见,Dp分布范围广的高温自水解液通过乙醇两步沉淀分离可得到3种不同的木聚糖组分,分别为XOS(S3)、中等Dp木聚糖(S2)和高Dp木聚糖(S1),实现不同Dp范围木聚糖组分的分离。
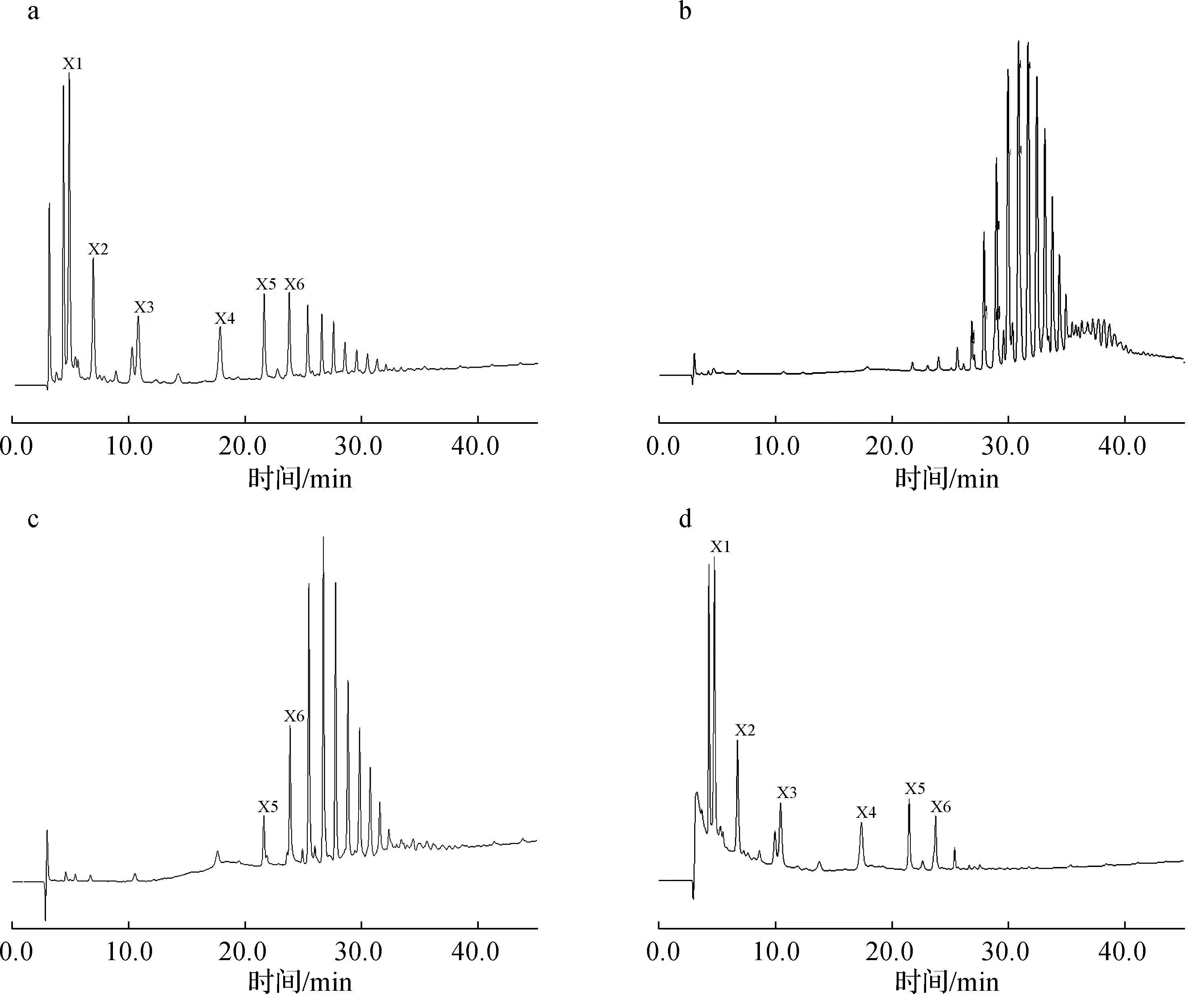
X1.木糖xylose; X2.木二糖xylobiose; X3.木三糖xylotriose; X4.木四糖xylotetraose; X5.木五糖xylopentaose; X6.木六糖xylohexaose a.高温自水解液 autohydrolysates; b.S1; c.S2; d.S3图2 不同样品的高效阴离子离子色谱图Fig.2 HPAEC-PAD chromatograms of different samples
2.3 青春双歧杆菌的体外增殖效果对比
葡萄糖是双歧杆菌最容易利用的碳源,然而葡萄糖进入动物体内到达消化道时就被消化酶降解而到达不了大肠中,其对存在于大肠内的益生菌起不到任何增殖作用,但可用于比较其它木聚糖组分的增殖效果。众多研究表明,XOS很难被消化道中的消化酶降解而能直接进入动物体内肠道中,在肠道中具有显著增殖双歧杆菌的效果[20-22]。将乙醇两步沉淀分离所得不同聚合度的木聚糖对青春双歧杆菌进行增殖效果的研究,结果如表3和图3所示。
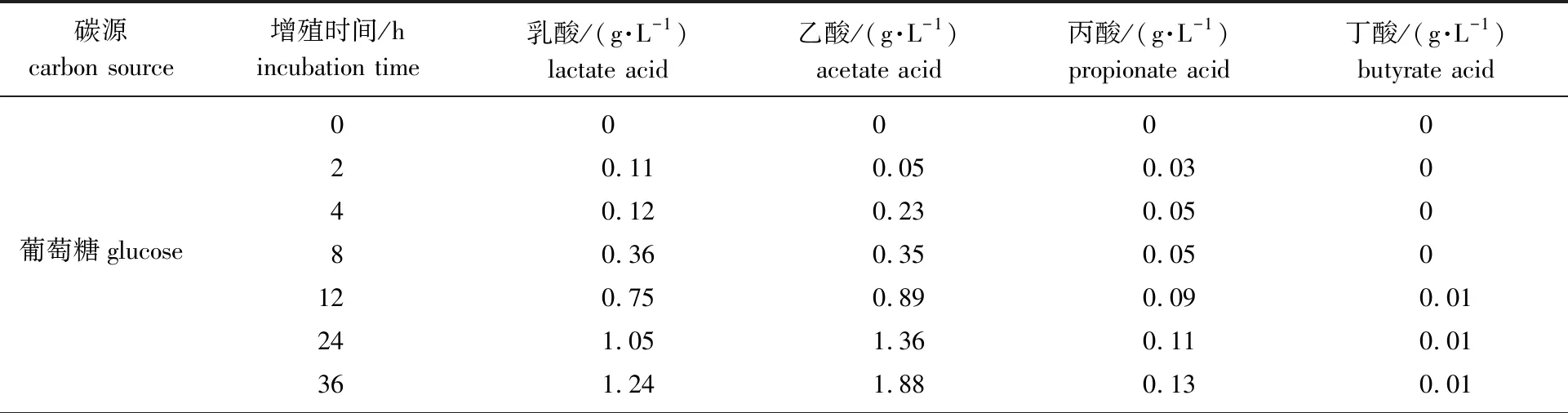
表3 不同碳源增殖青春双歧杆菌所产有机酸的含量Table 3 Contents of organic acids in the incubation of B. adolescentis with different carbon sources
续表3
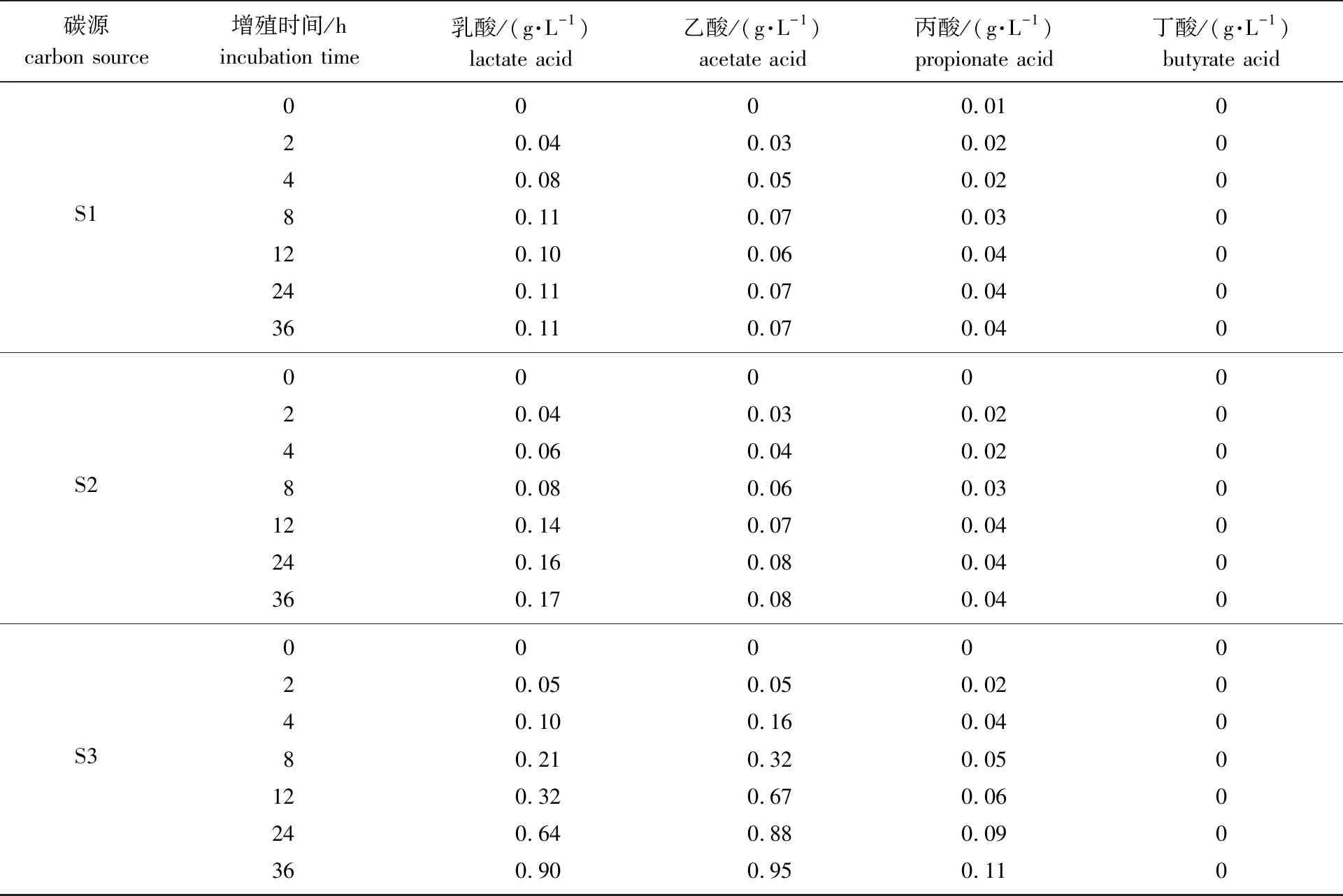
碳源carbon source增殖时间/hincubation time乳酸/(g·L-1)lactate acid乙酸/(g·L-1)acetate acid丙酸/(g·L-1)propionate acid丁酸/(g·L-1)butyrate acidS10000.01020.040.030.02040.080.050.02080.110.070.030120.100.060.040240.110.070.040360.110.070.040S20000020.040.030.02040.060.040.02080.080.060.030120.140.070.040240.160.080.040360.170.080.040S30000020.050.050.02040.100.160.04080.210.320.050120.320.670.060240.640.880.090360.900.950.110
从表3可以看出,青春双歧杆菌代谢葡萄糖、S1、S2和S3所产各有机酸中,乳酸和乙酸含量都较高,丙酸含量较少,丁酸在发酵过程中含量几乎不变。报道显示,益生菌代谢低聚糖产生的乳酸、乙酸、丙酸和丁酸等是主要的短链脂肪酸,对人体的生理功能起重要调节作用,具有改善肠功能、促进Ca2+吸收、促进脂肪代谢和减少患肠癌的风险,其中乙酸影响机体胆固醇的产生,丙酸和丁酸是机体能量的重要来源并调节细胞生长[23]。
如图3所示,葡萄糖增殖青春双歧杆菌效果最明显,36 h菌体质量浓度达0.35 g/L,菌体增殖倍数达6.60倍,此时葡萄糖全部被消耗完。S1和S2增殖青春双歧杆菌效果不明显,36 h菌体质量浓度分别为0.06 和0.08 g/L,菌体增殖倍数分别为1.13和1.51倍,残糖量较多,分别为97.16%和93.39%,表明S1和S2较难被青春双歧杆菌所利用。S3增殖青春双歧杆菌效果明显,36 h菌体质量浓度为0.25 g/L,菌体增殖倍数达4.72倍,残糖量为43.48%,与增殖效果最优的碳源葡萄糖相比,S3增殖效果也很显著,是一种很好的增殖青春双歧杆菌的益生元。S1和S2的木聚糖Dp范围分别为24~122和7~19,Dp较高,难以被青春双歧杆菌利用,而S3的木聚糖Dp范围为1~6,Dp较低,很容易被双歧杆菌利用。Gullón等[24]指出低聚糖的Dp对益生菌增殖效果起主要作用,Dp越低益生效果越好。这可能与双歧杆菌能够分泌β-木糖苷酶但不分泌内切木聚糖酶的原因有关[25],因而限制了对高Dp木聚糖的降解和利用。
不同碳源增殖青春双歧杆菌所产总有机酸含量不同。葡萄糖为碳源所产总有机酸含量最高,36 h总有机酸质量浓度达3.26 g/L,此时pH值为4.31;乙醇两步沉淀分离所得组分S1、S2和S3中,低聚合度的S3增殖青春双歧杆菌所产总有机酸含量最高,36 h总有机酸质量浓度达1.96 g/L(pH值5.65),虽然增殖效果不如葡萄糖,但其总有机酸产量、菌体增殖倍数、糖消耗量与以葡萄糖为碳源的产量基本相当。聚合度较高的S1和S2增殖青春双歧杆菌所产总有机酸质量浓度较低,分别为0.22和0.29 g/L。由此可见,S3增殖青春双歧杆菌效果明显,而S1和S2几乎起不到增殖青春双歧杆菌的效果。
对比不同Dp范围木聚糖对益生菌的增殖效果可以看出,木聚糖酶水解残渣在180 ℃、40 min条件下高温自水解得到的水解液经乙醇两步沉淀分离后,上清液S3主要含Dp为2~6的XOS,能被青春双歧杆菌有效利用,菌体增殖倍数高,有机酸产量高,是一种较好的益生元。Dp较高的S1和S2增殖青春双歧杆菌效果不明显,菌体浓度及各有机酸产量均较低。
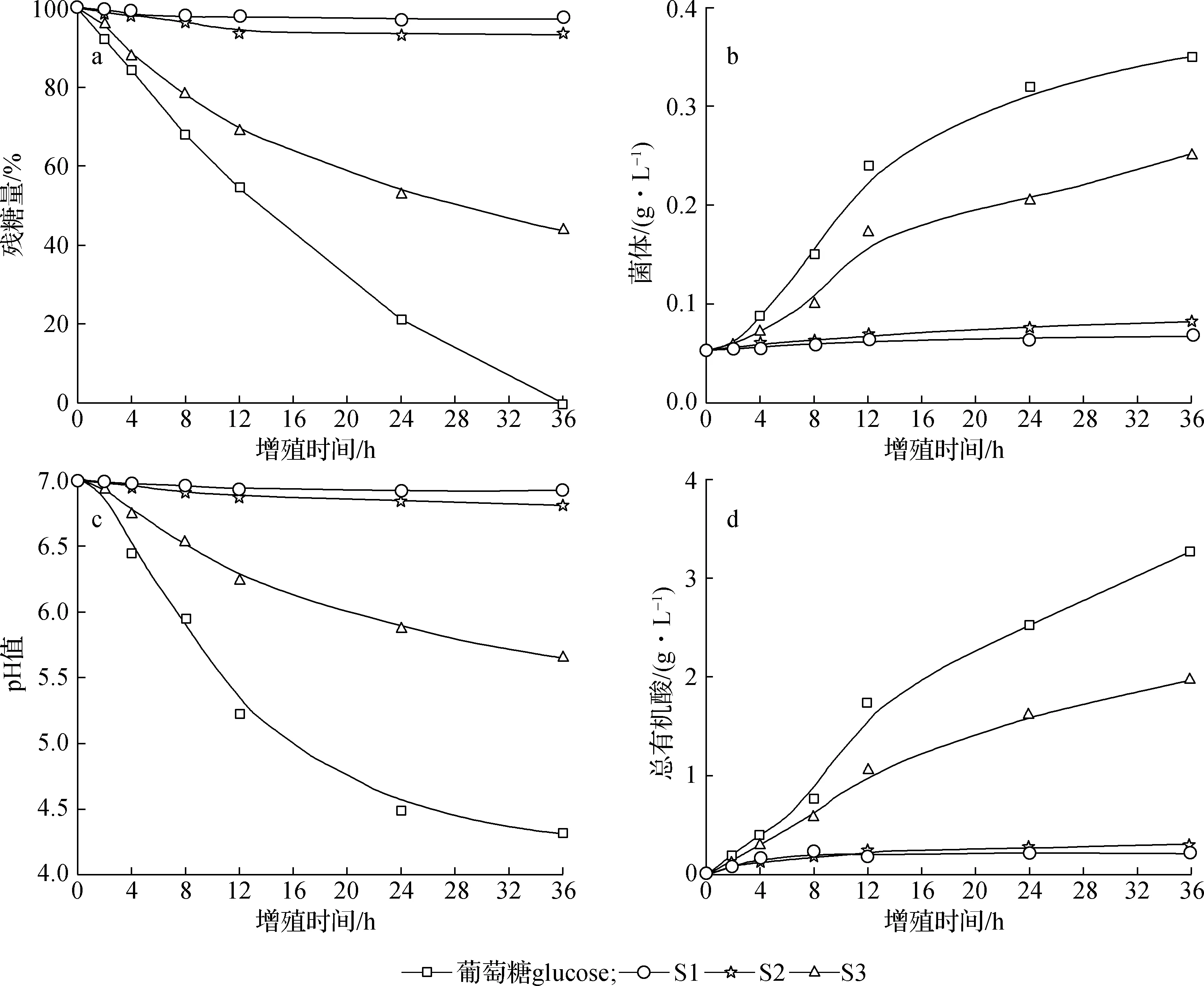
a.残糖量residual sugar content; b.菌体质量浓度biomass mass concn.; c.pH值pH value; d.总有机酸质量浓度total organic acid mass concn.图3 不同碳源对青春双歧杆菌增殖效果的影响Fig.3 Effects on the proliferation with B. adolescentis by using different carbon sources
3 结 论
3.1木聚糖酶水解残渣在不同条件下进行高温自水解,选择180 ℃、40 min为适合的条件,该条件下XOS含量高,降解副产物产量低,高温自水解液中XOS占水解液中总木聚糖质量分数的57.36%,XOS水解得率为原料中木聚糖质量分数的26.54%,降解副产物(有害物质)甲酸、乙酸、羟甲基糠醛和糠醛分别为原料中木聚糖质量的2.37%、1.08%、0.17%和2.58%。
3.2采用乙醇两步沉淀方式对高温自水解液进行分离,得到S1、S2和S3这3种木聚糖组分,其聚合度范围分别为24~122、 7~19和1~6。高效阴离子交换色谱分析显示,乙醇两步沉淀方式可将聚合度范围广的高温自水解液有效地分离。S1为聚合度高的木聚糖组分;S2几乎不含XOS,为中等聚合度的木聚糖组分;S3主要为聚合度2~6的低聚木糖组分,XOS纯度高达95.91%。
3.3青春双歧杆菌增殖结果表明:低聚合度的S3对青春双歧杆菌增殖效果最明显,36 h菌体质量浓度为0.25 g/L,菌体增殖倍数达4.72倍,残糖量为43.48%,总有机酸质量浓度达1.96 g/L,乳酸、乙酸和丙酸质量浓度分别为0.90、 0.95和0.11 g/L,丁酸未检测到,此时pH值为5.65。中等聚合度木聚糖组分S2和高聚合度木聚糖组分S1很难被青春双歧杆菌所利用,增殖效果不明显。
