超声数据3D打印制作二尖瓣模型的可行性
2020-05-03杨远婷宋宏宁陈思楷宋弯弯
杨远婷,宋宏宁,陈思楷,王 浩,宋弯弯,郭 娟,邓 倾,周 青
(武汉大学人民医院超声科,湖北 武汉 430060)
采用超声心动图可对瓣膜的解剖结构进行形态学观察和定量评估,有利于临床选择治疗方案,对诊断心脏瓣膜病并评估其严重程度和预后具有较高价值[1]。3D超声心动图发展很快,可通过二维屏幕显示瓣膜的3D图像,但对于全面、直观展示瓣膜解剖结构价值有限[2]。过去10年中,3D打印技术取得显著进步[3-4],并已越来越多地被用于心脏病学领域的临床教学[5]及手术决策[6]。本研究探讨以3D-经食道超声心动图(transesophageal echocardiography, TEE)为数据源,采用3D打印技术制作二尖瓣(mitral valve, MV)3D模型的可行性。
1 资料与方法
1.1 一般资料 回顾性分析2018年1—12月30例于武汉大学人民医院接受3D-TEE检查患者,男14例,女16例,年龄30~73岁,平均(56.2±9.7)岁;其中10例MV正常,MV狭窄及脱垂者各10例。纳入标准:①年龄>18岁,无TEE检查禁忌证;②左心室射血分数50%~60%;③3D-TEE图像完整、清晰显示MV结构;④窦性心律。
1.2 仪器与方法 采用GE Vivid E9彩色多普勒超声诊断仪,6VT经食管相控阵3D容积探头。于Echo Pac工作站进行图像传输与处理,以Mimics 19.0(Materialise, Leuven, Belgium)及3-Matic(Materialise, Leuven, Belgium)软件进行3D重建及后处理。3D打印采用JG AURORA打印机。
1.2.1 获取 3D-TEE图像 行咽部表面浸润麻醉后,嘱患者取左侧卧,置入食管超声探头。于食管中段水平调整探头角度及图像增益,当2D超声心动图清晰显示MV结构时,进入4D-Prepare模式,调整取样框大小,使之覆盖整个目标结构。在4D模式下采集5个心动周期的MV容积图像(图1A),导入Echo Pac工作站存盘进行分析。
1.2.2 3D-TEE图像后处理 通过Echo Pac工作站导出舒张末期MV容积图像,采用Mimics 19.0对图像进行阈值分割,能清晰分离MV时为最佳阈值范围,于此进行微调,使MV尽量包括在容积遮罩(Mask)内。通过新建1个交互式平面确定瓣环位置,并进行描点标记,再使用手动编辑工具对图像进行优化,创建MV 3D数字模型(图1B)。
1.2.3 MV 3D模具制作 将数字模型导入3-Matic,通过扩容及布尔运算设计MV模具3D数字模型,以标准镶嵌语言(standard tessellation language, STL)格式保存并传输至3D打印机后,用可溶性材料(聚乙烯醇)打印出MV 3D模具(图1C)。
1.2.4 MV 3D模型制作 采用硅胶灌注成型方式制作软质MV模型。将皮肤胶、硅油、固化剂按比例混合,搅拌均匀后放入排气装置,用注射器抽取除气后的皮肤胶,自模具灌胶口注入,溢出时证明已灌注完全。将模具静置约3~5 h,待皮肤胶成型后,将其放入常温水槽中,模具溶解后得到软质MV 3D模型(图1D)。
1.3 评价参数 由2名超声科主治医师在随机双盲情况下测量所有参数。
1.3.1 MV 3D-TEE参数 进入Echo Pac工作站,启动Flexi Slice显像功能(图2A),测量3D-TEE图像中的MV前后直径(anterior and posterior diameter, AP)、前外后内直径(anterolaterior and posteromedial diameter, ALPM)、周长(perimeter, P)、面积(area,A)及瓣膜开放幅度(MV opening width, MVOW)(图2B),每个参数测量3次,取平均值作为最终结果。
1.3.2 MV 3D模型参数 使用游标卡尺分别测量MV的AP、ALPM及MVOW(图3A);以软铝丝按照MV环塑形,软铝丝面积即为瓣环A;展开软铝丝,其长度即为二尖瓣环P(图3B)。
1.4 统计学分析 采用SPSS 24.0及MedCalc软件进行统计学分析。计量资料以±s表示,以配对t检验比较MV 3D模型与3D-TEE图像参数。采用Bland-Altman分析检验3D模型与3D-TEE图像测值的一致性。以组内相关系数(intraclass correlation coefficient, ICC)评价2名观察者间及观察者内测值的重复性。P<0.05为差异有统计学意义。

图1 3D打印制作软质MV模型流程图 A.MV 3D-TEE容积图像; B.3D重建及后处理的MV 3D数字模型; C.MV 3D模型的模具(箭示灌胶入口); D.软质MV 3D模型
2 结果
30例3D-TEE容积数据均成功后处理,并以1∶1尺寸制作出MV 3D模型(图4~6)。
MV正常、狭窄及脱垂者3D模型与3D-TEE图像间MV参数测值差异均无统计学意义(P均>0.05,表1)。Bland-Altman分析结果显示,MV正常者3D模型与3D-TEE图像测值一致性界值分别为:AP(-0.59 mm, 0.71 mm)、ALPM(-0.88 mm,0.72 mm)、P(-0.69 mm,0.87 mm)、A(-0.91 mm2,0.71 mm2)、MVOW (-0.07 mm,0.09 mm);MV狭窄者一致性界值分别为:AP(-0.10 mm,0.14 mm)、ALPM(-0.14 mm,0.14 mm)、P(-0.12 mm,0.24 mm)、A(-0.10 mm2,0.14 mm2)、MVOW(-0.09 mm,0.11 mm);MV脱垂者一致性界值分别为:AP(-0.13 mm,0.20 mm)、ALPM(-0.13 mm,0.24 mm)、P(-0.16 mm,0.22 mm)、A(-0.08 mm2,0.15 mm2)、MVOW(-0.09 mm, 0.12 mm)。
针对3D模型测量MV的AP、ALPM、P、A及MVOW时,2名观察者间ICC分别为0.91、0.92、0.96、0.90、0.94,观察者内ICC分别为0.93、0.92、0.94、0.90、0.95。
MV正常、狭窄及脱垂者中,3D模型与3D-TEE图像间MV的AP、ALPM、P、A及MVOW参数测值的绝对差值均较小(表2)。
表1 MV 3D模型与3D-TEE图像参数测值比较(±s)

表1 MV 3D模型与3D-TEE图像参数测值比较(±s)
MV状态AP(mm)ALPM(mm)P(mm)A(mm2)MVOW(mm)正常MV(n=10) 3D模型23.97±1.3832.70±2.3389.19±3.8455.60±2.8021.44±0.69 3D-TEE图像23.91±1.2932.78±2.2589.10±3.9055.70±2.8221.35±0.95 t值-0.570.62-0.720.78-0.68 P值0.580.550.490.460.52MV狭窄(n=10) 3D模型28.16±3.7634.94±3.22101.47±9.8989.91±1.437.57±0.84 3D-TEE图像27.98±3.7334.91±3.13100.06±9.4289.70±2.827.63±0.79 t值-0.13-0.94-0.60-1.090.38 P值0.900.370.140.300.72MV脱垂(n=10) 3D模型29.10±2.2036.36±5.53106.47±1.5089.45±1.1823.03±1.40 3D-TEE图像28.75±2.1835.79±5.62106.21±1.4789.10±1.1022.87±1.63 t值-1.89-1.31-0.85-1.92-0.93 P值0.090.220.420.120.38
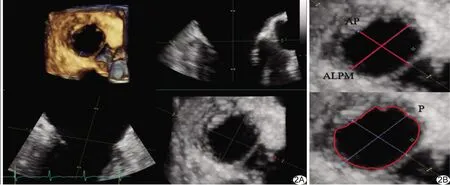
图2 3D-TEE图像参数测量 A.Flexi Slice显像,通过调节瓣环左右径和上下径定位线,在短轴确定瓣环的位置; B.测量MV周长P及面积A

MV状态AP绝对差值(mm)ALPM绝对差值(mm) P绝对差值(mm)A绝对差值(mm2)MVOW绝对差值(mm)MV正常(n=10)0.98±0.540.26±0.270.84±5.430.17±0.650.19±0.64MV狭窄(n=10)0.15±0.820.25±0.740.56±1.070.43±0.620.48±0.58MV脱垂(n=10)0.64±1.030.46±0.830.37±1.020.24±0.550.38±0.63

图3 测量MV 3D模型参数 A.以游标卡尺测量MV 3D模型的前外后内直径; B.以软铝丝按照MV环塑形,测量展开的铝丝长度,即为MV 3D模型的周长
3 讨论
3D打印是将可成型材料以逐层叠加方式结合起来制造出3D立体模型的技术[7]。CT图像具有较高的空间分辨率和密度分辨率,常作为心脏模型获取的影像数据源[8]。超声心动图在显示心脏瓣膜方面比CT和MR更具有优势[9]。利用3D-TEE图像为数据源制作MV 3D模型,有利于为临床提供直观的瓣膜模型。
3D打印过程涉及多个流程,从图像采集到模型制作,其中任何一个步骤均可影响3D模型的准确性。高质量超声容积数据是3D打印的前提。采集图像时,应尽可能使目标区域与超声束垂直,获取从左心房面或左心室面视角的3D数据图像,以减少回声失落现象。阈值分割是3D打印的关键,可先确定能包含MV结构的阈值范围,对于未显示的瓣膜结构,可按照已显示瓣膜的阈值进行多平面编辑。在优化过程中,还应仔细辨别目标区域的边界及噪声[10]。
随着医学技术的发展,治疗MV瓣膜病的方法已逐步扩展到心内直视手术之外,经导管修复瓣膜越来越显示出其优势[11];术前更直观了解瓣膜并进行演练有利于提高治疗一次成功率,也可预测操作过程中可能存在的风险。VUKICEVIC等[12]利用3D-TEE数据打印出1例MV重度关闭不全患者的MV 3D模型,并在模型上成功模拟了经导管MV修复术(MitraClip)。ROTMAN等[13]打印主动脉瓣钙化3D模型,将其置入模拟血管系统中,用于培训医师,使其熟练掌握经导管主动脉瓣置换术。
现有制作MV 3D模型的常用方法是直接打印和铸模成型[11]。为更好地用于手术训练,打印瓣膜的材料必须柔韧且具有足够弹性,而使用丙烯腈丁二烯苯乙烯直接打印的固体塑料模型不具备上述特点。目前已实现使用软性材料直接打印瓣膜模型,但需要特定且昂贵的3D打印机及打印材料[14]。本研究采用铸模硅胶灌注成型方法制作软质MV 3D模型,初步证实应用3D-TEE为数据源制作MV 3D模型是可行的,MV正常、狭窄及脱垂者MV 3D模型与源数据参数测值一致性均较高。与3D超声心动图中的3D重建相比,3D模型能更好地展示瓣膜形态。
本研究的局限性:①比较了3D模型与源数据之间的一致性,但未与金标准或瓣膜标本上的测量值进行对比;②因MV瓣下结构(腱索、乳头肌)在3D-TEE图像采集过程中与超声束处于平行状态[12],不能清晰进行3D重建,故本研究制作的MV 3D模型仅包括瓣叶结构。

图4 MV正常患者,男,32岁,MV 3D模型 A.左心室面观; B.左心房面观 图5 患者女,44岁,风湿性心脏瓣膜病致MV狭窄,MV 3D模型 A.左心室面观可见瓣口呈鱼口状改变(*示前后瓣交界融合部位); B.左心房面观 图6 患者男,51岁,MV脱垂,MV 3D模型 A.左心室面观可见瓣环径明显增大; B.左心房面观(*示瓣叶脱垂部位)
本研究探索3D-TEE作为制作MV 3D模型的影像学数据源的可行性,初步结果显示此法可全面展示MV解剖形态,MV 3D模型各径线测值与源数据测值的一致性好。相信随着研究的深入和完善,MV 3D模型在临床教学、术前决策及手术演练等方面将有更好的应用前景。
