AgClZnOGO光催化降解甲基橙的性能研究
2020-05-02朱秋蓉何世颖赵晓蕾唐婉莹宋小宝薛利红杨林章
朱秋蓉,何世颖,赵晓蕾,唐婉莹,宋小宝,薛利红,杨林章
1.南京理工大学化工学院,江苏 南京 210094 2.江苏省农业科学院农业资源与环境研究所,江苏 南京 210014
近年来,随着印染、纺织、皮革制造等行业的快速发展,染料废水的排放量也日渐增加,由其引起的环境问题也愈加严重[1].染料废水具有色度大、有机物含量高、“三致”毒性等特点[2-3],如果处理不当会严重污染环境,进而威胁到人类健康.常用染料废水的处理方法有生物法和物化法,但生物法降解缓慢,而物化法又无法将污染物彻底降解[4-6].在环境污染和能源危机日趋严重的今天,人们趋向于研究处理工艺简单、无二次污染、经济效益高的技术.
光催化降解技术因具有能耗低、操作简单、反应条件温和以及二次污染少等优点,在降解各种水污染物(如抗生素、农药和有机染料)等方面逐渐引起广大研究者的关注[7].光催化降解技术的基本原理是半导体光催化剂吸收太阳光的能量后,产生光生电子-空穴,然后被周围环境中的O2、H2O等电子受体捕获,产生大量的自由基[8](如·O2-、·OH等),它们具有很强的氧化还原能力,能有效地将复杂难降解的污染物降解为简单的化合物,最终矿化为CO2和H2O[9].
目前常用的半导体光催化剂有TiO2、WO3、Fe2O3、CdS、ZnO等[10-14].其中,ZnO因具有直接带隙、高电子迁移率、良好的物理和化学稳定性、廉价且无毒等优异的性能而被广泛研究[15];但其禁带宽度宽(3.2 eV)只能吸收紫外光,对太阳能利用率低,而且光生载流子的复合概率较高,使其光催化活性降低,易被光腐蚀且不易分离回收[16].针对以上不足,研究者提出了很多的改性方法,如掺入金属或非金属、贵金属沉积、与其他半导体复合形成异质结、负载到碳材料上等方法.近年来,AgX(X表示Cl、Br、I)材料被证明是一种新型高效的可见光催化剂,但由于其价格昂贵而且性质不稳定,使其在光催化领域的应用受到了很大的限制[17];将AgX与其他半导体复合,不仅能改善其他半导体光催化剂的性能,也能提升自身稳定性.此外,GO因其具有较大的表面积[18],往往用作半导体材料的载体.该研究将AgCl沉积于ZnO表面后负载到GO上,通过AgCl和GO的协同作用,能够更好地增强ZnO的光催化性能,在增加ZnO可见光吸收强度的同时,增加了其分散性、稳定性及其对污染物的吸附率.因此,该研究结果对促进光催化技术的实际应用具有重要指导意义.
1 材料与方法
1.1 材料与仪器
材料:Zn(NO3)2·6H2O购自成都市科龙化工试剂厂;DMF(N,N-二甲基甲酰胺)、尿素、NaCl购自南京化学试剂有限公司;GO购自上海源叶生物科技有限公司;C6H5Na3O7·2H2O、AgNO3、MO购自国药集团化学试剂有限公司.以上试剂均为分析纯.
仪器:XRD分析采用德国Bruker公司的D8 ADVANCE 型X射线衍射仪;扫描电子显微镜(SEM)采用日本HITACHI公司的EVO-LS10扫描电镜;光电子能谱(XPS)采用美国赛默飞世尔公司的EscaLab 250Xi 能谱仪;紫外-可见漫反射光谱(DRS)分析采用美国赛默飞世尔公司的Evolution 220紫外分光光度计.
1.2 AgCl/ZnO/GO光催化剂的制备
球形ZnO通过水热法[19]制备:称取2.23 g Zn(NO3)2·6H2O、0.44 g C6H5Na3O7·2H2O、1.80 g尿素溶于160 mL去离子水中;磁力搅拌1 h,超声10 min,将溶液倒入200 mL聚四氟乙烯水热反应釜中,120 ℃下恒温反应6 h;然后将产物用去离子水和无水乙醇各洗3次,离心,于80 ℃鼓风干燥箱中干燥12 h,再在300 ℃下煅烧2 h,得到球形ZnO.
AgCl/ZnO的制备:将0.20 g球形ZnO溶于20 mL去离子水中,用NH3·H2O调节pH为10,超声10 min;然后加入适量的AgNO3,在黑暗条件下磁力搅拌1 h,再逐滴加入20 mL与AgNO3浓度相同的NaCl溶液,磁力搅拌1 h;最后将产物用去离子水和无水乙醇各洗3次,离心,于55 ℃真空干燥箱中干燥12 h.
AgCl/ZnO/GO(ZnO/GO)的制备:取60 mL DMF,加入0.02 g GO,超声1 h,再加入0.20 g AgCl/ZnO(ZnO),超声30 min;然后在100 ℃油浴锅中反应1 h,将产物用去离子水和无水乙醇各洗3次,离心,于60 ℃真空干燥箱中干燥12 h.根据AgNO3与ZnO的物质的量的比分别为2∶1、1∶1、1∶2、1∶4,将复合材料分别记为AgCl/ZnO/GO(2∶1)、AgCl/ZnO/GO(1∶1)、AgCl/ZnO/GO(1∶2)、AgCl/ZnO/GO(1∶4).AgCl/ZnO/GO形成的机理如图1所示.
1.3 可见光催化活性评价
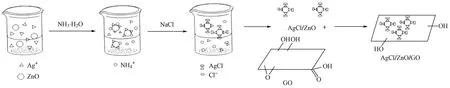
图1 AgClZnOGO形成机理示意Fig.1 Schematic diagram of the formation mechanism of AgClZnOGO
以MO为目标污染物,探究AgCl/ZnO/GO光催化材料的可见光催化性能.取40 mL 10 mg/L的MO溶液于50 mL石英管中,加入一定量催化剂,同时,为了减少在可见光照射下MO自身降解带来的误差,试验设置了不加任何催化剂的空白对照组;然后将石英管放入八位光化学反应仪中,在黑暗条件下磁力搅拌30 min以达到吸附平衡.采用140 W金卤灯作为可见光光源(光源放置在冷阱中,保证反应过程中的温度恒定;石英管与灯源之间装有可见光滤光片,滤掉λ<420 nm的光),在室温条件下,可见光照射50 min,每隔10 min取一次样,一次取3 mL,0.45 μm微孔滤膜过滤,用紫外分光光度计测定滤液在λ=464 nm处的吸光度.用式(1)~(3)计算不同染料的去除率:
η0=(C0-C1)/C0×100%
(1)
η1=(C1-Ct)/C1×100%
(2)
η=(C0-Ct)/C0×100%
(3)
式中:η0为吸附去除率,%;η1为光催化降解率,%;η为总去除率,%;C0为MO的初始浓度,mg/L;C1为暗反应30 min后反应液中MO的浓度,mg/L;Ct为光照下时间为t时反应液中MO的浓度,mg/L.所有反应均设置3个平行试验.在此过程中,考察了AgCl含量〔AgCl/ZnO(二者物质的量的比)为1∶4、1∶2、1∶1、2∶1〕、催化剂投加量(0、10、20、30、40、50、70、90 mg)和溶液pH(4、6、7、8、10)对MO降解率的影响.
2 结果与讨论
2.1 催化剂的结构表征分析
2.1.1XRD分析图2是ZnO和AgCl/ZnO/GO(2∶1)、AgCl/ZnO/GO(1∶1)、AgCl/ZnO/GO(1∶2)、AgCl/ZnO/GO(1∶4)的XRD衍射图谱.由图2可见,通过水热法制备的ZnO呈六方纤锌矿结构,其衍射峰与标准图谱(JCPDS 00-036-1415)的峰位完全一致.与ZnO相比,AgCl/ZnO/GO三元复合材料的XRD衍射峰则多了2θ为27.9°、32.3°、46.3°、54.9°、57.6°、67.5°、74.6°、76.8°几个峰,它们分别对应AgCl的(111)(200)(220)(311)(222)(400)(311)(420)晶面[20],其峰形高且窄,说明复合材料中成功引入了结晶度良好的AgCl;而且,随着AgCl含量的增加,ZnO的峰强逐渐变弱,而AgCl的峰强则逐渐变强,但是ZnO的峰位并没有发生改变,说明其与AgCl、GO复合并没有改变ZnO的晶型.在AgCl/ZnO/GO的XRD图谱中并未发现关于GO的衍射峰,可能是因为复合材料中GO含量较少,除此以外并没有其他杂质峰的出现,说明合成材料纯度较高.
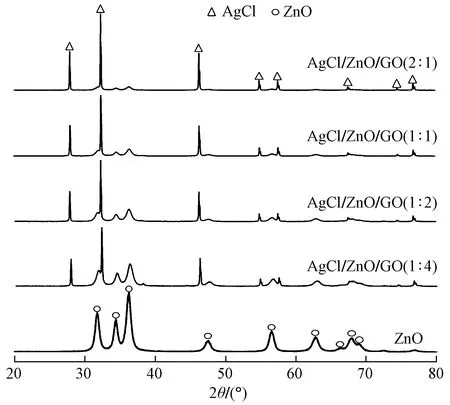
图2 合成材料的XRD图Fig.2 XRD patterns for synthetic samples
2.1.2SEM和TEM分析
采用SEM和TEM对ZnO、AgCl/ZnO(2∶1)、GO、AgCl/ZnO/GO(2∶1)这几种材料的形貌进行表征,结果如图3所示.图3(a)是用水热法制备的球形ZnO,其直径为3~4 μm,表面纹理较多,呈多孔状;图3(b)(e)分别为AgCl/ZnO(2∶1)二元复合材料的SEM和TEM结果,可以看出,在二元复合物中,AgCl为近球形,直径为50~100 nm,比较均匀地负载到了球形ZnO表面.图3(c)是GO的SEM结果,呈薄片状;图3(d)(f)分别为AgCl/ZnO/GO(2∶1)三元复合材料的SEM和TEM结果,TEM结果中浅灰色的薄膜是剥离的GO薄片,上面分散着部分因超声处理而脱落的AgCl颗粒,GO表面的黑色区域为AgCl/ZnO(2∶1),由SEM和TEM结果可以看出,AgCl/ZnO(2∶1)较为紧密地负载到了薄层状GO表面.
2.1.3XPS分析


图3 不同材料的电镜图Fig.3 SEM and TEM photos of different materials
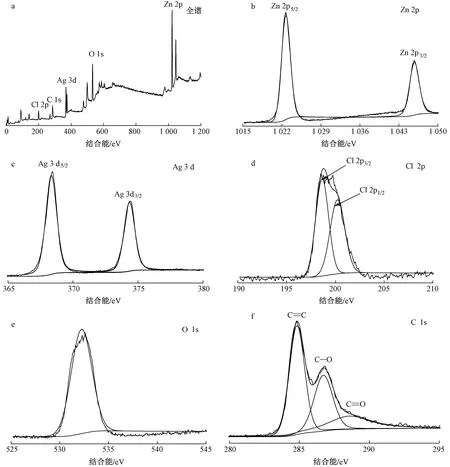
图4 AgClZnOGO(2∶1)的全谱及Zn 2p、Ag 3d、Cl 3d、O 1s 和C 1s的XPS图谱Fig.4 Full spectra of AgClZnOGO(2∶1) composites and spectra of Zn 2p,Ag 3d,Cl 3d,O 1s,C 1s by XPS

图6 ZnO和不同AgCl含量催化剂对MO的可见光催化降解曲线以及一级动力学拟合曲线Fig.6 Visible-light catalytic degradation curves and first-order kinetic fit curves of methyl orange by ZnO and catalysts with varying contents of AgCl
2.1.4UV-Vis分析
图5为ZnO、AgCl/ZnO(2∶1)和各AgCl/ZnO/GO(AgCl含量不同)光催化材料的紫外-可见吸收光谱图.由图5可以看出,ZnO仅在紫外光区有吸收,当负载AgCl以后,在λ=500 nm左右有一个明显的吸收峰,可见AgCl与ZnO形成异质结后,窄带隙半导体AgCl作为增感剂[24]使ZnO对光的吸收红移到了可见光区;与AgCl/ZnO光催化剂相比,AgCl/ZnO/GO光催化材料的吸收边缘向更长的波长发生了红移,说明GO的负载进一步增强了材料对可见光的吸收,这可能是因为,GO是良好的光电子受体,高效转移ZnO产生的光生电子降低了光生电子-空穴的复合能量[25],而且随着AgCl含量的增加,AgCl/ZnO/GO光催化材料对可见光的吸收增强,其中AgCl对ZnO可见光吸收增强的效果比GO更为显著.

图5 不同材料的紫外-可见吸收光谱图Fig.5 Diffuse reflectance spectra of different nanocomposites
2.2 催化剂可见光催化降解MO
2.2.1AgCl含量对MO去除率的影响
AgCl含量对MO降解的影响如图6所示.由图6(a) 可以看出,MO的降解率随着AgCl含量的增加而增加;在可见光照射50 min后,AgCl/ZnO/GO(2∶1)光催化材料对MO的降解率达98.93%.为了更好地理解MO降解的反应动力学特征,以-ln(C/C1)(C为光照时间为t时溶液中MO的浓度)对反应时间t进行线性拟合,结果如图6(b)所示,可知不同AgCl含量的AgCl/ZnO/GO光催化材料对MO的降解过程均符合准一级反应方程,AgCl/ZnO/GO(1∶4)、AgCl/ZnO/GO(1∶2)、AgCl/ZnO/GO(1∶1)和AgCl/ZnO/GO(2∶1)对MO的降解速率常数分别为 0.023 5、0.032 6、0.059 6、0.094 0 min-1,其中AgCl/ZnO/GO(2∶1)的催化降解速率常数最大,说明AgCl含量对MO的去除能力有很大影响,这与AgCl作为光敏剂,对可见光具有很好的吸收有关.当AgCl/ZnO/GO光催化材料中AgCl/ZnO增至1∶1时,对MO已经达到了很好的降解效果;当AgCl/ZnO增至2∶1时,虽然其光催化降解性能有所提高,但不显著,从绿色环保和经济实用角度出发,不再探究继续增加AgCl含量对降解效果的影响.
2.2.2不同材料对MO的催化降解效率
为了进一步探究AgCl和GO对ZnO可见光催化降解性能的影响,进行了可见光照射下不同材料对MO的降解试验.ZnO、ZnO/GO、AgCl/ZnO(2∶1)、AgCl/ZnO/GO(2∶1)对MO的光催化降解性能如图7所示.由图7(a)可知,在未添加任何催化剂的空白对照试验中,MO浓度基本没有变化,说明光照不会引起MO的降解;ZnO在可见光下的光催化能力较弱,GO负载和AgCl沉积都能提高ZnO的可见光催化活性,其中以AgCl/ZnO/GO(2∶1)的光催化能力为最强.图7(b)是以-ln(C/C1)为纵坐标、t为横坐标,不同材料对MO降解效率进行的一级动力学拟合曲线,其中,ZnO、ZnO/GO、AgCl/ZnO(2∶1)、AgCl/ZnO/GO(2∶1)对MO的降解速率常数分别为0.006 1、0.008 1、0.024 5、0.094 0 min-1,AgCl/ZnO/GO(2∶1)的催化降解速率常数最大,分别是AgCl/ZnO(2∶1)、ZnO/GO、ZnO的3.8、11.5、15.4倍.光催化剂的降解性能主要取决于光生电子-空穴的产生与分离,AgCl的加入能显著扩宽ZnO的光响应范围,使其对可见光的吸收加强,从而使光生电子-空穴的产生速率加快;同时,因为GO具有较大的表面积和较好的导电性,AgCl/ZnO(2∶1)与GO的复合能使光生电子-空穴快速分离,降低其复合率.由图8可以看出,ZnO电极在可见光照射下表现出非常微弱的光电流响应,而制备的AgCl/ZnO/GO(2∶1)光催化材料的光电流响应要强很多,说明AgCl/ZnO/GO(2∶1)在可见光照射下,其光生电子-空穴的生成和分离效率更高,进一步说明GO和AgCl均能明显改善ZnO的可见光催化活性.所以,与其他材料相比,AgCl/ZnO/GO(2∶1)表现出了优异的可见光催化降解性能.
表1比较了7种材料对MO的去除能力,其中暗吸附阶段的结果表明,GO的负载使得材料对MO有较高的吸附率,AgCl的沉积在提高材料的光催化降解率方面起了更重要的作用,因此,AgCl/ZnO/GO三元复合材料将三者的优势结合了起来,产生协同效应,显示出最佳的MO去除能力.

图7 不同材料对MO的可见光催化降解曲线和一级动力学拟合曲线Fig.7 Visible-light catalytic degradation curves and first-order kinetic fit curves of methyl orange with different materials
2.2.3催化剂用量对MO光催化降解率的影响
向40 mL 10 mg/L的MO溶液中分别加入0、10、20、30、40、50、70、90 mg的催化剂AgCl/ZnO/GO,在室温、pH为7的条件下暗吸附30 min,可见光照射50 min,考察催化剂用量对MO光催化降解的影响,结果如图9所示.由图9可见,当催化剂用量从10 mg增至70 mg时,MO的光催化降解率明显提高;当催化剂用量达到70 mg时,催化降解效果最好,仅用30 min就将MO完全降解了;但当继续增加催化剂用量时,催化降解效率又下降了.这是由于随催化剂用量增加,催化剂表面的活性位点也增加了,单位时间内产生的活性物质增加,同时还增加了催化剂与MO的接触概率,因此光催化效率提高;催化剂用量过多时,会降低反应液的透明度,从而减少对光的利用率[26],导致催化降解效率降低.因此,在该试验条件下,AgCl/ZnO/GO光催化材料的最佳用量为70 mg.
2.2.4pH对MO光催化降解率的影响
取40 mL 10 mg/L的MO溶液,调节pH分别为4、6、7、8、10,分别加入40 mg AgCl/ZnO/GO,在室温下暗吸附30 min,可见光照射50 min,考察pH对MO光催化降解效果的影响,结果如图10所示.由图10可知,在该试验条件下,pH对MO的降解没有显著影响.在pH为7时,AgCl/ZnO/GO对MO的催化降解效率达到最高,随pH的增大或减小,其催化降解效率均有所降低.该现象与催化剂的稳定性、表面所带电荷和染料性质以及溶液中OH-浓度均有关系.其中,最主要的原因是,AgCl/ZnO/GO在酸性和碱性条件下易发生光化学腐蚀,导致其催化降解活性有所降低[27];而且酸性条件下,溶液中的OH-浓度较低,复合材料产生的空穴与其反应生成的·OH较少[28],不利于MO的光催化降解;而在较高pH下,催化剂表面带有大量的负电荷,它与属于阴离子型染料的MO之间存在静电斥力,导致染料的吸附量减少[29],催化降解效率降低.该研究结果也表明,AgCl/ZnO/GO是一种比较稳定的光催化剂,在较广的pH范围内均能保持一定的催化活性,具有实际应用的前景.
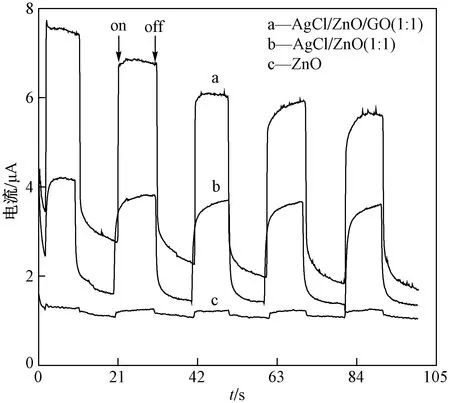
注:on、off分别表示灯的开、关.图8 可见光照射下不同材料的光电流Fig.8 Transient photocurrent responses of differentnanocomposites under visible light irradiation
表1 7种材料对MO去除率的比较
Table 1 Removal rates of methyl orange with seven materials
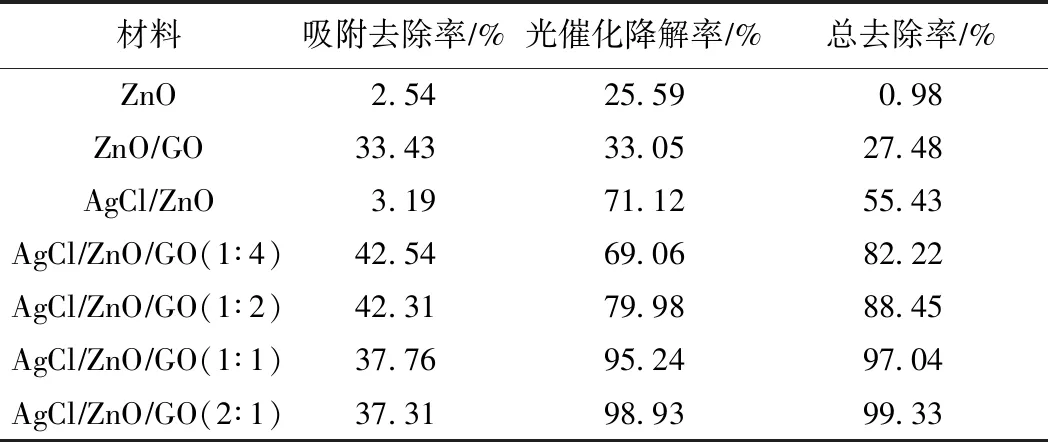
材料吸附去除率∕%光催化降解率∕%总去除率∕%ZnO2.5425.590.98ZnO∕GO33.4333.0527.48AgCl∕ZnO3.1971.1255.43AgCl∕ZnO∕GO(1∶4)42.5469.0682.22AgCl∕ZnO∕GO(1∶2)42.3179.9888.45AgCl∕ZnO∕GO(1∶1)37.7695.2497.04AgCl∕ZnO∕GO(2∶1)37.3198.9399.33
催化剂用量mg:1—10;2—20;3—30;4—40;5—50;6—70;7—90.图9 催化剂用量对MO光催化降解率的影响Fig.9 Influence of the catalyst dosage on photocatalytic degradation rate of methyl orange

pH:1—4;2—6;3—7;4—8;5—10.图10 不同pH对MO光催化降解率的影响Fig.10 Influence of pH on photocatalytic degradation rate of methyl orange
2.2.5催化剂重复利用性能
AgCl/ZnO/GO光催化材料重复利用4次后对MO的降解率分别为98.97%、93.68%、91.22%、88.78%,随着重复利用次数的增加,光催化材料对MO的可见光降解率略有降低,但经过4次重复利用后其对MO降解率仍能保持在88%以上.AgCl在重复利用过程中仍会光解[30],AgCl不断进行光解,将影响AgCl/ZnO异质结的形态结构,降低电子转移效率,增加光生电子-空穴的复合率,这也将导致光催化材料在重复利用过程中的光催化降解效率有所降低[31],该结论与图8所示的随着光照次数的增加,光催化材料光响应强度降低的结论一致.综上可知,AgCl/ZnO/GO在重复利用过程中的光催化降解效率有所降低,但总体而言其重复利用性较好.
2.3 光催化机理
ZnO的禁带宽度比较宽,只能吸收能量较高的紫外光而对可见光没有吸收,但当ZnO与AgCl形成异质结再与GO复合后,光催化材料对光的吸收拓宽到可见光区,而且AgCl是一种光敏材料,它在光照后会分解,产生少量的Ag原子簇,当Ag原子簇产生后,AgCl可以通过自身光敏化作用将光的吸收范围从紫外光区域红移至可见光区域;同时在可见光照射下,Ag原子簇还可以通过表面等离子体共振(SPR)效应产生光生电子-空穴[32].在半导体-半导体光催化材料中,光生电子会从导带能量较高的半导体迁移到能量较低的半导体上,所以在AgCl和ZnO结合后,Ag原子簇产生的光生电子转移到AgCl导带(-3.3 eV,绝对真空能级),然后再转移到ZnO导带(-4.3 eV,绝对真空能级)[33],ZnO能起到转移电子和提供反应活性位点的作用.由于AgCl/ZnO/GO光催化材料中有GO,它作为电子受体和转运体在光催化材料中能抑制光生电子-空穴的重组,进而提高光催化效率,而且它具有较大的表面积,有利于染料和氧的吸附和传质[34].最终光生电子分别在ZnO和氧化石墨烯(GO)表面被电子受体(如O2、H2O)捕获而产生一系列活性基团(如·O2-、·OH),产生的光生空穴则会与材料表面的OH-、Cl-反应产生·OH和Cl0,这些活性物质具有强氧化性[35],能氧化降解体系中的染料污染物.可见光照射下,AgCl/ZnO/GO的反应机理如图11所示,其具体反应过程如式(4)~(12)所示.
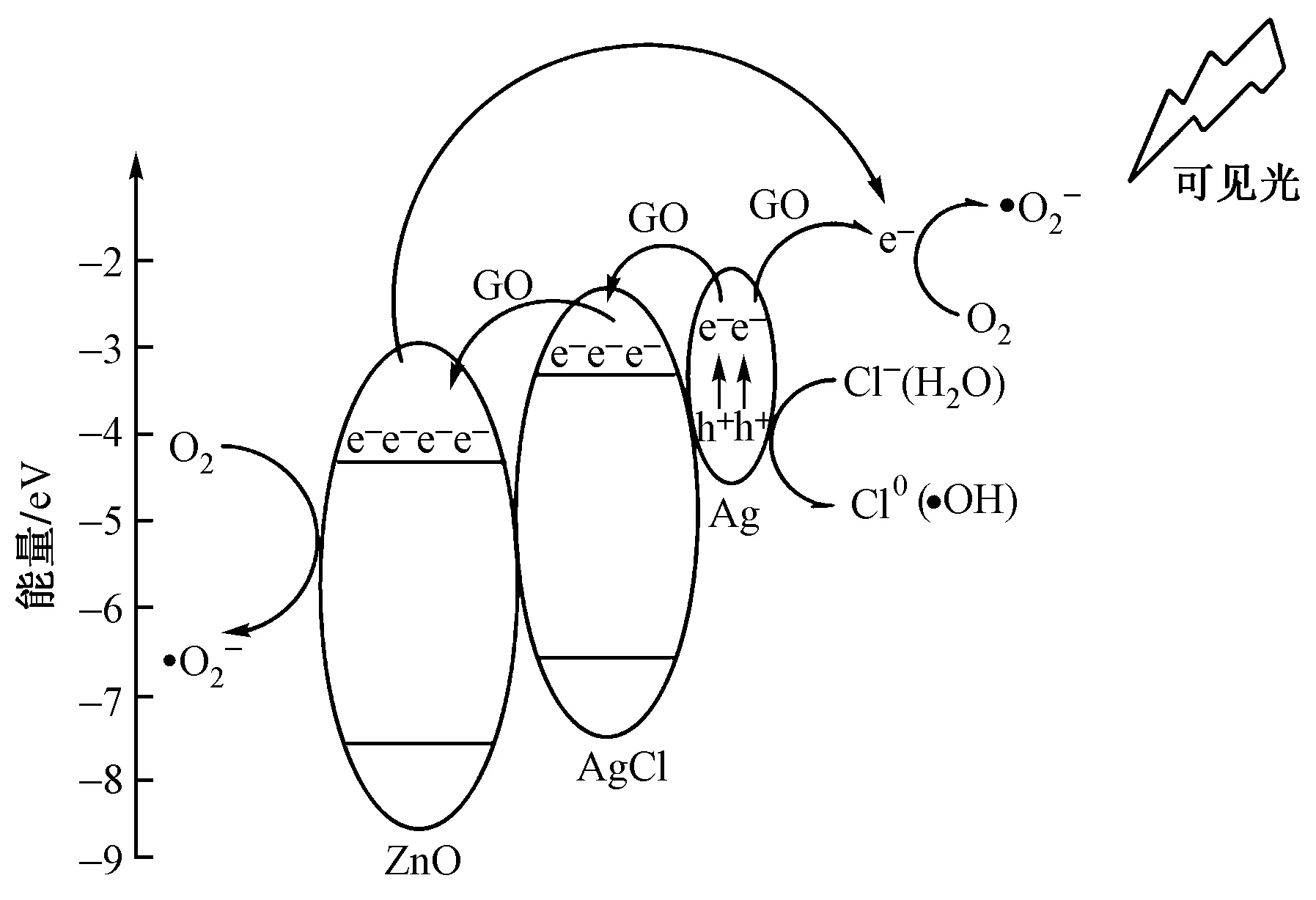
图11 可见光照射下AgClZnOGO的反应机理Fig.11 Reaction mechanism of AgClZnOGO under visible light irradiation
(4)
Ag*(e-)+AgCl→Ag+AgCl(e-);
Ag*(e-)+GO→Ag+GO(e-)
(5)
AgCl(e-)+ZnO→AgCl+ZnO(e-)
(6)
ZnO(e-)+O2→ZnO+·O2-
(7)
ZnO(e-)+GO→ZnO+GO(e-);
GO(e-)+O2→GO+·O2-
(8)
·O2-+2H+→·OH+OH-
(9)
Ag*(h+)+Cl-→Ag+Cl0
(10)
Ag*(h+)+H2O→Ag+·OH+OH-;
Ag*(h+)+OH-→Ag+·OH
(11)
Ag*(h+)、·OH、Cl0、·O2-+MO→H2O+CO2+Cl-
(12)
3 结论
a) SEM、XRD、XPS表征结果显示,该试验成功地制备了AgClZnOGO光催化材料;由UV-Vis和光电流结果可知,与ZnO和AgClZnO相比,AgClZnOGO对可见光的吸收增加,光生电子-空穴的产生分离效率提高.
