基于FAERS的新型冠状病毒肺炎治疗用药安全信号挖掘研究:α-干扰素*
2020-04-29吴斌肖桂荣罗敏胡巧织吴逢波徐珽
吴斌,肖桂荣,罗敏,胡巧织,吴逢波,徐珽
(四川大学华西医院临床药学部,成都 610041)
2020年1月20日,国家卫生健康委员会(下文简称“国家卫健委”)将新型冠状病毒感染的肺炎纳入《中华人民共和国传染病防治法》乙类传染病,并采取甲类传染病的预防和控制措施管理[1],随后将“新型冠状病毒感染的肺炎”命名为“新型冠状病毒肺炎(Novel Coronavirus Pneumonia,NCP)”[2],世界卫生组织(WHO)命名为COVID-19。
对COVID-19目前尚无特效疫苗及确认有效的抗病毒治疗药物。国家卫健委根据疫情变化及救治经验,先后发布七版《新型冠状病毒肺炎诊疗方案》(以下简称《方案》),指导COVID-19的临床科学、规范救治。《方案》第七版将α-干扰素、洛匹那韦/利托那韦、利巴韦林、磷酸羟氯喹和阿比多尔纳入了抗病毒治疗备选药物[3]。
α-干扰素(interferon-α,IFN-α)在临床主要经皮下、肌内或静脉给药,主要用于治疗病毒性疾病和恶性肿瘤。《方案》第七版推荐可试用IFN-α雾化吸入给药[3],属于超说明书用药范畴,临床在紧急情况下的药品特殊使用仍应加强管理,关注用药安全。
除药品说明书、文献报告之外,不良事件报告系统(adverse events reporting system,AERS)是药品安全性研究的重要数据来源。国内外也逐步形成了基于AERS大数据的不良事件信号挖掘方法,应用于药品上市后安全性监测。美国FDA的AERS(FAERS)因数据量大而且对公众免费开放[4],成为药品不良事件(adverse drug event,ADE)信号挖掘的应用最广泛的数据库之一。FAERS数据按季度更新,对公众免费开放。2020年2月6日最新一期(2019年第4季度)数据发布后,本研究团队第一时间获取数据,及时完成数据库更新及数据清洗工作。本研究拟基于FARES对IFN-α上市后不良事件进行安全信号挖掘,以期为COVID-19抗疫过程中IFN-α的安全使用提供参考数据。
1 数据与方法
1.1资料来源
1.1.1ADE数据源 数据来源于FAERS,该数据以ASCII或XML形式存储,本研究下载2004Q1至2019Q4,共64个季度的ASCII数据,选择个人信息记录(DEMO)、不良事件记录(REAC)、药物使用记录(DRUG)和事件结局(OUTC)数据表进行后续分析。
1.1.2数据清洗 根据FAERS说明文件去除DEMO表的重复报告,并映射到DRUG、REAC和OUTC表。采用Medex_UIMA_1.3.7系统对DRUG表中药品名称进行标准化处理,并赋予RxCUI编码[5]。FAERS不良事件数据采用《ICH国际医学用语词典》(Medical Dictionary for Regularly Activities,MedDRA)首选语(Preferred Terms,PT)编码。本研究下载MedDRA 21.1版,用于首选语(PT)、高位语(High Level Term,HLT)、高位组语(High Level Group Term,HLGT)、系统器官分类(System Organ Class,SOC)编码和语言汉化[6]。
1.1.3药品提取 限定上报药品的“ROLE_COD”为“首要怀疑药品(Primary Suspect Drug)”,模糊检索标准化的DRUG表中的所有干扰素(interferon)病例,剔除其中β-干扰素、γ-干扰素和PEG干扰素等,得到首要怀疑的IFN-α报告编码(PRIMARYID)和病例编码(CASEID)。
1.1.4ADE提取 根据1.1.3中得到的报告编码和病例编码映射REAC表,筛选出对应报告事件(PT),并通过SOC映射到系统分类。
1.2数据分析 采用比例失衡法(disproportionality methods)中的报告比值比法(reporting odds ratio,ROR)和比例报告比值法(proportional reporting ratio,PRR)进行信号检测。该方法基于四格表(表1),通过比较目标药品(IFN-α)的目标事件发生比例与其他所有药品的目标事件的发生比例(背景数据),以检测潜在ADE信号。PRR法报告数≥3,PRR≥2,且χ2≥4提示信号;ROR法双侧检验 95%CI下限>1提示信号[7],即药品和事件之间潜在关联性。计数资料采用例数和构成比描述。统计分析采用SPSS 20.0版软件和Microsoft Excel 2016版软件。
表1 比例失衡法四格表
Tab.1Four-foldtableofdisproportionalitymethods

目标事件报告数其他事件报告数小计IFN-αaba+b其他所有药品cdc+d小计a+cb+dN=a+b+c+d
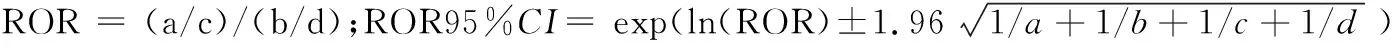

2 结果
2.1不良事件报告情况 经过数据清洗,共得药品不良事件报告11 450 529例,其中以IFN-α为首要怀疑药品的报告2 889例。男女比例为1.32。中位年龄55岁,18~64岁患者占53.96%。医师报告39.91%。来自美国的报告占58.81%。52.34%报告未说明给药途径,前3位分别为皮下、静脉和肌内给药,共占43.89%,未见经鼻给药报告。其余报告基本信息参见表2和图1。
表2 FAERS中IFN-α相关不良事件报告基本信息
Tab.2PrimaryinformationofIFN-αrelatedeventsreportedinFAERS
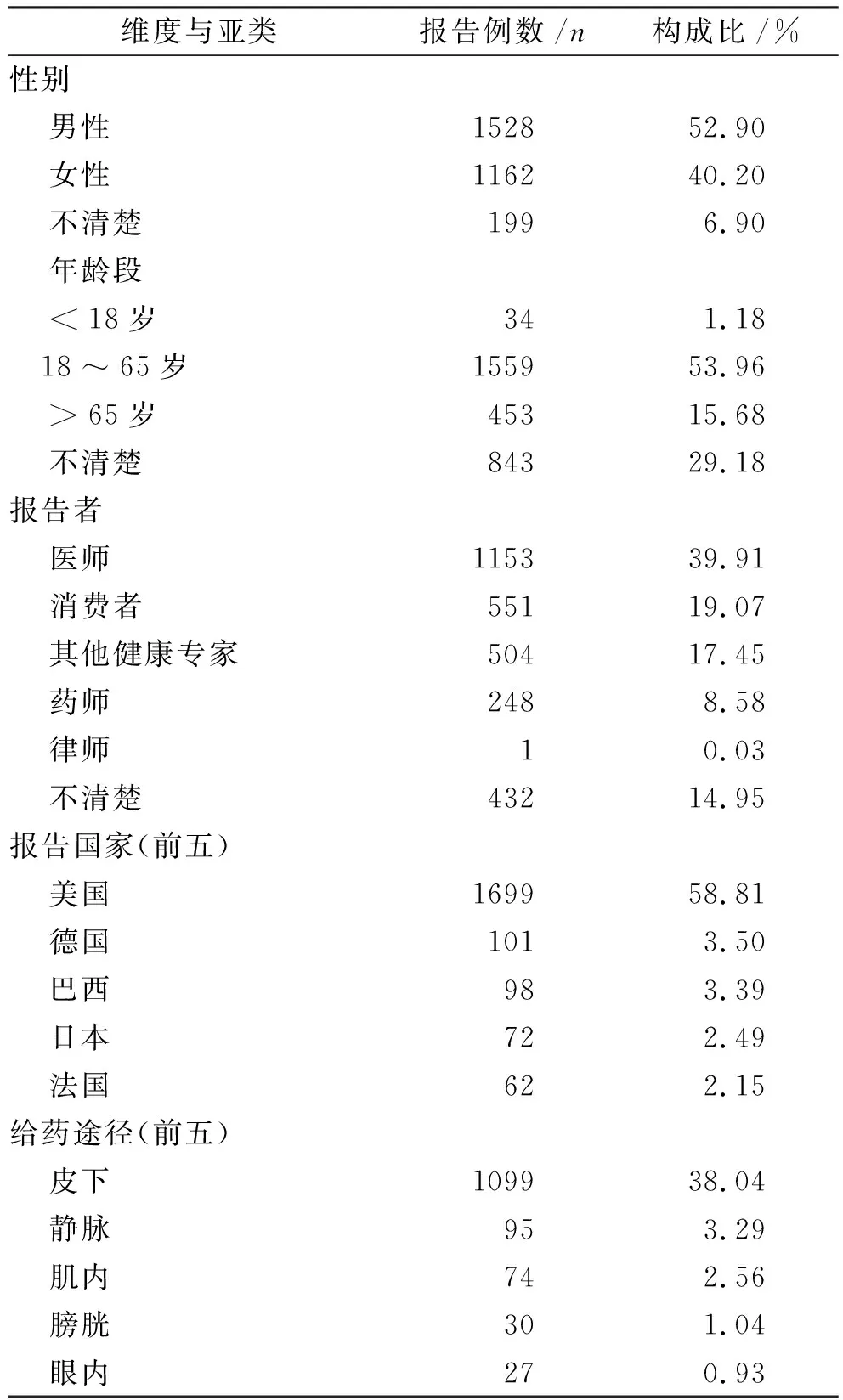
维度与亚类报告例数/n构成比/%性别 男性152852.90 女性116240.20 不清楚1996.90 年龄段 <18岁341.18 18~65岁155953.96 >65岁45315.68 不清楚84329.18报告者 医师115339.91 消费者55119.07 其他健康专家50417.45 药师2488.58 律师10.03 不清楚43214.95报告国家(前五) 美国169958.81 德国1013.50 巴西983.39 日本722.49 法国622.15给药途径(前五) 皮下109938.04 静脉953.29 肌内742.56 膀胱301.04 眼内270.93
2.2各SOC不良事件报告及信号情况 对以IFN-α为首要怀疑药品报告的事件(PT)进行信号分析,并映射得到对应的系统器官分类(SOC),表3列出各SOC下报告例数前3位的事件及信号分析结果(表中Y代表检出信号,N代表未检出信号),其中全身性及给药部位各种反应(如疲乏、发热、流感样症状)、各类检查(如中性粒细胞计数降低、体质量降低、血小板计数降低)、血液及淋巴系统事件(如贫血、中性粒细胞减少症、血小板减少症)报告例数相对较多,且其项下前3位事件均检出信号。

图1 FAERS中IFN-α相关不良事件逐年报告数量
Fig.1YearlyreportsofIFN-αrelatedeventsreportedinFAERS
2.3前20位信号事件 对以IFN-α为首要怀疑药品报告的事件(PT)分别采用PRR和ROR方法进行信号分析,前20位中检出“低磷酸盐血症”和“血清肌酸磷酸激酶升高”尚未收载于药品说明书。
2.4病例转归 对以IFN-α为首要怀疑药品报告的病例转归情况进行分析,结果见表5,其中273例(9.45%)患者最终死亡,另有91例(3.15%)为威胁生命事件。
3 讨论
IFN-α在临床主要用于慢性病毒性肝炎、淋巴或造血系统肿瘤以及某些实体肿瘤的治疗。本次研究纳入的以IFN-α为首要怀疑药品的2889例病例报告中,超过半数的病例来自美国报告,我国报告病例仅13例。病例中位年龄为55岁,18~64岁病例超过半数,因此从年龄分布来看,并非老年患者不良事件报告更为集中。而本次COVID-19危重症、死亡患者以老年或有基础疾病的患者为主,所以更应关注IFN-α使用过程中可能存在的安全问题[4]。
在本研究纳入的IFN-α报告中,以全身性及给药部位各种反应(如疲乏、发热、流感样症状)、各类检查、血液及淋巴系统事件报告例数相对较多,部分高频不良事件与COVID-19症状相似,临床可能存在误判风险。在报告例数前20位且检出信号的事件中,“低磷酸盐血症”和“血清肌酸磷酸激酶升高”尚未收载于药品说明书,可进一步设计前瞻性研究以探求因果关系。
IFN-α为I型干扰素,相对分子质量约19 300,主要采用皮下注射、肌内注射或静脉给药的方式给药。

表3 各SOC项下IFN-α报告例数前3位事件及其信号分析

续表3 各SOC项下IFN-α报告例数前3位事件及其信号分析
“Y”代表检出信号;“N”代表未检出信号。
“Y” respresents the detectted signal;“N”means the signal is not detected.

表4 FAERS中IFN-α报告例数前20位信号事件
①为说明书(以重组人α-干扰素-2a注射液(罗荛愫)、重组人α-干扰素-2b注射液(甘乐能)为例)尚未载入的不良事件。
①Adverse events that have not been listed in the label of recombinant human interferon α-2a injection (Roferon-A) and interferon α-2b injection (INTRONA).
因相对分子质量大,IFN-α雾化吸入给药,从肺部吸收很少,与皮下注射比较,相对生物利用度低。因此,理论上IFN-α雾化吸入不良事件发生率应低于传统给药方式。本次基于FAERS对IFN-α的数据挖掘过程中,未发现有雾化吸入给药的病例报告。当前IFN-α雾化吸入研究相对较少:有研究报告重组人IFN-α1b肌内注射对比雾化吸入治疗小儿病毒性肺炎[8],结果两组均未发现不良事件;另有研究报告IFN-α雾化吸入用于治疗小儿病毒性肺炎[9]、毛细支气管炎[10],结果显示不良事件表现为发热、萎靡不振、粒细胞减少、腹泻、皮疹,与本研究发现的高频不良事件相似。所以,本文分析结果虽更适用于IFN-α传统给药途径,但IFN-α雾化吸入给药仍可参考。
表5 FAERS中IFN-α相关不良事件报告病例转归情况
Tab.5OutcomeforpatientsofIFN-αrelatedeventsreportedinFAERS

患者转归报告例数/n构成比/%死亡2739.45威胁生命913.15导致入院或延长住院时间81128.07导致残疾582.01先天畸形20.07需要干预以预防永久性损伤140.48其他重要医学事件65922.81不清楚98133.96
在报告病例的转归情况分析中发现,死亡或威胁生命的事件超过10%,另有近30%的患者导致了入院或住院时间延长。这一方面与药品导致的不良事件或许相关,但更重要的应考虑到IFN-α的治疗受众人群,其中肿瘤患者的预后可能对患者转归有较大贡献。
本研究仍存在一定局限性。首先,限于FAERS数据来源多样性,部分数据项存在缺失,难以对每项指标都纳入所有病例进行分析。其次,由于自发呈报系统的低报漏报特点,可能存在信号低估可能。此外,虽然药品与不良事件存在统计学关联,但因果关系仍需进一步评估和验证。
综上所述,本研究基于FAERS大数据的信号挖掘方法,对COVID-19疫情中所用的治疗药物IFN-α不良事件进行了评价,全面展示IFN-α在各系统的高频报告事件及高频信号事件,以期促进IFN-α的安全使用。
